Степень окисления
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Когда атомы взаимодействуют и образуют химическую связь, электроны между ними в большинстве случаев распределяются неравномерно, поскольку свойства атомов различаются. Более электроотрицательный атом сильнее притягивает к себе электронную плотность. Атом, который притянул к себе электронную плотность, приобретает частичный отрицательный заряд δ — , его «партнер» — частичный положительный заряд δ+ . Если разность электроотрицательностей атомов, образующих связь, не превышает 1,7, мы называем связь ковалентной полярной . Если разность электроотрицательностей, образующих химическую связь, превышает 1,7, то такую связь мы называем ионной .
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Например , в связи H-Cl мы считаем, что водород условно «отдал» электрон, и его заряд стал +1, а хлор «принял» электрон, и его заряд стал -1. На самом деле таких полных зарядов на этих атомах нет.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
Например , для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N2H4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например : Ca 2+ , CO3 2- .
Для нахождения степеней окисления используют следующие правила :
- Степень окисления атомов в простых веществах равна нулю;
- В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
- Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
- Степень окисления водорода в соединениях с металлами (солеобразные гидриды — NaH, CaH2 и др.) равна -1; в соединениях с неметаллами (летучие водородные соединения) +1;
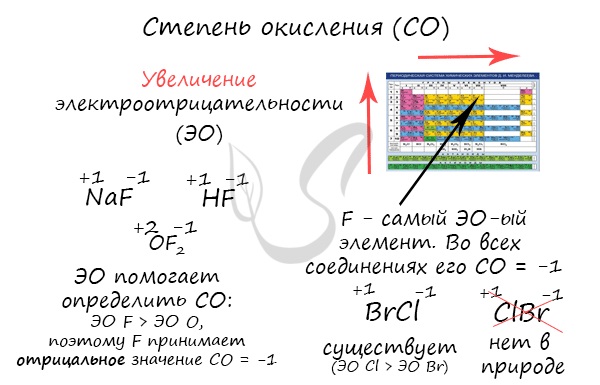
- Степень окисления кислорода равна -2. Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1, и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF2 и др.);
- Степень окисления фтора во всех сложных веществах равна -1.
Выше перечислены ситуации, когда степень окисления мы считаем постоянной . У всех остальных химических элементов степень окисления — переменная , и зависит от порядка и типа атомов в соединении.
Примеры :
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
Решение: степень окисления калия равна +1, степень окисления хрома обозначим, как х, степень окисления кислорода -2. Сумма всех степеней окисления всех атомов в молекуле равна 0. Получаем уравнение: +1*2+2*х-2*7=0. Решаем его, получаем степень окисления хрома +6.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
- В двойных (солеобразных) оксидах степень у атома, как правило, две степени окисления. Например, в железной окалине Fe3O4 у железа две степени окисления: +2 и +3. Какую из них указывать? Обе. Для упрощения можно представить это соединение, как соль: Fe(FeO2)2. При этом кислотный остаток образует атом со степенью окисления +3. Либо двойной оксид можно представить так: FeO*Fe2O3.
- В пероксосоединениях степень окисления атомов кислорода, соединенных ковалентными неполярными связями, как правило, изменяется. Например, в пероксиде водорода Н2О2, и пероксидах щелочных металлов степень окисления кислорода -1, т.к. одна из связей – ковалентная неполярная (Н-О-О-Н). Другой пример – пероксомоносерная кислота (кислота Каро) H2SO5 (см. рис.) содержит в составе два атома кислорода со степенью окисления -1, остальные атомы со степенью окисления -2, поэтому более понятной будет такая запись: H2SO3(O2). Известны также пероксосоединения хрома – например, пероксид хрома (VI) CrO(O2)2 или CrO5, и многие другие.
- Еще один пример соединений с неоднозначной степенью окисления – супероксиды (NaO2) и солеобразные озониды KO3. В этом случае уместнее говорить о молекулярном ионе O2 с зарядом -1 и и O3 с зарядом -1. Строение таких частиц описывается некоторыми моделями, которые в российской учебной программе проходят на первых курсах химических ВУЗов: МО ЛКАО, метод наложения валентных схем и др.
- В органических соединениях понятие степени окисления не очень удобно использовать, т.к. между атомами углерода существует большое число ковалентных неполярных связей. Тем не менее, если нарисовать структурную формулу молекулы, то степень окисления каждого атома также можно определить по типу и количеству атомов, с которыми данный атом непосредственно связан. Например, у первичных атомов углерода в углеводородах степень окисления равна -3, у вторичных -2, у третичных атомов -1, у четвертичных — 0.
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Источник
Валентность и степень окисления
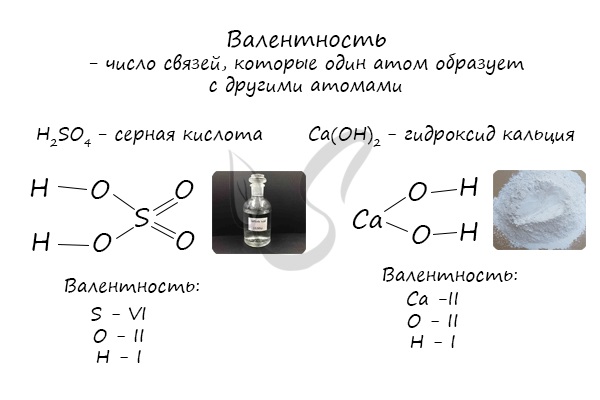
Валентность
Валентность (лат. valere — иметь значение) — мера «соединительной способности» химического элемента, равная числу индивидуальных химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
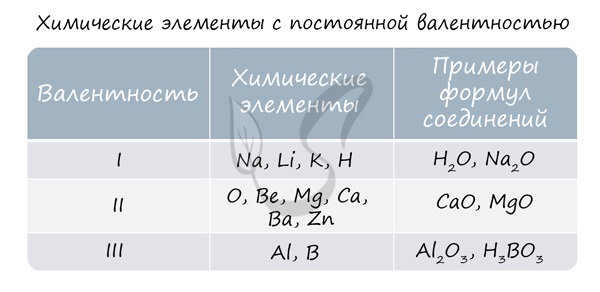
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
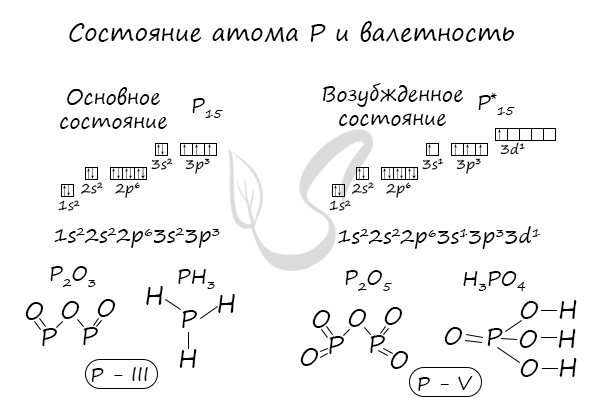
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие элементы — с постоянной валентностью.
Запомните, что у некоторых простых веществ валентность принимает значения: III — у азота, II — кислорода. Подведем итог полученным знаниям, написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.
Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N — III
- O — II
- H, Na, K, Li — I
- S — VI
- C — II (в угарном газе CO), IV (в углекислом газе CO2 и карбонате натрия Na2CO3
- Fe — II
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд «+», а другим «-«. Это связано с электроотрицательностью — способностью атома притягивать к себе электроны. Знак «+» означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное понятие.
Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток — получает знак «+».
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉
Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Источник
Высшая степень окисления
Понятие степень окисления
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
Положительная степень окисления обозначает число электронов, которые смещаются от данного атома, а отрицательная – число электронов, которые смещаются к данному атому.
Из этого определения следует, что в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений могут служить молекулы, состоящие из одинаковых атомов (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na +1 I -1 , Mg +2 Cl -1 2, Al +3 F -1 3, Zr +4 Br -1 4.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Высшая степень окисления
Для элементов, проявляющих в своих соединениях различные степени окисления, существуют понятия высшей (максимальной положительной) и низшей (минимальной отрицательной) степеней окисления. Высшая степень окисления химического элемента обычно численно совпадает с номером группы в Периодической системе Д. И. Менделеева. Исключения составляют фтор (степень окисления равна -1, а элемент расположен в VIIA группе), кислород (степень окисления равна +2, а элемент расположен в VIA группе), гелий, неон, аргон (степень окисления равна 0, а элементы расположены в VIII группе), а также элементы подгруппы кобальта и никеля (степень окисления равна +2, а элементы расположены в VIII группе), для которых высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе (максимальная положительная степень окисления меди и серебра равна +2, золота +3).
Источник