- Большая Энциклопедия Нефти и Газа
- Отрицательная теплота — образование
- Тепловое равновесие и уравнение теплового баланса
- Что такое теплообмен и при каких условиях он происходит
- Уравнение теплового баланса и сохранение тепловой энергии
- Уравнение теплового баланса
- Если несколько тел участвуют в процессе теплообмена
- Пример расчетов для теплообмена между холодным и горячим телом
- Задача для самостоятельного решения:
- Молекулярная физика. Плавление и кристаллизация.
- Плавление аморфных веществ .
- Теплота плавления .
- Теплота сгорания .
Большая Энциклопедия Нефти и Газа
Отрицательная теплота — образование
Отрицательные теплоты образования обусловлены именно этой исключительной прочностью кратных связей элементов первого периода, обусловливающей устойчивость основных состояний кислорода и особенно азота. [1]
Топливо может иметь небольшие отрицательные теплоты образования , но предпочтительно топливо с положительными те-плотами образования. [2]
Большинство соединений имеет отрицательную теплоту образования . [3]
С одной стороны, гидразин имеет значительную отрицательную теплоту образования . Поэтому распад его на элементы2 достаточно экзотермичен, чтобы можно было ожидать протекания его в форме самораспространяющегося процесса. [4]
В каждом случае транс-изомер обладает более высокой теплотой гидрирования, а поэтому и менее отрицательной теплотой образования , чем соответствующий цис-изомер. Теплоты изомерного превращения из трансизомера в ц с-изомер, вычисленные для восьми -, девяти — и десятичленных циклоолефинов, составляют соответственно — 9 2, — 2 9 и — 3 3 ккал / моль по сравнению с величиной в 1 0 ккал / моль для теплоты изомеризации гранс-бутена в цис-бутен. Разница в 9 ккал между теплотами гидрирования цис — и транс-циклооктена является самой большой из всех известных для любой пары цыс-гранс-изомеров и отражает сильную деформацию, сопровождающую включение двойной гране-связи в восьмичленное кольцо. Таким образом, у циклических олефинов более устойчивыми являются цис-изоме-ры, а у олефинов с прямой цепью наблюдается как раз обратная картина и наиболее устойчивыми будут транс-изомеры. У циклических соединений меньше проявляется угловая и торсионная деформация, когда для образования кольца используются с-связи. [5]
СО, СО2, SO2, CH2O, HCN, S, которые имеют подходящие отрицательные теплоты образования . [6]
Он содержит 51 4 % углерода; 8 6 % водорода; 40 0 % азота, имеет отрицательную теплоту образования , горит на воздухе почти бесцветным пламенем. Цементирующими свойствами уротропин: не обладает. [7]
В случае фторсодержащих соединений отщепление фтора наблюдается не всегда, тогда как потеря HF является более характерным процессом, по-видимому, благодаря особенно благоприятной отрицательной теплоте образования HF . Отщепление НС1 в хлорсодержащих соединениях более предпочтительно, чем отщепление НВг в соответствующих бромпроизводных. [9]
Если рассмотреть рис. 1а и 16, на которых представлены характеристики окислителей, то окажется, что моноокись фтора занимает особое положение. Необычная характеристика этого окислителя может быть объяснена частично его большой плотностью, а также отрицательной теплотой образования . Другим окислителем, выделяющимся среди топливных смесей, дающих большую скорость истечения струи, является элементарный фтор. [10]
Треххлористый азот неустойчив не вследствие слабости связей N — С1, а вследствие необычайной прочности тройной связи в Na — В NF3 энергия резонанса с ионным состоянием в связях N — F достаточно велика для ( того, чтобы преодолеть это, и молекула имеет положительную теплоту образования. В F2O и С12О ( с JCA-лгв 0 5) ионный характер недостаточен для преодоления потери в — 24 2 ккал / мол для атома кислорода. Эти вещества имеют небольшие отрицательные теплоты образования . [11]
Существенное значение при горении смесей имеет их агрегатное состояние, в частности образование жидкого слоя. Однако не всегда его наличие будет определяющим, в некоторых случаях решающую роль может играть химическая природа горючего, в частности его способность связывать активные промежуточные продукты. Хотя последний легко плавится и окисляется и имеет отрицательную теплоту образования , его смесь с перхлоратом ( рис. 103, кривая 3) в диапазоне давлений до 150 ат и выше 600 ат горит с меньшей скоростью, чем чистый перхлорат. Добавление к этой смеси наиболее эффективных катализаторов горения перхлората аммония — бихромата калия и оксина-та меди — приводит к существенному увеличению скорости горения. При этом в интервале давлений до 100 ат действие неорганического и органического катализаторов ( см. рис. 103, кривые 1, 2) практически равнозначно, при более высоких давлениях оксинат меди значительно более эффективен. [13]
Согласно взглядам Волькенштейна, микродефекты имеют как биографическое, так и тепловое происхождение. Для создания дефектов последнего типа может потребоваться затрата определенного количества энергии. Хемосорбция представляет собой реакцию между хемосорбируемым атомом и микродефектом. Теплота хемосорбции равна алгебраической сумме теплот этих элементарных реакций и отрицательных теплот образования новых ( тепловых) микродефектов, которые образуют новые адсорбционные участки. Эта концепция исходит из того, что поверхность по существу не является неоднородной, а наблюдаемая неоднородность создается в результате хемосорбционного процесса. Поскольку при этом расходуется энергия, теплота хемосорбции падает с заполнением. [14]
Последние обладают подвижностью, которая характеризуется энергией активации. Они способны взаимодействовать друг с другом и могут создавать новые микродефекты, когда на них происходит хемосорбция. Поэтому в указанной работе вместо концепции активных центров, согласно которой последние принимаются закрепленными на определенных участках, развивается представление о нелокализованных активных центрах. Тейлор [227] отмечает, что подобные активные центры могут действовать на поверхности реальных катализаторов и на поверхности металлов, покрытых примесями. Согласно взглядам Волькенштейна, микродефекты имеют как биографическое, так и тепловое происхождение. Для создания дефектов последнего типа может потребоваться затрата определенного количества энергии. Хемосорбция представляет собой реакцию между хемосорбируемым атомом и микродефектом. Теплота хемосорбции равна алгебраической сумме теплот этих элементарных реакций и отрицательных теплот образования новых ( тепловых) микродефектов, которые образуют новые адсорбционные участки. Эта концепция сходит из того, что поверхность по существу не является неоднородной, а наблюдаемая неоднородность создается в результате хемосорбционного процесса. Поскольку при этом расходуется энергия, теплота хемосорбции падает с заполнением. [15]
Источник
Тепловое равновесие и уравнение теплового баланса
Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
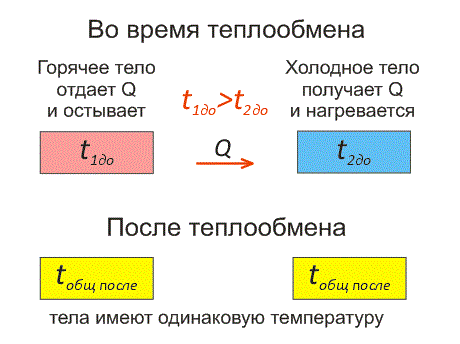
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
\(\large Q_<\text<остывания горяч>> \left( \text <Дж>\right) \) – это количество теплоты горячее тело теряет.
\(\large Q_<\text<нагревания холод>> \left( \text <Дж>\right) \) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
\[\large Q_ <1>+ Q_ <2>= 0 \]
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
- равными по модулю и
- имеют различные знаки (одно число — знак «плюс», а второе – знак «минус»).
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
\[\large \boxed < Q_<1>+ Q_ <2>+ Q_ <3>+ \ldots + Q_
- Q для каждого нагреваемого тела будет обладать знаком «+»,
- Q для каждого охлаждаемого тела — знаком «-».
Пример расчетов для теплообмена между холодным и горячим телом
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
2). Теперь запишем формулу для каждого количества теплоты:
Примечания:
- \(\large c_<\text<воды>> \) – удельную теплоемкость воды находим в справочнике;
- Массу воды переводим в килограммы;
- Горячая вода остывает и отдает тепловую энергию. Поэтому, разность \(\large (t_<\text<общ>> — t_<\text<горяч>> ) \) будет иметь знак «минус», потому, что конечная температура горячей воды меньше ее начальной температуры;
- Холодная вода получает тепловую энергию и нагревается. Из-за этого, разность \(\large (t_<\text<общ>> — t_<\text<холодн>> ) \) будет иметь знак «плюс», потому, что конечная температура холодной воды больше ее начальной температуры;
3). Подставим выражения для каждого Q в уравнение баланса:
4). Для удобства, заменим символы числами:
\[\large 4200 \cdot 0,2 \cdot (t_<\text<общ>> — 80 ) + 4200 \cdot 0,1 \cdot (t_<\text<общ>> — 15 ) = 0 \]
\[\large 840 \cdot (t_<\text<общ>> — 80 ) + 420 \cdot (t_<\text<общ>> — 15 ) = 0 \]
Раскрыв скобки и решив это уравнение, получим ответ:
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
- \(\large Q_ <1>\) – охлаждение алюминия от температуры +80 градусов до конечной температуры;
- \(\large Q_ <2>\) – охлаждение керосина от температуры +80 градусов до конечной температуры;
- \(\large Q_ <3>\) – нагревание свинца от температуры +20 градусов до конечной температуры;
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
Источник
Молекулярная физика. Плавление и кристаллизация.
Переход вещества из твердого кристаллического состояния в жидкое называется плавлением. Чтобы расплавить твердое кристаллическое тело, его нужно нагреть до определенной температуры, т. е. подвести тепло. Температура, при которой вещество плавится, называется температурой плавления вещества.
Обратный процесс — переход из жидкого состояния в твердое — происходит при понижении температуры, т. е. тепло отводится. Переход вещества из жидкого состояния в твердое называется отвердеванием, или кристал лизацией. Температура, при которой вещество кристаллизуется, называется температурой кристалли зации.
Опыт показывает, что любое вещество кристаллизуется и плавится при одной и той же температуре.
На рисунке представлен график зависимости температуры кристаллического тела (льда) от времени нагревания (от точки А до точки D) и времени охлаждения (от точки D до точки K). На нем по горизонтальной оси отложено время, а по вертикальной — температура.
Из графика видно, что наблюдение за процессом началось с момента, когда температура льда была -40 °С, или, как принято говорить, температура в начальный момент времени tнач = -40 °С (точка А на графике). При дальнейшем нагревании температура льда растет (на графике это участок АВ). Увеличение температуры происходит до 0 °С — температуры плавления льда. При 0°С лед начинает плавиться, а его температура перестает расти. В течение всего времени плавления (т.е. пока весь лед не расплавится) температура льда не меняется, хотя горелка продолжает гореть и тепло, следовательно, подводится. Процессу плавления соответствует горизонтальный участок графика ВС. Только после того как весь лед расплавится и превратится в воду, температура снова начинает подниматься (участок CD). После того, как температура воды достигнет +40 °С, горелку гасят и воду начинают охлаждать, т. е. тепло отводят (для этого можно сосуд с водой поместить в другой, больший сосуд со льдом). Температура воды начинает снижаться (участок DE). При достижении температуры 0 °С температура воды перестает снижаться, несмотря на то, что тепло по-прежнему отводится. Это идет процесс кристаллизации воды — образования льда (горизонтальный участок EF). Пока вся вода не превратится в лед, температура не изменится. Лишь после этого начинает уменьшаться температура льда (участок FK).
Вид рассмотренного графика объясняется следующим образом. На участке АВ благодаря подводимому теплу средняя кинетическая энергия молекул льда увеличивается, и температура его повышается. На участке ВС вся энергия, получаемая содержимым колбы, тратится на разрушение кристаллической решетки льда: упорядоченное пространственное расположение его молекул сменяется неупорядоченным, меняется расстояние между молекулами, т.е. происходит перестройка молекул таким образом, что вещество становится жидким. Средняя кинетическая энергия молекул при этом не меняется, поэтому неизменной остается и температура. Дальнейшее увеличение температуры расплавленного льда-воды (на участке CD) означает увеличение кинетической энергии молекул воды вследствие подводимого горелкой тепла.
При охлаждении воды (участок DE) часть энергии у нее отбирается, молекулы воды движутся с меньшими скоростями, их средняя кинетическая энергия падает — температура уменьшается, вода охлаждается. При 0°С (горизонтальный участок EF) молекулы начинают выстраиваться в определенном порядке, образуя кристаллическую решетку. Пока этот процесс не завершится, температура вещества не изменится, несмотря на отводимое тепло, а это означает, что при отвердевании жидкость (вода) выделяет энергию. Это как раз та энергия, которую поглотил лед, превращаясь в жидкость (участок ВС). Внутренняя энергия у жидкости больше, чем у твердого тела. При плавлении (и кристаллизации) внутренняя энергия тела меняется скачком.
Металлы, плавящиеся при температуре выше 1650 ºС, называют тугоплавкими (титан, хром, молибден и др.). Самая высокая температура плавления среди них у вольфрама — около 3400 °С. Тугоплавкие металлы и их соединения используют в качестве жаропрочных материалов в самолетостроении, ракетостроении и космической технике, атомной энергетике.
Подчеркнем еще раз, что при плавлении вещество поглощает энергию. При кристаллизации оно, наоборот, отдает ее в окружающую среду. Получая определенное количество теплоты, выделяющееся при кристаллизации, среда нагревается. Это хорошо известно многим птицам. Недаром их можно заметить зимой в морозную погоду сидящими на льду, который покрывает реки и озера. Из-за выделения энергии при образовании льда воздух над ним оказывается на несколько градусов теплее, чем в лесу на деревьях, и птицы этим пользуются.
Плавление аморфных веществ .
Наличие определенной точки плавления — это важный признак кристаллических веществ. Именно по этому признаку их можно легко отличить от аморфных тел, которые также относят к твердым телам. К ним, в частности, относятся стекла, очень вязкие смолы, пластмассы.
Аморфные вещества (в отличие от кристаллических) не имеют определенной температуры плавления — они не плавятся, а размягчаются. При нагревании кусок стекла, например, сначала становится из твердого мягким, его легко можно гнуть или растягивать; при более высокой температуре кусок начинает менять свою форму под действием собственной тяжести. По мере нагревания густая вязкая масса принимает форму того сосуда, в котором лежит. Эта масса сначала густая, как мед, затем — как сметана и, наконец, становится почти такой же маловязкой жидкостью, как вода. Однако указать определенную температуру перехода твердого тела в жидкое здесь невозможно, поскольку ее нет.
Причины этого лежат в коренном отличии строения аморфных тел от строения кристаллических. Атомы в аморфных телах расположены беспорядочно. Аморфные тела по своему строению напоминают жидкости. Уже в твердом стекле атомы расположены беспорядочно. Значит, повышение температуры стекла лишь увеличивает размах колебаний его молекул, дает им постепенно все большую и большую свободу перемещения. Поэтому стекло размягчается постепенно и не обнаруживает резкого перехода «твердое—жидкое», характерного для перехода от расположения молекул в строгом порядке к беспорядочному.
Теплота плавления .
Теплота плавления — это количество теплоты, которое необходимо сообщить веществу при постоянном давлении и постоянной температуре, равной температуре плавления, чтобы полностью перевести его из твердого кристаллического состояния в жидкое. Теплота плавления равна тому количеству теплоты, которое выделяется при кристаллизации вещества из жидкого состояния. При плавлении вся подводимая к веществу теплота идет на увеличение потенциальной энергии его молекул. Кинетическая энергия не меняется, поскольку плавление идет при постоянной температуре.
Изучая на опыте плавление различных веществ одной и той же массы, можно заметить, что для превращения их в жидкость требуется разное количество теплоты. Например, для того чтобы расплавить один килограмм льда, нужно затратить 332 Дж энергии, а для того чтобы расплавить 1 кг свинца — 25 кДж.
Физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления полностью перевести его в жидкое состояние, называется удельной теплотой плавления.
Удельную теплоту плавления измеряют в джоулях на килограмм (Дж/кг) и обозначают греческой буквой λ (лямбда).
Удельная теплота кристаллизации равна удельной теплоте плавления, поскольку при кристаллизации выделяется такое же количество теплоты, какое поглощается при плавлении. Так, например, при замерзании воды массой 1 кг выделяются те же 332 Дж энергии, которые нужны для превращения такой же массы льда в воду.
Чтобы найти количество теплоты, необходимое для плавления кристаллического тела произвольной массы, или теплоту плавления, надо удельную теплоту плавления этого тела умножить на его массу:
Количество теплоты, выделяемое телом, считается отрицательным. Поэтому при расчете количества теплоты, выделяющегося при кристаллизации вещества массой m, следует пользоваться той же формулой, но со знаком «минус»:
Теплота сгорания .
Теплота сгорания (или теплотворная способность, калорийность) — это количество теплоты, выделяющейся при полном сгорании топлива.
Для нагревания тел часто используют энергию, выделяющуюся при сгорании топлива. Обычное топливо (уголь, нефть, бензин) содержит углерод. При горении атомы углерода соединяются с атомами кислорода, содержащегося в воздухе, в результате чего образуются молекулы углекислого газа. Кинетическая энергия этих молекул оказывается большей, чем у исходных частиц. Увеличение кинетической энергии молекул в процессе горения называют выделением энергии. Энергия, выделяющаяся при полном сгорании топлива, и есть теплота сгорания этого топлива.
Теплота сгорания топлива зависит от вида топлива и его массы. Чем больше масса топлива, тем больше количество теплоты, выделяющейся при его полном сгорании.
Физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой 1 кг, называется удельной теплотой сгорания топлива. Удельную теплоту сгорания обозначают буквой q и измеряют в джоулях на килограмм (Дж/кг).
Количество теплоты Q, выделяющееся при сгорании m кг топлива, определяют по формуле:
Чтобы найти количество теплоты, выделяющееся при полном сгорании топлива произвольной массы, нужно удельную теплоту сгорания этого топлива умножить на его массу.
Источник