- Теплообменом с окружающей средой пренебречь что это значит
- 10 класс
- § 54. Кипение жидкости
- Исследования физических явлений опытным путём
- Вопросы:
- Вопросы для обсуждения:
- Пример решения задачи
- Упражнения:
- Тепловое равновесие и уравнение теплового баланса
- Что такое теплообмен и при каких условиях он происходит
- Уравнение теплового баланса и сохранение тепловой энергии
- Уравнение теплового баланса
- Если несколько тел участвуют в процессе теплообмена
- Пример расчетов для теплообмена между холодным и горячим телом
- Задача для самостоятельного решения:
Теплообменом с окружающей средой пренебречь что это значит
3 литра воды, взятой при температуре 20°С, смешали с водой, температура которой была равна 100°С. Температура смеси оказалась равной 40°С. Чему равна масса горячей воды? Теплообменом с окружающей средой пренебречь.
= 1000 кг/м 3 ; V1 = 3 л = 0,003 м 3 ; t1 = 20°С; t2 = 100°С; t = 40°С
Масса холодной воды: Закон теплового баланса:
где c — удельная теплоёмкость воды. Отсюда:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Приведено полное правильное решение, включающее следующие элементы: 1) верно записано краткое условие задачи; 2) записаны уравнения и формулы, применение которых необходимо и достаточно для решения задачи выбранным способом; 3) выполнены необходимые математические преобразования и расчёты, приводящие к правильному числовому ответу, и представлен ответ. При этом допускается решение «по частям» (с промежуточными вычислениями). | 3 |
| Правильно записаны необходимые формулы, проведены вычисления, и получен ответ (верный или неверный), но допущена ошибка в записи краткого условия или переводе единиц в СИ. Представлено правильное решение только в общем виде, без каких-либо числовых расчётов. Источник 10 класс§ 54. Кипение жидкостиПроцесс кипения жидкости. Процесс испарения может происходить не только с поверхности жидкости, но и по всему её объёму. В этом случае при некоторой температуре наблюдается кипение жидкости (рис. 8.6). Исследования физических явлений опытным путёмПроследим за нагреванием воды в стеклянном сосуде. Сначала дно и стенки сосуда покроются маленькими пузырьками. Их появление объясняется выделением воздуха, растворённого в воде. В воде (а также в любой другой жидкости) всегда имеется некоторое количество растворённого воздуха. Этим воздухом дышат рыбы и другие живые существа, обитающие в воде. Так как внутри каждого пузырька происходит испарение воды, то, кроме воздуха, пузырьки содержат насыщенный водяной пар. При повышении температуры пузырьки, заполненные воздухом и паром, увеличиваются в размерах (рис. 8.7, а); их количество увеличивается. C увеличением объёма пузырьков возрастает действующая на них выталкивающая (архимедова) сила. В некоторый момент времени она отрывает пузырёк от стенок. При этом между пузырьком и дном сосуда образуется всё суживающаяся воздушная перемычка (рис. 8.7, б). Наконец, пузырёк отрывается, оставляя у дна небольшое количество воздуха, из которого с течением времени образуется новый пузырёк. Поднимающийся пузырёк, попадая в верхние, более холодные слои воды, уменьшается в размере, так как содержащийся в нём пар конденсируется (рис. 8.7, в). Давление в пузырьке стремительно падает, и пузырёк «схлопывается». «Схлопывание» происходит настолько быстро, что стенки пузырька, сталкиваясь, производят нечто вроде маленького взрыва. Мы слышим, как закипающая вода шумит. Когда вся вода достаточно прогреется, поднимающиеся пузырьки уже не будут уменьшаться в размерах и достигают поверхности, выбрасывая пар во внешнее пространство (рис. 8.7, г). Шум при этом прекращается и начинается «бульканье» — вода кипит. Кипение — это переход жидкости в пар, происходящий с образованием пузырьков пара по всему объёму жидкости или на поверхности сосуда. Термометр, помещённый в пар над кипящей водой, всё время, пока вода кипит, показывает одну и ту же температуру (около 100 °C). Эта температура не изменится, пока вся вода не выкипит. Кипение происходит при такой температуре, когда давление насыщенных паров сравнивается с давлением внутри жидкости. Температуру, при которой жидкость кипит, называют температурой кипения. Она зависит от рода жидкости. Зависимость температуры кипения жидкости от внешнего давления. Температура кипения жидкости зависит от внешнего давления. Чем больше внешнее давление, тем выше температура кипения. Так, в паровом котле при давлении, достигающем 1,6 ∙ 10 6 Па, вода не кипит и при температуре, равной 200 °C. В медицинских учреждениях кипение воды в герметически закрытых сосудах — автоклавах (рис. 8.8) также происходит при повышенном давлении. Поэтому температура кипения значительно выше 100 °C. Автоклавы применяют для стерилизации хирургических инструментов, перевязочного материала и т. д. И наоборот, уменьшая внешнее давление, мы тем самым понижаем температуру кипения. Под колоколом воздушного насоса можно заставить воду кипеть при комнатной температуре (рис. 8.9). При подъёме в горы атмосферное давление уменьшается, поэтому уменьшается температура кипения. На высоте 7134 м (пик Ленина на Памире) давление приближённо равно 4 ∙ 10 1 Па (300 мм рт. ст.). Вода кипит там примерно при температуре, равной 70 °C. На рисунке 8.10 приведён график зависимости температуры кипения воды от внешнего давления. Он является одновременно и графиком, выражающим зависимость давления насыщенного водяного пара от температуры. Удельная теплота парообразования жидкости. Как вы уже знаете, испарение жидкости сопровождается её охлаждением. Для поддержания температуры испаряющейся жидкости неизменной к ней необходимо подводить извне количество теплоты. Многочисленные опыты подтверждают, что для превращения жидкости в пар путём испарения или кипения требуется определённое количество теплоты. На что расходуется подводимая к телу энергия? Прежде всего, на увеличение его внутренней энергии при переходе из жидкого состояния в газообразное. При этом увеличивается объём вещества: от объёма жидкости до объёма насыщенного пара. Следовательно, увеличиваются среднее расстояние между молекулами и их потенциальная энергия. Кроме того, при увеличении объёма вещества совершается работа против сил внешнего давления. Зависимость количества теплоты, необходимого для парообразования жидкости, от её рода характеризуется физической величиной, называемой удельной теплотой парообразования. Удельной теплотой парообразования данной жидкости называют отношение количества теплоты, требующегося для превращения данной массы жидкости в пар при постоянной температуре и постоянном давлении, к массе жидкости. где r — удельная теплота парообразования жидкости; m — масса жидкости; Qп — количество теплоты, необходимое для её парообразования. Единицей удельной теплоты парообразования в СИ является джоуль на килограмм (Дж/кг). Удельная теплота парообразования воды очень велика: 2,26 ∙ 10 6 Дж/кг при температуре 100 °C и нормальном атмосферном давлении. Это означает, что для превращения воды массой 1 кг в пар при температуре 100 °C и нормальном атмосферном давлении требуется 2,26 ∙ 10 6 Дж энергии. При этом внутренняя энергия пара массой 1 кг при 100 °C больше внутренней энергии 1 кг воды при той же температуре на 2,26 ∙ 10 6 Дж. У других жидкостей (спирт, эфир, ртуть, керосин и др.) удельная теплота парообразования меньше в 3 — 10 раз. Для одной и той же жидкости удельная теплота парообразования при разных температурах имеет разное значение. При повышении температуры удельная теплота парообразования уменьшается, так как с ростом температуры уменьшается разность между объёмом жидкости и объёмом её насыщенного пара. Поэтому уменьшается изменение внутренней энергии и работа против сил внешнего давления. Количество теплоты, необходимое для парообразования жидкости, в соответствии с выражением (1) равно: Согласно закону сохранения энергии, при конденсации пара происходит выделение такого же количества теплоты, какое было затрачено при парообразовании той же массы жидкости при той же температуре: Формулы (2) и (3) используют при записи уравнений теплового баланса в тех случаях, когда мы рассматриваем явления парообразования и конденсации. Вопросы:1. Объясните процесс кипения с молекулярно-кинетической точки зрения. 2. Как зависит температура кипения жидкости от внешнего давления? Для чего используют автоклавы? 3. Для превращения жидкости в пар путём испарения или кипения требуется определённое количество теплоты. На что оно расходуется? 4. Что называют удельной теплотой парообразования жидкости? Вопросы для обсуждения:1. Как изменяется потенциальная энергия взаимодействия молекул тела при: 2. Пробирка наполнена водой и открытым концом опущена в стакан с водой. Изменится ли уровень воды в пробирке, если установку нагреть до температуры кипения воды? 3. Можно ли осуществить процесс кипения жидкости в условиях невесомости? Пример решения задачиВ сосуд, содержащий 0,5 кг воды при температуре 16 °C, впускают 75 г стоградусного водяного пара при нормальном атмосферном давлении. Определите установившуюся температуру в сосуде. Теплообменом с окружающей средой пренебречь. После этого вода массой m1 нагревается от t1 до θ. Для этого необходимо затратить, количество теплоты Q3: По условию задачи система теплоизолирована, поэтому уравнение теплового баланса имеет вид: Подставляя в это уравнение выражения для количеств теплоты Q1, Q2 и Q3, получим: C учётом числовых данных запишем: Ответ: θ ≈ 97 °C. Упражнения:1. В сосуд, содержащий 30 л воды, впускают 1,85 кг стоградусного водяного пара при нормальном атмосферном давлении. В сосуде установилась температура, равная 37 °C. Чему равна первоначальная температура воды? Теплоёмкостью сосуда пренебречь. 2. В латунный калориметр массой 0,2 кг, содержащий 0,35 кг воды при 8 °C, впускают пар при температуре 100 °C при нормальном атмосферном давлении. Сколько пара впустили, если в калориметре установилась температура, равная 40 °C? 3. В 1 л воды при температуре 20 °C и нормальном атмосферном давлении бросили кусок железа массой 0,1 кг, нагретый до температуры 500 °C. При этом некоторое количество воды испарилось. Определите, сколько воды испарилось, если установившаяся температура воды равна 24 °C. 4. В воду массой 12 кг впускают 1 кг пара при температуре 100 °C и при нормальном атмосферном давлении. Температура воды после конденсации в ней пара равна 70 °C. Найдите первоначальную температуру воды. 5. Через воду, имеющую температуру 10 °C, пропускают водяной пар при температуре 100 °C, и при нормальном атмосферном давлении. Сколько процентов составит масса воды, образовавшейся из пара, от массы всей воды в сосуде в тот момент, когда её температура стала равной 50 °C? Источник Тепловое равновесие и уравнение теплового балансаТела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым. Что такое теплообмен и при каких условиях он происходитТела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
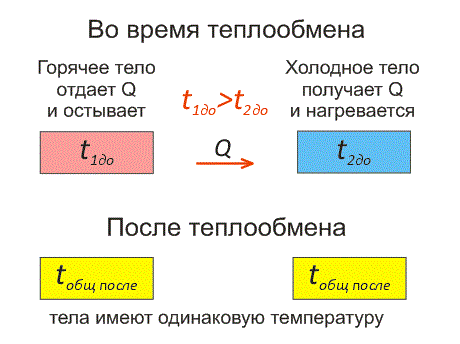
Рассмотрим два тела, имеющие различные температуры (рис. 1). Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться. На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом. Когда температуры тел выравниваются, теплообмен прекращается.
Когда температура тел выравняется, теплообмен прекратится. Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру. Уравнение теплового баланса и сохранение тепловой энергииКогда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус». А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс». Эти факты отражены на рисунке 2.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой. Уравнение теплового балансаТот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса. Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией: \(\large Q_<\text<остывания горяч>> \left( \text <Дж>\right) \) – это количество теплоты горячее тело теряет. \(\large Q_<\text<нагревания холод>> \left( \text <Дж>\right) \) – это количество теплоты холодное тело получает. В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене. Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами. В некоторых учебниках применяют сокращения: \[\large Q_ <1>+ Q_ <2>= 0 \] Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
Если несколько тел участвуют в процессе теплообменаИногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса: \[\large \boxed < Q_<1>+ Q_ <2>+ Q_ <3>+ \ldots + Q_
Пример расчетов для теплообмена между холодным и горячим теломК горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует. Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости. При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости. Решение: В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии. Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой. 1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль: 2). Теперь запишем формулу для каждого количества теплоты: Примечания:
3). Подставим выражения для каждого Q в уравнение баланса: 4). Для удобства, заменим символы числами: \[\large 4200 \cdot 0,2 \cdot (t_<\text<общ>> — 80 ) + 4200 \cdot 0,1 \cdot (t_<\text<общ>> — 15 ) = 0 \] \[\large 840 \cdot (t_<\text<общ>> — 80 ) + 420 \cdot (t_<\text<общ>> — 15 ) = 0 \] Раскрыв скобки и решив это уравнение, получим ответ: Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия. Задача для самостоятельного решения:В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует. Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует. Источник |