- Позитивная реакция опухолевых клеток msh2 что значит
- Позитивная реакция опухолевых клеток msh2 что значит
- Позитивная реакция опухолевых клеток msh2 что значит
- ИММУНОГИСТОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ MSH2, MSH6, PMS2, MLH1 В ОПРЕДЕЛЕНИИ СТЕПЕНИ ЗЛОКАЧЕСТВЕННОСТИ АДЕНОКАРЦИНОМЫ ТОЛСТОЙ КИШКИ
- Полный текст:
- Аннотация
- Ключевые слова
- Об авторах
- Список литературы
- Для цитирования:
- For citation:
Позитивная реакция опухолевых клеток msh2 что значит
Только 4% пациентов с раком толстого кишечника, без отбора по семейной истории рака, несут мутации в одном из трех генов репарации несовпадения — MLH1, MSH2 и MSH6. Как и при спорадическом раке груди, генетикам приходится балансировать между высокой стоимостью секвенирования генов репарации несовпадений с низкой вероятностью результата у каждого пациента с раком толстой кишки и очевидной важностью обнаружения такой мутации для семьи пациента.
Такие клинические показатели, как возраст начала (до 50 лет), поражение более проксимальных отделов кишки, присутствие другой опухоли или колоректальный рак в анамнезе, семейный анамнез колоректальных или других опухолей (особенно рак эндометрия) и случаи рака у родственников до 50 лет — все это повышает вероятность того, что больной раком толстой кишки унаследовал мутацию в генах репарации несовпадений оснований ДНК.
Молекулярные исследования опухолевых тканей для подтверждения наличия фенотипа RER+ или иммуногистохимическое подтверждение отсутствия белков MLH1, MSH2 или MSH6 также увеличивает вероятность, что конкретный пациент с колоректальным раком несет мутацию в генах репарации несовпадений.
Объединение клинических и молекулярных критериев допускает идентификацию небольшого подмножества (4%) всех больных колоректальным раком, вероятность обнаружения мутации репарации несовпадений у которых составляет 80%. Эти больные —экономически наиболее выгодная группа для проведения секвенирования.
Тем не менее все эти попытки повышения экономической эффективности, связанные с ограничением количества пациентов с целью увеличения выхода положительных результатов секвенирования, неизбежно приводят к потере небольшого числа (до 20%) пациентов с унаследованными мутациями репарации несовпадений.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Позитивная реакция опухолевых клеток msh2 что значит
хирург-онколог, маммолог, кандидат медицинских наук
+7 921 945 33 18
+7 981 710 40 41
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
В в клинике онкологических решений ЛУЧ (юридический адрес — Санкт-Петербург, Петровская коса, 1), также работаю с 2002 года в отделении заболеваний молочной железы ФГБУЗ Клиническая больница Российской академии наук. В 2007 году проходил обучение по онкологии в МАПО. С 2007 года являюсь действительным членом ЕВРОПЕЙСКОГО ОБЩЕСТВА МАММОЛОГОВ (EUSOMA) и ЕВРОПЕЙСКОГО ОБЩЕСТВА МЕДИЦИНСКОЙ ОНКОЛОГИИ (ESMO).
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Источник
Позитивная реакция опухолевых клеток msh2 что значит
Иммунная система является ключевым медиатором в процессе гибели опухоли. Однако злокачественные клетки могут уклоняться от иммунного ответа через ряд механизмов, включая активацию иммуносупрессии, приводя к нерегулируемому росту опухоли. Блокада контрольных иммунных точек высвобождает Т-клеточно-негативную костимуляцию, что позволяет активировать противоопухолевый T клеточный ответ, в результате которого происходит распознавание и уничтожение опухоли [1]. Цитотоксический Т-лимфоцит-ассоциированный антиген-4 (CTLA-4) и рецептор запрограммированной гибели клеток 1 (PD-1) действуют как отрицательные регуляторы, ослабляя нормальную активацию Т-клеток. Рецептор PD-1 экспрессируется на поверхности активированного Т-лимфоцита и ингибирует иммуносупрессивные лиганды PD-1 (PD-L1/PD-L2), которые экспрессируются опухолевыми клетками [2]. В отличие от меланомы, рака легкого и колоректального рака 3, иммунотерапия в монорежиме не демонстрирует высокую противоопухолевую активность при распространенных опухолях гинекологического тракта 7.
Что такое микросателлитная нестабильность
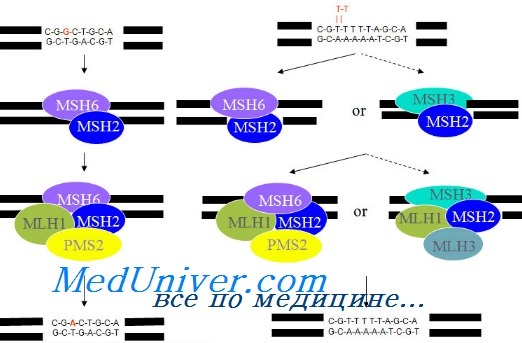
У человека существует сложная система, исправляющая нарушения в ДНК, которые возникают достаточно часто. Одним из таких механизмов является система репарации неспаренных оснований ДНК (mismatch repair system – MMR), которая ответственна за распознавание и удаление неправильно спаренных оснований, образованных в результате ошибок в процессе репликации ДНК. За работу системы репарации неспаренных оснований ДНК отвечают 6 генов: MSH2, MLH1, PMS2, MSH3, MSH6 и MLH3. Наличие герминальных мутаций в этих генах приводит к развитию синдрома Линча. Чаще встречается другой, ненаследственный механизм формирования дефицита MMR (dMMR), в подавляющем большинстве случаев заключающийся в метилировании промотера MLH1 в самой опухоли. В результате dMMR появляется большое число мутаций со сдвигом рамки считывания, что приводит к формированию стоп-кодонов и синтезу нефункциональных белков. Микросателлиты представляют собой короткие последовательности в ДНК из 1-5 оснований, повторяющиеся до нескольких десятков раз. Микросателлиты встречаются и в норме, однако при dMMR их число увеличивается, что и может быть выявлено. Понятия dMMR и микросателлитная нестабильность (MSI) описывают один и тот же процесс. Микросателлитную нестабильность оценивают двумя методами – методом ПЦР и иммуногистохимическим [9].
При определении методом ПЦР выделяются 3 варианта MSI: MSI-Н (высокий уровень MSI), когда ≥2 маркеров нестабильны, MSI-L (низкий уровень MSI), когда нестабилен 1 маркер, и MSS (стабильный уровень), когда стабильны все маркеры. Значение низкого уровня MSI до сих пор четко не установлено, и этих пациентов расценивают как больных с MSS опухолями. Вторым вариантом диагностики dMMR является иммуногистохимическое исследование (ИГХ), когда в опухоли изучается экспрессия белков MSH2, MLH1, PMS2, MSH6. В случае отсутствия окрашивания хотя бы одного белка устанавливается дефицит MMR. Обе методики демонстрируют высокую (>95%) конкордантность и являются в сложных случаях взаимодополняющими, так как существуют редкие варианты нарушения MMR, диагностируемые только ПЦР или только ИГХ.
При раке эндометрия MSI-h/dMMR встречается у 48,2% пациенток с метастатическим процессом и может отличаться от первичной опухоли. В основном в таких опухолях отмечаются недифференцированные или смешанные гистологические варианты с высоким уровнем содержания опухоль-инфильтрирующих лимфоцитов. Часто опухоль локализуется в нижних сегментах матки. Но по данным многочисленных исследований прогноз пациенток с MSI-h/dMMR не отличается от больных с опухолями без нарушений в системе репарации ДНК [10,11].
Рак эндометрия и иммунотерапия
По данным статистики, в 2019 г. было диагностировано 62 000 новых случаев рака эндометрия в мире и, что особо настораживает, прогнозируется рост как заболеваемости, так и смертности со скоростью 1-2% в год [12].
Рак эндометрия – генетически гетерогенное злокачественное новообразование, состоящее из четырех различных фенотипов: POLE ультрамутации, гипермутация микросателлитной нестабильности (MSI), низкая копийность генов и высокая копийность генов [13]. Молекулярная характеристика рака эндометрия имеет большое значение для обоснования использования ингибиторов контрольных точек в этой злокачественной опухоли. В результате дефектной системы репликации ДНК, появления POLE-инактивирующих мутаций и дефекта в системе репарации неспаренных оснований ДНК (MMR) (MLH1, MSH2, MSH6, PMS2) происходит значительное увеличение мутационной нагрузки опухоли [14], котороое коррелирует с высоким уровнем неоантигенов и опухоль-инфильтрирующих лимфоцитов (TIL). Это создает определенное микроокружение опухоли, которое является благоприятным для иммунологического ответа [15]. Большинство рецидивов рака эндометрия имеют либо низкую копийность генов, либо высокую копийность с высокой микросателлитной стабильностью (MSS) опухоли, которые часто являются резистентными для лечения. И разработка новых подходов к лечению именно этой группы больных на сегодня является самой актуальной.
Монотерапия ингибиторами иммунных контрольных точек
В 2017 году в рамках 2 фазы исследования изучали активность пембролизумаба при 12 различных типах опухолей с дефицитом репарации ДНК (dMMR), в том числе были и больные раком эндометрия (N=15), где эффективность терапии была очень впечатляющей и составила 53% [8]. Это исследование также показало, что дефицит MMR является биомаркером ответа на лечение, предлагая новый вариант терапии для злокачественных опухолей с дефицитом MMR.
С 2017 года пембролизумаб одобрен для лечения распространенных форм опухолей с dММR/MSI-H, ранее получавших лечение, включая и рак эндометрия [16]. Также пембролизумаб и анти-PD-L1 препарат атезолизумаб изучались при раке эндометрия у 24 пациенток с PD-L1-положительном статусом опухоли, независимо от MSI статуса, и эффективность этих препаратов составила всего 13% [17, 18]. Во 2 фазе исследования при распространенном раке эндометрия (N=23) применяли монотерапию ниволумабом с эффективность лечения в 23%, независимо от MSI статуса [19].
Также в 1/2 фазе исследования изучался препарат достарлимаб (анти-PD-1) у 125 больных прогрессирующим раком эндометрия, где клинический ответ независимо от MSI статуса составил 29,6%. Частота ответов в группе MSI-H и MSS составила 48,8% и 20,3% соответственно. С последующим наблюдением в течение 10 месяцев 84% пациенток все еще находились на лечении, и медиана продолжительности ответа (DOR) не была достигнута [20].
Во 2 фазе исследования ингибиторы PD-L1 авелумаб (N=31) и дурвалумаб (N=70) показали объективный ответ 26,7% и 43% у пациенток с dММR и 6,25% и 3% со стабильным статусом MMR у пациенток распространенным раком эндометрия соответственно [21, 22]. Также в настоящее время продолжаются исследования монотерапии ингибиторов контрольных точек при рецидивирующем раке эндометрия – ниволумаба и пембролизумаба. В обоих исследованиях производится селекция пациентов в соответствии с MSI, POLE, или dMMR статусом.
Скромные ответы монотерапии ингибиторов контрольных точек подчеркивают общий принцип, что иммуногенность и противоопухолевые ответы зависят в значительной степени от мутагенности опухоли и, следовательно, изменить иммунологический ответ можно в сочетании иммунотерапии с комбинированной терапией.
Комбинация ингибиторов контрольных точек с другими методами лечения
Недавно FDA зарегистрировало по ускоренному типу комбинацию перорального ингибитора мультикиназ ленватиниба (VEGFR1-3, FGFR 1-4, KIT, RET, PDGFRa) и пембролизумаба для лечения распространенного рака эндометрия, прогрессирующего после предшествующей терапии без MSI-H/dMMR. Эта регистрация была основана на впечатляющих результатах исследования KEYNOTE-146, 1b/2 фазы исследования, в котором приняли участие 108 пациенток (94 со стабильным MMR; 11 с дефицитом MMR). Объективный ответ на 24 неделе по irRECIST составил 36,2% и 63,6% для стабильного MMR и дефицитного MMR когорты соответственно. Объективный ответ и продолжительность ответа по независимому радиологическому анализу согласно RECIST 1.1 были 38,3% и не достигнуто для стабильного MMR и 63,6% и не достигнуто для когорт дефицитного MMR соответственно. При медиане наблюдения 18,7 месяца эффективность лечения была зафиксирована у пациентов независимо от статуса MSI, статуса PD-L1 или гистологии [7]. Серьезные побочные эффекты, связанные с лечением были отмечены у 16 (30%) пациентов, и была зарегистрирована одна смерть, связанная с лечением (внутричерепное кровотечение). Наиболее частыми нежелательными явлениями были гипертензия (31 [58%]), усталость (29 [55%]), диарея (27 [51%]) и гипотиреоз (25 [47%]). Наиболее распространенными видами токсичности 3 степени, связанными с лечением, были гипертензия (18 [34%]) и диарея (четыре [8%]). Только пять (9%) пациентов прекратили лечение из-за побочных эффектов.
В настоящее время проводится 3 фаза исследования ленватиниба с пембролизумабом в сравнении с доксорубицином или еженедельным паклитакселом в поздних линиях лечения рака эндометрия, а также в первой линии лечения продолжается исследование ленватиниба с пембролизумабом в сравнении с карбоплатином и паклитакселом.
Промежуточные результаты продолжающегося исследования 2 фазы дурвалумаба и тремелимумаба (анти-CTLA-4) в сравнении с одним дурвалумабом при рецидивирующем раке эндометрия независимо от статуса MMR (86% пациентов в каждой когорте были со стабильным статусом MMR) демонстрируют скромные результаты лечения: объективный ответ монотерапии дурвалумабом составил 14,8% и 11,1% при комбинации дурвалумаба с тремелимумабом [23].
До недавнего времени стандартом лечения распространенных форм рака эндометрия и рецидивов являлись монотерапия цитостатиками и гормонотерапия с медианой выживаемости без прогрессирования всего 1,0-3,2 месяца. Но с выявлением ряда биомаркеров подход к лечению такого резистентного к терапии рака, как рак эндометрия, существенно изменился: при опухолях с высокой мутационной нагрузкой (dММR/MSI-H) ингибитор контрольных точек пембролизумаб продемонстрировал высокую эффективность лечения.
Но доля пациентов со стабильным статусом MMR остается очень высокой, и для этой группы больных лечение комбинированной терапией ленватиниба с пембролизумабом является очень перспективным.
Источник
ИММУНОГИСТОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ MSH2, MSH6, PMS2, MLH1 В ОПРЕДЕЛЕНИИ СТЕПЕНИ ЗЛОКАЧЕСТВЕННОСТИ АДЕНОКАРЦИНОМЫ ТОЛСТОЙ КИШКИ
Полный текст:
Аннотация
Микросателлитная нестабильность связана с нарушением функций генов MSH2, MLH1, PMS2 и MSH6, которые в норме осуществляют репарацию неспаренных нуклеотидов ДНК. В настоящее время известно, что микросателлитная нестабильность – это независимый прогностический фактор, определяющий степень злокачественности рака толстой кишки. Использование иммуногистохимии для исследования системы репарации неспаренных нуклеотидов имеет свои особенности и ограничения. Материал и методы. В исследование вошло 39 больных аденокарциномой толстой кишки из них умереннодифференцированная аденокарцинома – 28 (72 %), высокодифференцированная аденокарцинома – 3 (8 %), низкодифференцированная аденокарцинома – 5 (12 %), муцинозная аденокарцинома – 3 (8 %) случая. Иммуногистохимически по стандартному протоколу исследовались белки генов MSH2, MSH6, PMS2, MLH1. Результаты. Из 39 исследованных случаев в 6 (15 %) наблюдениях было выявлено выпадение экспрессии как минимум одного из исследованных маркеров. Из 6 полученных случаев с косвенными признаками MSI-H три аденокарциномы были низкодифференцированными, 1 – муцинозной, 2 – умереннодифференцированными. Заключение. Иммуногистохимическое исследование генов репарации ДНК может быть использовано для определения степени злокачественности аденокарциномы толстой кишки совместно с оценкой гистологической дифференцировки опухоли. При использовании только гистологической дифференцировки для определения степени злокачественности аденокарциномы толстой кишки в 10 % случаев она будет оценена неверно.
Ключевые слова
Об авторах
Раскин Григорий Александрович, кандидат медицинских наук, ведущий научный сотрудник.
Петров Семен Венедиктович, доктор медицинских наук, профессор кафедры патологии.
Орлова Рашида Вахидовна, доктор медицинских наук, профессор, заведующая кафедрой онкологии, медицинский факультет,Санкт-Петербургский государственный университет.
Список литературы
1. Раскин Г.А., Янус Г.А., Корнилов А.В., Орлова Р.В., Петров С.В., Протасова А.Э., Пожарисский К.М., Имянитов Е.Н. Иммуногистохимическое исследование MSH2, PMS2, MLH1, MSH6 в сопоставлении с анализом микросателлитной нестабильности в аденокарциноме толстой кишки // Вопросы онкологии. 2014. Т. 60, № 2. С. 47–50.
2. Bosman F.T., Carneiro F., Hruban R.H., Theise N.D. WHO classification of tumors the digestive system. Lyon: IARC Press, 2010. 417 p.
3. Harfe B.D., Minesinger B.K., Jinks-Robertson S. Discrete in vivo roles for the MutL homologs MIh2p and MIh3p in the removal of frameshift intermediates in budding yeast // Curr. Biol. 2000.Vol. 10 (3). P. 145–148.
4. Kadyrov F.A., Dzantiev L., Constantin N., Modrich P. Endonucleolytic function of MutLalpha in human mismatch repair // Cell. 2006. Vol. 126 (2). P. 297–308.
5. Kamat N., Khidhir M.A., Alashari M.M., Rannug U. Microsatellite instability and loss of heterozygosity detected in middle-aged patients with sporadic colon cancer: A retrospective study // Oncol. Lett. 2013. Vol. 6 (5). P. 1413–1420.
6. Kheirelseid E.A., Miller N., Chang K.H., Curran C., Hennessey E., Sheehan M., Kerin M.J. Mismatch repair protein expression in colorectal cancer // J. Gastrointest. Oncol. 2013. Vol. 4. P. 397–408. doi: 10.3978/j.issn.2078-6891.2013.021.
7. Kinzler K.W., Vogelstein B. Lessons from hereditary colorectal cancer // Cell. 1996. Vol. 87 (2). P. 159–170.
8. Lindor N.M., Burgart L.J., Leontovich O., Goldberg R.M., Cunningham J.M., Sargent D.J., Walsh-Vockley C., Petersen G.M., Walsh M.D., Leggett B.A., Young J.P., Barker M.A., Jass J.R., Hopper J., Gallinger S., Bapat B., Redston M., Thibodeau S.N. Immunohistochemistry versus microsatellite instability testing in phenotyping colorectal tumors // J. Clin. Oncol. 2002. Vol. 20 (4). P. 1043–1048.
9. Peltomaki P., Vasen H. Mutations associated with HNPCC predisposition – Update of ICG-HNPCC/INSiGHT mutation database // Dis. Markers. 2004. Vol. 20 (4–5). P. 269–276.
10. Shia J. Immunohistochemistry versus Microsatellite Instability Testing For Screening Colorectal Cancer Patients at Risk for Hereditary Nonpolyposis Colorectal Cancer Syndrome. Part I. The Utility of Immunohistochemistry // J. Mol. Diagn. 2008. Vol. 10 (4). P. 293–300. doi: 10.2353/jmoldx.2008.080031.
Для цитирования:
Раскин Г.А., Петров С.В., Орлова Р.В. ИММУНОГИСТОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ MSH2, MSH6, PMS2, MLH1 В ОПРЕДЕЛЕНИИ СТЕПЕНИ ЗЛОКАЧЕСТВЕННОСТИ АДЕНОКАРЦИНОМЫ ТОЛСТОЙ КИШКИ. Сибирский онкологический журнал. 2015;1(5):80-83.
For citation:
Raskin G.A., Petrov S.V., Orlova R.V. IMMUNOHISTOCHEMICAL STUDY OF MSH2, MSH6, PMS2, MLH1 IN EVALUATION OF DIFFERENTIATION GRADE OF COLON ADENOCARCINOMA. Siberian journal of oncology. 2015;1(5):80-83. (In Russ.)

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Источник