- Плевральные синусы затемнены клиническое описание передние кардиодиафрагмальные что это значит
- О чем говорят результаты флюорографии
- Общие понятия о флюорографии
- Описание флюорографических снимков
- Патологии, которые могут быть определены по снимку
- Плевральные синусы затемнены клиническое описание передние кардиодиафрагмальные что это значит
Плевральные синусы затемнены клиническое описание передние кардиодиафрагмальные что это значит
Диагностика образований, расположенных в проекции кардио-диафрагмальных углов.
Гренков Г. И., Медведский В. Е.
Витебский медицинский институт.
В проекции кардиодиафрагмальных углов может локализоваться достаточно большое количество патологических образований. Диагностическая значимость клинических проявлений этих образований, особенно на начальном этапе, незначительна. Только при увеличении их размеров появляются симптомы компрессионного медиастинального синдрома.
Среди разнообразных методов лучевой диагностики рентгенологический метод является ведущим в выявлении новообразований этой области. Он позволяет уточнить локализацию, форму и размеры образования, выявить взаимосвязь с окружающими органами. Однако детальный анализ патологии кардиодиафрагмального угла при обычной рентгенографии затруднителен. Это связано со своеобразием анатомо-топографических взаимоотношений органов этой области и большим числом заболеваний, локализующихся здесь. Применение дополнительных специальных методик рентгенологического исследования позволяет в большинстве случаев поставить правильный диагноз. Наибольшую диагностическую значимость имеет пневмомедиастинография, выполняемая в различные фазы дыхания. В отдельных случаях показана томография. Заслуживает интерес применение методики встречного контрастирования, когда газ вводится в средостение и брюшную полость одновременно. Определенный успех в диагностике опухолей и опухолевидных образований кардиодиафрагмального угла связан с внедрением в практику рентгеновской компьютерной томографии. Она значительно расширяет объем диагностической информации и у отдельных больных отпадает надобность в проведении сложных методов исследования, связанных с наложением пневмоперитонеума и пневмомедиастинума. Однако отсутствие достаточного количества подобной аппаратуры ограничивают широкое использование этой методики.
В проекции кардиодиафрагмального угла встречаются медиастинальные и абдоминомедиастинальные липомы, целомические кисты перикарда, парастернальные грыжи, лейомиомы пищеводно-желудочного соустья. Значительно реже находят гигантские опухоли вилочковой железы, тератодермоидные кисты. Симулировать опухолевые процессы кардиодиафрагмального угла могут кардиодиафрагмальные грыжи, ограниченная релаксация диафрагмы. С наибольшей частотой встречается правосторонняя локализация патологического процесса в области переднего кардиодиафрагмального угла.
Рентгенологическая семиотика липом разнообразна и зависит от их размеров Медиастинальные липомы чаще встречаются в проекции правого кардиодиафрагмального угла. Они имеют грушевидную форму, однородную структуру, четкие контуры. Газ, введенный в средостение, смещает патологическое образование и позволяет увидеть его дольчатую структуру, уточнить взаимоотношение с окружающими органами и тканями.
Абдоминомедиастинальные липомы (Рис. 1), проникая через щель Ларрея, располагаются в правом сердечно-диафрагмальном синусе. Это наиболее распространенная опухоль средостения. При рентгенологическом обследовании определяется тень полукруглой формы, средней интенсивности с ровным и четким краем. В боковой проекции тень прилежит к контуру передней грудной стенки. На пневмомедиастинограммах газ расслаивает опухоль на дольки. У отдельных больных может быть видна ножка опухоли, соединяющая медиастинальное и абдоминальное пространства. При дополнительном введении газа в брюшную полость наблюдается симптом “погружения”, когда расположенная выше медиастинальная часть липомы вследствие высокого стояния купола диафрагмы, как бы смещается в брюшную полость.

| Рис. 1. Абдомино-медиастинальная липома. |
Злокачественные жировые опухоли этой локализации встречаются редко и их симптоматика мало отличается от доброкачественных липом.
Целомические кисты перикарда (Рис. 2) — тонкостенные образования, развившиеся от отшнуровавшегося дивертикула. Содержанием кист является жидкость, подобная перикардиальной. Диаметр кист колеблется от 3-4 см до 10-15 см. Типичным признаком является тень полукруглой или полуовальной формы, связанная с куполом диафрагмы, сердцем или передней грудной стенкой. При многопроекционном исследовании они не отделяются от тени сердца. Контуры кист всегда четкие. Только наличие жировых включений, спаек приводит к неровности и угловатости контура. Для них характерна передаточная пульсация сердца. Они часто меняют форму при дыхании: удлиняются при вдохе, уплощаются при выдохе. В условиях пневмомедиастинума эти образования отчетливо отделяются от всех окружающих органов и тканей полоской газа. Серьезные дифференциально-диагностические трудности возникают в случаях, когда кисты достигают больших размеров. Их дифференцируют с липомами, диафрагмальной грыжей, осумкованным плевритом, релаксацией купола диафрагмы.

| Рис. 2. Целомическая киста перикарда. |
В парастернальных грыжах находят фрагменты тонкой или толстой кишок, желудка, сальника, печени. В тех случаях, когда грыжевой мешок содержит полые органы, основным признаком грыжи становится появление тени ячеистого, неоднородного образования, связанного с передней грудной стенкой. Исследование желудочно-кишечного тракта в таких случаях дает возможность увидеть контрастированные кишечник или желудок, расположенные в грыжевом мешке. Газ, введенный в брюшную полость, проникает в грыжевой мешок и на его фоне становится хорошо видимой тень сальника или фрагмент печени.
Лейомиомы пищеводно-желудочного соустья, достигнув больших размеров, могут быть видимыми в проекции кардиодиафрагмальных углов. Контрастное исследование пищевода разрешает диагностические трудности. Лейомиомы дают овальной формы дефект наполнения с неровными, но четкими контурами на фоне сохраненного рельефа слизистой оболочки.
Тимомы больших размеров могут занимать все средостение и выходить в проекцию кардиодиафрагмальных углов. При этом находят затемнение сравнительно однородной структуры с волнистыми с волнистыми очертаниями, что отражает дольчатое строение опухоли. На пневмомедиастинограммах уточняют форму и размеры опухоли и ее загрудинную локализацию. Определенное значение имеет своеобразная клиническая картина течения заболевания.
Тератодермоидные образования (Рис. 3) содержат разнообразные ткани. Очень важным признаком, позволяющим установить правильный диагноз, является наличие в толще опухоли плотных включений и краевых обызвествлений. Эти новообразования часто инфицируются и нагнаиваются, в связи с чем формируются спайки, которые связывают опухоль с окружающими тканями.

| Рис. 3. Терато-дермоидная киста средостения. |
Рентгенологическая картина затемнений, обусловленных диафрагмальными грыжами, зависит от того, какие органы содержатся в грыжевом мешке. Патологическая тень при диафрагмальных грыжах прилежит к диафрагме и смещается вместе с ней. При этом возможно изменение формы тени. Выпадение кишечника (Рис. 4) или желудка позволяют увидеть на фоне неравномерного затемнения участки просветлений, горизонтальные уровни жидкости. Контрастное исследование желудка и кишечника обнаруживает эти органы в грудной полости. Наличие в грыжевом мешке паренхиматозных органов дает гомогенное затемнение. Решающее диагностическое значение в таких случаях имеет наложение диагностического пневмоперитонеума. Введенный газ проникает в грыжевой мешок и располагается между диафрагмой и паренхиматозным органом.

| Рис. 4. Диафрагмальная грыжа слева. Содержит петлю толстой кишки. |
При ограниченных релаксациях купола диафрагмы определяется ее полуовальное выпячивание с ровным и четким контуром, нередко можно обнаружить так называемый симптом “пересекающихся дуг” различных мышечных групп диафрагмы. Возможно наблюдать парадоксальное движение релаксированного участка диафрагмы по отношению к остальному.
Источник
О чем говорят результаты флюорографии
«Туберкулез. Убийца побежден». Это не лозунг из будущего. Лет 20 назад такое высказывание можно было увидеть в коридорах поликлиник. Сегодня он не актуален. Убийца вернулся и уносит жизни тысяч людей на планете. Профилактические меры особого влияния не имеют. Одна из них – флюорографическое обследование. О чем же говорят его результаты? Как узнать, что скрывается за загадочными медицинскими знаками и терминами, которые описывают результат вашей флюорограммы.
Общие понятия о флюорографии
Рентгеновские лучи проходят через ткани, оставляя снимок на пленке. Рентгенографическое исследование не является совершенным. Его преимущества – доступность и дешевизна. Однако достоверность такой диагностики, особенно в начале заболевания, не такая точная, как хотелось бы.
Описание флюорографических снимков
На снимке отражается преимущественно измененная плотность органов. Разница плотности структуры органа на разных фрагментах снимка и является для врача – рентгенолога настораживающим фактором и толчком для дальнейшего обследования пациента. Скопление фрагментов соединительной ткани может быть заметно на снимке в виде фиброза, спаек, тяжей, лучей, рубцов, наслоений.
Изменение плотности органа видно не при каждой патологии. На снимке может не определяться, например, пневмония. Рентгенография не всегда может быть единственным условием постановки окончательного диагноза.
Что можно определить по флюорографическому снимку:
- фиброзные и склеротические изменения
- присутствие жидкости, воздуха, иногда — инородного тела в полости
- опухоли
- полостные патологии (кисты, абсцессы)
- воспаления в запущенных стадиях
Патологии, которые могут быть определены по снимку
Тяжистость корней. Проявляется при бронхитах, чаще при бронхите курильщика; как один из симптомов онкологии, профессиональных поражениях дыхательных путей.
Расширение и уплотнение корней. Данный результат на снимке может показать хронически протекающий процесс в легких. Корни могут расширяться по причине увеличения лимфоузлов, отека сосудов и бронхов. Такие показатели в совокупности или по отдельности могут указывать на пневмонию или острый бронхит. Уплотненные, расширенные корни бывают у заядлых курильщиков, а также при бронхите или пневмонии.
Усиленный сосудистый рисунок в легких. При остром воспалительном процессе наблюдается более интенсивное кровоснабжение органа, кровенаполнение сосудов. На снимке это отражается усиленным рисунком сосудов. Такое явление характерно как для пневмонии, так и для предраковых состояний. Поэтому если на снимке виден усиленный сосудистый отпечаток, даже при наличии всех симптомов пневмонии, делается повторный снимок.
Кальцинаты. Плотностью напоминают костную ткань, имеют округлую форму, представляют собой «заграждения» от очага болезни: например, человек долго контактировал с туберкулезным больным, но заражения не произошло. Кальцинаты сами по себе не вызывают опасений.
Наличие фиброзной ткани. Присутствие на легочной ткани фиброзов говорит о прошлой травме, ранении или инфекции легких. Фиброзная ткань замещает пораженную, не вызывает опасений, хотя и не заменяет легочную ткань.
Запаянный, а также свободный синус. Плевральные синусы образовываются в складках плевры. При наличии патологий в таких полостях видна жидкость. Синус может быть запаян после травмы или после плеврита. При отсутствии жалоб такие симптомы не страшны.
Очаговая тень и очаг. Видны в виде затемнений на снимке. Тень имеет площадь до сантиметра, ее местоположение в середине легких или внизу говорит об очаговой пневмонии. Очаговая тень в верхних отделах свидетельствует о туберкулезе легких и требует дополнительного обследования. Наложение теней в сочетании с неровными краями и усиленным легочным рисунком свидетельствует об активном воспалительном процессе.
Изменения диафрагмы. Может быть попутно обнаружены искривления диафрагмального купола, его уплощение, завышенное положение и другие изменения. Причины могут быть разные: от патологий пищевода, желудка и печени до онкологии, плеврита, ожирения. В задачу флюорограммы не входит установить причину таких изменений диафрагмы. Это задача более узких специалистов.
Спайки. Спайками называются концентраты соединительных тканей, возникающих вследствие воспалений. Они призваны оградить здоровые ткани от очагов воспаления. Сами по себе спайки не являются поводом беспокоиться, так как свидетельствуют о прошедшем процессе.
В любом случае следует помнить, что традиционное ежегодное флюорографическое обследование органов грудной полости поможет вам во время выявить и застраховать себя от опасных заболеваний. Флюорография является самым точным способом диагностики при некоторых серьезных легочных патологиях. Не игнорируйте этот вид обследования!
Имеются противопоказания. Перед применением проконсультируйтесь со специалистом.
Перед применением препаратов, указанных на сайте, проконсультируйтесь с врачом.
Источник
Плевральные синусы затемнены клиническое описание передние кардиодиафрагмальные что это значит
Рентгенография грудной клетки является первым методом лучевой диагностики заболеваний легких, плевры и средостения, который позволяет обнаружить патологический объект и на основании теневой картины с той или иной вероятностью определить его природу. Схожесть рентгенологической семиотики разных образований в средостении не всегда позволяет сделать однозначный вывод о конкретном заболевании, и тогда следующим диагностическим этапом становится компьютерная томография. Ее большим преимуществом является получение двухмерных аксиальных срезов на разных уровнях грудной полости с высоким пространственным разрешением без эффекта суммации теней, что делает метод основным в диагностике патологии средостения [1].
Кардиодиафрагмальное пространство на рентгенограммах занимает передненижние паракардиальные отделы грудной полости и отграничено медиально краем сердечной тени, латерально и снизу – контуром диафрагмы, спереди – грудной стенкой, сзади без видимой границы переходит в диафрагмомедиастинальный плевральный синус и нижние отделы центрального средостения. Поскольку границами и компонентами кардиодиафрагмального пространства являются разные анатомические структуры, то их патологические изменения часто приводят к затемнению этого участка на рентгенограммах. Тенеобразующий объект может исходить из органов или клетчатки средостения, плевры или плевральной полости, легкого, диафрагмы, поддиафрагмального пространства [2]. Такое многообразие разных источников затемнения, проецирующихся на одну и ту же анатомическую область, создает диагностические сложности в определении нозологических форм и требует проведения дополнительных исследований, одним из которых является УЗИ грудной клетки [3, 4].
Эхография позволяет получать двухмерные сканы как в аксиальной, так и в других плоскостях с формированием серошкального изображения, построенного на основании интенсивности отраженного эхосигнала. Пристеночное расположение объекта исследования без экранирования воздушной легочной тканью предоставляет хорошие условия для его ультразвуковой визуализации как из межреберий, так и субкостально, а высокая пространственная и контрастная разрешающая способность метода дает возможность детально оценить строение и взаимоотношение с окружающими структурами [5, 6].
Цель исследования: разработать методику УЗИ кардиодиафрагмального пространства и дифференциальную ультразвуковую диагностику его рентгенографических затемнений.
Материал и методы исследования
В отделении торакальной хирургии ГБУЗ «Городская клиническая больница № 5» г. Нижнего Новгорода обследованы 404 пациента с одно- или двусторонним затемнением кардиодиафрагмального пространства на обзорной рентгенограмме грудной клетки или плевральным выпотом, занимавшим передний реберно-диафрагмальный синус. У 237 пациентов тенеобразующий объект располагался внеплеврально: абдоминомедиастинальная липома (АМЛ) (166 пациентов), целомическая киста перикарда (ЦКП) (37 пациентов), выраженная паракардиальная жировая клетчатка (29 пациентов), грыжа щели Ларрея (5 пациентов). У 167 пациентов диагностирован свободный плевральный выпот различной этиологии с эхогенными структурами в переднем реберно-диафрагмальном синусе: жировые подвески (83 пациента), плевральные шварты и скопления рыхлого фибрина (56 пациентов), мезотелиома (21 пациент), метастазы (7 пациентов), которые не определялись рентгенологически на фоне выпота и были обнаружены только эхографически. Очаги верифицированы: у 261 пациента комплексным клинико-инструментальным обследованием, у 117 – оперативно, у 46 – видеоторакоскопией с биопсией.
Все пациентам выполнено УЗИ грудной клетки на сканерах среднего класса секторным (3,5 МГц), конвексным (2–6 МГц) и линейным (7–12 МГц) датчиками на абдоминальной программе сканирования. Исследование плевральной полости проводили по принятой методике [7, 8], а кардиодиафрагмального пространства – по разработанной оригинальной методике, состоявшей из двух последовательных этапов. Сначала выполняли субкостальное сканирование из-под мечевидного отростка с направлением оси сканирования к правому плечу или справа парастернально из межреберья над местом прикрепления реберной дуги к грудине и выявляли дополнительное образование между куполом диафрагмы и сердцем. Измеряли его наибольшую ширину от диафрагмы до контура сердца и толщину от грудной стенки до наиболее удаленной вглубь средостения границы.
На втором этапе определяли степень распространения патологического объекта вниз, оценивая глубину проникновения в передний реберно-диафрагмальный синус и далее за его пределы или взаимосвязь с передней брюшной стенкой и органами брюшной полости через грудино-реберный треугольник диафрагмы (щель Ларрея–Морганьи). Для этого датчик при продольном сканировании из межреберья или субкостально направляли каудально, плавно смещая его далее вниз вдоль передней брюшной стенки, тем самым у АМЛ подтверждали сообщение жировой ткани в средостении с предбрюшинной клетчаткой, а у мезотелиом – прорастание опухоли в синус и ниже в мягкие ткани передней брюшной стенки [9]. В диагностике затемнений кардиодиафрагмального пространства УЗИ грудной клетки показало более высокую чувствительность, чем рентгенография: соответственно 92,5% и 74,1% при АМЛ и 90,8% и 70,8% при ЦКП.
Результаты исследования и их обсуждение
Причиной затемнения кардиодиафрагмального пространства служили различные патологические процессы, которые исходили из плевры и сопровождались накоплением выпота или возникали из окружающих органов и тканей, располагаясь внеплеврально. В зависимости от консистенции внеплевральные объекты были солидными или жидкостными, что определяло их эхогенность и эхоструктуру. Наиболее часто встречалась АМЛ – ложная грыжа из предбрюшинной клетчатки, проникшая через щель Ларрея–Морганьи в правое кардиодиафрагмальное пространство. В норме его частично заполняло немного жировой клетчатки треугольной формы до 2,0 см в ширину и в глубину средостения. Подозрение на АМЛ возникало при выявлении избыточного количества жировой ткани свыше 3,0 см в этих измерениях. Большинство пациенток были женщины с повышенной массой тела (97,0%).
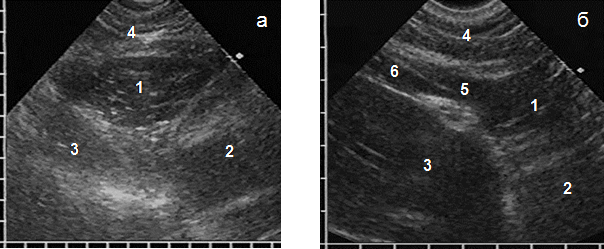
АМЛ при субкостальном сканировании имела вид образования треугольной формы без капсулы, основанием к грудной стенке и вершиной вглубь средостения, с неоднородной эхоструктурой за счет множественных коротких гиперэхогенных сигналов на гипоэхогенном фоне, такой же, как у нормальной паракардиальной и предбрюшинной жировой клетчатки. Эти сигналы возникали при отражении ультразвука от соединительнотканных прослоек, разделявших жировую ткань на отдельные дольки. На глубоком вдохе образование незначительно меняло треугольную форму за счет смещения диафрагмы. Важным диагностическим признаком АМЛ являлась визуализация ее ножки при продольном сканировании в виде узкого гипоэхогенного участка на уровне диафрагмы, переходившего каудально в предбрюшинную клетчатку (рис. 1). Частота обнаружения зависела от толщины ножки, которая составила в среднем 8,0±1,3 мм и была видна у 102 (61,4%) больных.
Рис. 1. Эхограммы АМЛ при субкостальном сканировании (а) и ее ножки при продольном сканировании (б): АМЛ (1), сердце (2, размыто при сокращении), печень (3), передняя брюшная стенка (4), ножка липомы (5), предбрюшинная клетчатка (6)
У пациентов со значительно повышенной массой тела абдоминомедиастинальную липому имитировала избыточная паракардиальная клетчатка средостения, имевшая типичную для жировой ткани эхоструктуру. Она лоцировалась не только в правом кардиодиафрагмальном пространстве, но по обе стороны сердца – вокруг верхушки и вдоль апикальных, а при значительном количестве – вдоль средних и базальных отделов стенок желудочков в виде треугольного или грушевидного образования, изменявшего свою форму синхронно с сокращениями сердца. Почти все пациенты были мужчины-гиперстеники (82,8%) с широкой грудной клеткой. Размеры паракардиальной клетчатки сильно варьировали, особенно слева, колеблясь от 3,0х2,5 см до 8,0х5,5 см. Принципиальным отличием от АМЛ являлось отсутствие связи с предбрюшинной клетчаткой, от которой она четко отграничивалась куполом диафрагмы, не распространяясь ниже его уровня. При большой толщине жирового слоя его латеральный контур вдоль левого желудочка частично перекрывался реверберациями от предлежащей воздушной легочной ткани.
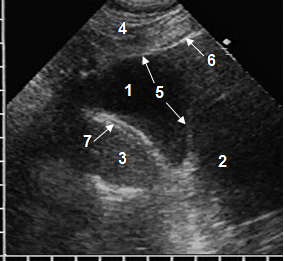
ЦКП располагались как в кардиодиафрагмальном пространстве, так и на различном протяжении вдоль правого, реже левого желудочка, при крупном размере достигая предсердий. Рентгенографически нередко возникали затруднения в их дифференцировке с АМЛ, что стало стимулом для разработки дифференциальной ультразвуковой диагностики. Для ЦКП характерна овальная или каплевидная форма, при которой продольная ось располагалась параллельно длинной оси сердца, но кисты в правом кардиодиафрагмальном пространстве часто имели треугольную форму со сглаженными углами. Они содержали прозрачную жидкость, поэтому имели однородную анэхогенную структуру, что принципиально отличало их от гипоэхогенных липом с линейными эхосигналами. Важным эхопризнаком ЦКП являлась тонкая эхогенная стенка, а связь с предбрюшинной клетчаткой отсутствовала (рис. 2). Сообщение с полостью перикарда установлено у 2 (5%) больных. Размеры кист колебались в более широких пределах, чем АМЛ: от 4 до 17 см. Допплерографически в них наблюдалась передаточная пульсация за счет сокращений сердца.
Рис. 2. Эхограмма ЦКП при субкостальном сканировании: анэхогенная ЦКП (1), сердце (2), печень (3), передняя брюшная стенка (4), стенка кисты (5), гиперэхогенная поверхность легкого с реверберациями (6), трехслойная структура мышечной части диафрагмы (7)
УЗИ при грыже щели Ларрея имело разную информативность в зависимости от содержимого грыжевого мешка. Диагностические сложности возникли при наличии в нем участков большого сальника, эхографически не отличавшихся от предбрюшинной клетчатки и ошибочно расцененных как АМЛ у 3 больных. Для дифференцировки необходимо прицельно оценивать ту структуру, в которую жировая ткань переходила ниже диафрагмы – в предбрюшинную клетчатку, расположенную поверхностно вдоль непрерывной гиперэхогенной линии брюшины, или в большой сальник глубже нее, когда в брюшине возникал участок перерыва в области грыжевых ворот. Ущемленная петля тонкой кишки определялась в грыжевом мешке в виде изогнутой трубчатой структуры с эхогенной стенкой и жидким содержимым с неоднородной малоподвижной взвесью, при этом в брюшной полости наблюдалась типичная эхокартина острой тонкокишечной непроходимости.
Эхографически выявление жидкости в полости плевры не вызывало диагностических затруднений. Выпот в переднем реберно-диафрагмальном плевральном синусе лоцировался как анэхогенное пространство с сохранением его анатомической формы в виде треугольника с остроконечной вершиной, направленной вниз. Диагностические вопросы возникали при выявлении на фоне выпота диффузного утолщения плевры или очаговых образований, требовавших определения их воспалительной или опухолевой природы. Для этого оценивали распространенность объекта в плевральной полости и за ее пределами, его размеры, форму, эхоструктуру и передаточную смещаемость, изменение анатомической формы синуса при заполнении его эхогенными массами, на основании чего дифференцировали мезотелиомы от скоплений фибрина и крупных плевральных шварт, а метастазы от жировых подвесок.
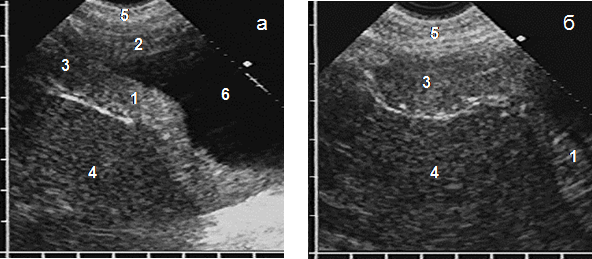
Диффузно-узловая мезотелиома распространялась, как правило, на два листка плевры, чаще диафрагмальный и костальный, в виде однородного гипоэхогенного пласта с четкими неровными контурами и неравномерной толщиной более 10 мм и протяженностью свыше 10 см. Максимальная толщина чаще составляла 15–30 мм (65%). Опухоли до 15 мм встречались редко (10%), но у 25% больных толщина превышала 30 мм, причем в 14% мезотелиома занимала значительный объем плевральной полости, достигая в наибольшем месте 60–80 мм. У 12 (39%) пациентов опухоль распространялась на весь передний реберно-диафрагмальный синус, расширяя его и прорастая вниз в переднюю брюшную стенку в виде образования удлиненной формы с закругленным дистальным краем (рис. 3). Крупные мезотелиомы сильно деформировали диафрагму, в месте прорастания купол локально истончался и замещался опухолевой тканью. Дыхательная подвижность диафрагмы отсутствовала при опухоли более 20 мм и переходе через передний плевральный синус на костальную плевру.
Фибриновым плевральным наложениям свойственна меньшая толщина – 6–8 мм, но мы наблюдали и массивные шварты неравномерной толщины до 25 мм, имитировавшие мезотелиому. В отличие от опухоли они имели неровную зазубренную поверхность и часто сочетались с множественными эхогенными нитями в виде разноячеистой фибриновой сети. Заполненный фибриновыми массами передний плевральный синус сохранял нормальные размеры и остроугольную форму. При рыхлой консистенции фибрина прослеживалось изменение его формы на глубоком вдохе синхронно с дыхательным смещением диафрагмы.
Рис. 3. Эхограммы мезотелиомы с ростом по плевре (а) и в переднем плевральном синусе (б): опухолевое утолщение диафрагмальной (1) и костальной (2) плевры, прорастание опухоли в синус (3), печень (4), мягкие ткани передней брюшной стенки (5), плевральный выпот (6)
Часто в переднем плевральном синусе на фоне выпота различной этиологии лоцировались жировые подвески, представленные нормальной жировой тканью, расположенной интраплеврально в виде отдельных элементов или массивных скоплений. Они имели вытянутую овальную или грушевидную форму с узким основанием в глубине синуса и краниальным расширением за его пределами и характерную для жировой ткани среднеэхогенную дольчатую структуру с множественными линейными гиперэхогенными включениями. Вследствие мягкой консистенции жировые подвески обладали выраженной передаточной смещаемостью при дыхании, что выражалось в их плавных качательных движениях синхронно с дыхательными смещениями диафрагмы.
В отличие от жировых подвесок метастазы, расположенные только в переднем плевральном синусе, не встречались, они выявлялись на разных листках плевры, в том числе и в синусе. Для них характерны овальная или уплощенная форма с широким основанием, однородная гипоэхогенная структура, отсутствие передаточной смещаемости при дыхании или сердцебиении. При диффузном росте их эхосемиотика не отличалась от мезотелиомы.
Выводы. УЗИ грудной клетки является эффективным методом диагностики патологии кардиодиафрагмального пространства. В дифференцировке затемнений данной локализации ультразвуковой метод более информативен, чем рентгенография, благодаря возможности оценки эхоструктуры тенеобразующего объекта и распространения за пределы грудной клетки, что позволяет своевременно выбрать правильную тактику лечения. АМЛ имела треугольную форму, неоднородную гипоэхогенную структуру с короткими линейными сигналами, ножку к предбрюшинной клетчатке; ЦКП – овальную форму, однородное анэхогенное содержимое, тонкую эхогенную капсулу без связи с передней брюшной стенкой. Для мезотелиомы характерно неравномерное утолщение плевры свыше 20–30 мм с четким контуром и однородной гипоэхогенной структурой, у трети больных опухоль заполняла весь передний плевральный синус и прорастала вниз за его пределы. Жировые подвески лоцировались как исходящие из глубины синуса вытянутые образования с узким основанием, с неоднородной дольчатой эхоструктурой и передаточной смещаемостью при дыхании, а метастазы – как однородные гипоэхогенные очаги овальной формы, плотно фиксированные к плевре и без передаточной смещаемости.
Источник