- Pas-реакция
- Смотреть что такое «Pas-реакция» в других словарях:
- Pas реакция отрицательная что значит
- Гликоген (реакция ШИК) (PAS) — метод Гочкисс — Мак Минус
- Техника проведения ШИК-реакции
- Оценка результатов ШИК-реакции
- Видео методы окрашивания препаратов в гистологии
- PAS-реакция
- Иммуногистохимические методы дифференциальной диагностики протоковых и дольковых карцином in situ молочной железы
Pas-реакция
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг .
Смотреть что такое «Pas-реакция» в других словарях:
Шик-Реакция, Pas-Реакция (Periodic Acid — Schiff (PAS) reaction) тест, позволяющий выявить наличие в тканях гликопротеинов, полисахаридов, некоторых мукополисахаридов, гликолипидов и ряда жирных кислот. Исследуемая ткань после воздействия на нее реактива Шиффа обрабатывается йодной… … Медицинские термины
ШИК-РЕАКЦИЯ, PAS-РЕАКЦИЯ — (periodic acid Schiff (PAS) reaction) тест, позволяющий выявить наличие в тканях гликопротеинов, полисахаридов, некоторых мукополисахаридов, гликолипидов и ряда жирных кислот. Исследуемая ткань после воздействия на нее реактива Шиффа… … Толковый словарь по медицине
PAS- — (син. ШИК реакция) гистохимический метод выявления гликогена, нейтральных глико и мукопротеидов, сиаломукопротеидов и гликолипидов, основанный на окислении перйодной кислотой (или ее солями) 1,2 гликольных групп, содержащихся в этих соединениях,… … Большой медицинский словарь
шик-реакция — см. Pas реакция … Большой медицинский словарь
Международная реакция на провозглашение независимости Сахарской Арабской Демократической Республики — Эта статья является частью серии: Конфликт в Западной Сахаре Западная Сахара Историческая справка История Западной Сахары История Марокко Сахарская Арабская Демократическая Республика Испанс … Википедия
Пневмония — I Пневмония (pneumonia; греч. pneumon легкое) инфекционное воспаление легочной ткани, поражающее все структуры легких с обязательным вовлечением альвеол. Неинфекционные воспалительные процессы в легочной ткани, возникающие под влиянием вредных… … Медицинская энциклопедия
Шик-реа́кция — см. Pas реакция … Медицинская энциклопедия
Мезенхимальные диспротеинозы — (сосудисто стромальные диспротеинозы) дисметаболические (дистрофические) процессы, характеризующиеся преимущественным нарушением белкового обмена и первично развивающиеся в строме органов. Традиционно наряду с мезенхимальными диспротеинозами как… … Википедия
Пециломикоз — Пециломикоз это новая нозологическая единица микоза, введенная Baker в 1971 г. на основании имеющихся сообщений о поражении человека и животных грибами рода Paecilomyces. Остается до настоящего времени малоизученным видом системного… … Википедия
Пушкин, Александр Сергеевич — — родился 26 мая 1799 г. в Москве, на Немецкой улице в доме Скворцова; умер 29 января 1837 г. в Петербурге. Со стороны отца Пушкин принадлежал к старинному дворянскому роду, происходившему, по сказанию родословных, от выходца «из… … Большая биографическая энциклопедия
Источник
Pas реакция отрицательная что значит
Цитохимические методы преследуют отождествление химических и ферментных веществ в клетках, используя для этого цветные реакции. Цитохимические препараты сохраняют клеточную структуру, что допускает выявление клеток и внутриклеточную локализацию исследувмого составного. Вот почему в гематологии отдается предпочтение не биохимическим, трудоемким, разрушающим клеточную структуру о относящимся к весьма разнородной клеточной популяции, а цитохимическим способам.
Цитохимия доказала, что среди морфологически одинаковых клеток имеются существенные химические и ферментативные различия.
Гликоген (реакция ШИК) (PAS) — метод Гочкисс — Мак Минус
Принцип ШИК-реакции. Полисахариды выявляются путем реакции, окисляющей спиртные группы, которые преобразуются в альдегидные группы, и отождествления последних путем цветной реакции реагентом Шифф.
Реагенты для ШИК-реакции: 1. Закрепляющий смесь спирт-формалин: 9 частей абсолютного этилового спирта +1 часть 40% формалина; сохранять при температуре +4°.
2. Периодння кислота, 1% водный раствор. Раствор бесцветный. Хранить в бутылке из коричневого стекла, в темноте, при лабораторной температуре. Пожелтевший раствор неприменим.
3. Реагент Шиффа. Развести 1 г основного фуксина в 200 мл дистилированной воды при температуре кипения. Болтать 5 минут, охладить до температуры 50°, профильтровать и добавить 20 мл нормальной соляной кислоты. Охладить до 25°, добавить 2 г метабисульфита натрия или калия, которые полностью обеспечивают раствор. Раствор должен простоять сутки в условиях темноты и холода (+4°). Затем добавить 2 г активированного угля, поболтать 1 мин. и профильтровать.
Полученный фильтрат прозрачный и бесцветный. Допускается слегка желтоватый оттенок; если раствор розовеет, становится неприменимым. Хранить при температуре +4° в герметически закрытой бутылке из коричневого стекла.
4. Зеленый светлый —1% водный раствор.
5. Диастаз: неразжиженная слюна человека или 0,1% раствора амилолитического-диастатического фермента в физиологическом солевом растворе.
Техника проведения ШИК-реакции
1) 10-тиминутное закрепление мазков смесью спирт-формалин; промывание дистилированной водой;
2) окисление 1% раствором периодной кислоты, 10 мин.; промывание дистилированной водой;
3) окраска реагентом Шиффа в накрытой посуде, в условиях темноты и холода, в течение 2 часов; промывание проточной водой;
4) контрастная окраска 1% зеленым-светлым в течение 1 минуты; промывание проточной водой.
Контрольный закрепленный мазок подвергается инкубации диастазом, 60 мин. в условиях комнатной температуры для выборочного удаления гликогена. После промывания дистилированной водой подвергается обработке по обычному методу.
Оценка результатов ШИК-реакции
Гликоген, окрашенным в багряно красный- цвет, представляется в виде зерен или рассеянный. Для контроля реакции используются зрелые гранулоциты мазка. Помимо гликогена ШИК положительную реакцию дают и другие вещества углеводной природы, такие как, муцин, мукопротеины, цереброзиды, фибрин. Дифференциация гликогена от этих составных осуществляется путем предварительной обработки диастазом, после чего гликоген более не окрашивается.
В гранулоцитах гликоген находится в рассеянном виде уже на стадии промиелоцита и начинает увеличиваться по мере созревания. В нормальных условиях лимфоциты отрицательны или в 20% из них могут находиться несколько мелких зерен гликогена. Моноциты отрицательные либо имеют тонкую зернистость.
Интенсивность окраски определяется полуколичественно. В лимфоцитах реакция ШИК отражается в виде гликогенного показателя, или среднего показателя реакции (Астальди). Нормальный показатель гликогена колеблется в пределах от 0,10 до 0,30. Обычно лишь у патологических лимфоцитов наблюдается степень нагрузки более 3.
Значилось метода ШИК-реакции:
а) При постановке дифференциального диагноза отдельных цитологических видов острой лейкемии:
— Миелобласты и промиелоуиты ШИК-отрицательные или приобретают слабую диффузную окраску. Тела Ауера дают положительную реакцию, которая ослабевает после переваривания со слюной.
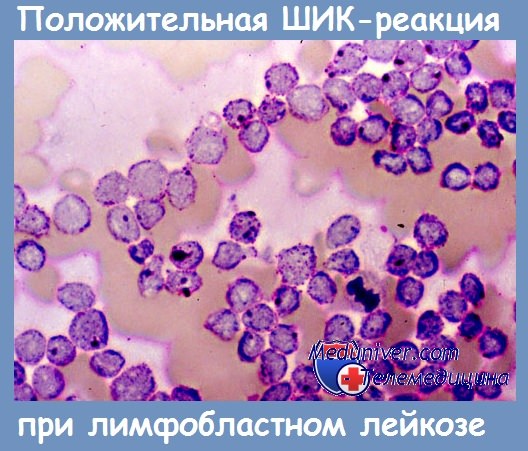
— Лимфобласты при острой лейкемии и лимфосаркоме дают резкую ШИК-положительную реакцию в виде зерен или крупных блоков гликогена.
— Эритробласты при эритремии и острой эритролейкемии дают резко положительную рассеянную или зернистую реакцию, в противоположность нормальным эритробластам, которые ШИК-отрицательные;
— Моноцитоидные б ласты непостоянно слабо положительные, с тонкой зернистостью.
б) В целях постановки диагноза и наблюдения за эффективностью лечения при хронической лимфатической лейкемии: завышенный показатель гликогена указывает на тяжелую форму заболевания и тяжкий прогноз.
Рост гликогена в патологических лимфоцитах не характерное для лейкемии явление, оно объясняется ростом метаболической активности при любом виде лимфоидной пролиферации.
в) Для дифференциации клеток Гоше от иных макрофагов с накоплением.
Видео методы окрашивания препаратов в гистологии
Редактор: Искандер Милевски. Дата обновления публикации: 5.5.2021
Источник
PAS-реакция
Механизм РАS-реакции основан на окислении йодной кислотой гликолевых групп или их амино- или алкиламино- производных до альдегидов. Альдегидные группировки при взаимодействии с реактивом Шиффа образуют продукт красного цвета (метод Mc Manus).
Мукополисахариды (новое название – гликозамингликаны) определяются во всех морфологически идентифицируемых клетках гранулоцитарного ряда. Концентрация PAS-положительного материала в клетках гранулоцитопоэза нарастает по мере созревания клеток. Диффузное окрашивание цитоплазмы обычно свойственно наиболее молодым клеткам гранулоцитарного ряда (миелобласты, промиелоциты, миелоциты). В зрелых нейтрофилах содержится много PAS-положительного вещества в виде мелких гранул, упакованных так плотно, что цитоплазматический фон плохо различим. В зрелых эозинофилах и базофилах PAS-положительный материал располагается следующим образом: специфические гранулы остаются неокрашенными и резко выделяются на фоне диффузного окрашивания цитоплазмы.
В моноцитах PAS-положительный материал чаще выявляется в виде мелкой пылевидной зернистости на фоне светло-розового диффузного окрашивания.
В норме от 3 до 10% клеток эритроидного ряда содержат мукополисахариды.
В тромбоцитах PAS-положительный материал выявляется в виде мелких рассеянных гранул по периферии клетки либо в виде интенсивного центрально расположенного пятна.
В лимфоцитах концентрация мукополисахаридов меньше, чем в гранулоцитах. В норме 2 – 30% лимфоцитов периферической крови содержат PAS-положительный материал, располагающийся в виде гранул вокруг ядра, в 1-2% клеток гранулы могут быть интенсивно окрашены и образуют крупные блоки.
Нормальные цитохимические показатели содержания гликогена в лейкоцитах 95–100% нейтрофилов. PAS-реакция выявляется в диффузной форме. От 2 до 30% лимфоцитов содержат PAS-положительное вещество в гранулярной форме.
Рис. 5. Диффузная PAS-реакция в нейтрофилах, гранулярная – в лимфоците.
Рис. 6. Диффузно-гранулярная PAS-реакция в бластах (М5).
Клиническое значение определения PAS-реакции
При диагностике острых миелобластных лейкозов бластные клетки могут быть либо PAS-отрицательными, либо обнаруживать слабодиффузное окрашивание цитоплазмы. Яркое диффузное окрашивание цитоплазмы наблюдается только при остром промиелоцитарном лейкозе. В монобластах реакция может быть отрицательной, слабо положительной в диффузной или диффузно-гранулярной форме (когда продукт реакции выявляется в виде рассеянных мелких или средних гранул, располагающихся по краю цитоплазмы, на диффузном фоне). В то же время при ОЛЛ бласты содержат гликоген в цитоплазме в виде средних и крупных гранул, располагающихся венчиком вокруг ядра, иногда сливающихся в блоки, на неокрашенном фоне. Количество клеток с таким характером PAS-реакции сильно варьируется при различных случаях ОЛЛ.
Дата добавления: 2015-09-11 ; просмотров: 4 | Нарушение авторских прав
Источник
Иммуногистохимические методы дифференциальной диагностики протоковых и дольковых карцином in situ молочной железы
Ефремов Г.Д. 1 , Завалишина Л.Э. 2 , Франк Г.А. 2
1) ФГУ «НИИ Урологии Минздравсоцразвития РФ», лаборатория патологической анатомии,
2) ФГБУ «МНИОИ им. П.А.Герцена Минздрава России, отделение патанатомии,
Москва Россия
Цель работы: определение наиболее эффективной комбинации биологических характеристик для дифференциальной диагностики между протоковыми и дольковыми карциномами in situ, особенно в случаях необычной морфологической структуры опухоли.
Материалы и методы. В исследуемую группу вошли 99 пациенток, проходивших лечение или обследованных в МНИОИ им. П.А. Герцена по поводу карциномы in situ молочной железы. Среди них были 71 больная с протоковой формой преинвазивной карциномы и 28 больных с дольковой формой заболевания. Для исследования были выбраны следующие антитела: Е-кадхерин и β-катенин (маркеры клеточной адгезии), CK 5/6 и CK 14 (маркеры базального эпителия), CK-H (34βE12).
Результаты. Экспрессия Е-кадхерина была выявлена в 68 образцах внутрипротокового рака in situ (95,7%). Во всех наблюдениях классической внутридольковой карциномы первого типа (19, 68%) было выявлено полное отсутствие экспрессии Е-кадхерина. Среди случаев с выраженной клеточной атипией (второй тип) выявлены 4 (14,2%) с наличием полного мембранного окрашивания клеток. При оценке полученных результатов высокомолекулярного цитокератина наблюдали позитивное окрашивание в классической дольковой карциноме in situ (16 наблюдений из 19,84%). Кроме того, позитивное окрашивание опухолевых клеток на высокомолекулярный цитокератин отмечали в 14% случаев внутрипротоковой карциномы (10 из 71), причем в четырех случаях окрашивание было интенсивным. Положительная экспрессия цитокератина 5/6 типа была получена в 3 наблюдениях внутрипротокового и одном – внутридолькового рака. Экспрессия цитокератина 14 типа была обнаружена у 1 больной протоковой карциномой in situ и у 1 – внутридольковой карциномой. Коэкспрессия цитокератинов 5/6 и 14 была найдена в 3 образцах протоковой и 1 образце внутридольковой карциномы. Таким образом, экспрессия цитокератинов 5/6 и 14 была обнаружена в 4 случаях протоковой и 2 случаях дольковой карциномы in situ. В остальных наблюдениях эти протеины экспрессировались только миоэпителиальными клетками.
Выводы. Определен алгоритм дифференциальной диагностики между дольковыми и протоковыми карциномами in situ, позволяющий быстро и эффективно различать их между собой, особенно в случае нестандартной или редкой гистологической формы опухоли.
Ключевые слова: карцинома in situ, протоковая карцинома in situ, дольковая карцинома in situ, иммуногистохимия, неинвазивный рак молочной железы.
Дифференциальный диагноз между протоковыми и дольковыми карциномами in situ молочной железы имеет важное клиническое значение в связи с различной лечебной тактикой в современной терапии пациенток.
Дольковая карцинома in situ была исторически выделена как отдельная морфологическая форма дольковой неоплазии, характеризующаяся внутридольковой пролиферацией мономорфных мелких клеток, полностью выполняющих структуру дольки и ведущих к ее расширению [1]. Первоначально дольковая карцинома in situ представляли как облигатное предопухолевое заболевание. Это предположение базировалось на морфологическом подобии дольковой карциномы in situ с инвазивным дольковым раком. Публикации C.D. Haagensen и соавт. (1978), P.P. Rosen и соавт. (1978) показали, что изменения эпителия долек, описываемые как дольковый рак in situ и атипическая дольковая гиперплазия, не имеют существенного прогностического значения для последующего развития инвазивной карциномы [2, 3]. И сейчас, спустя более чем шестьдесят лет после первоначального описания, роль дольковой карциномы in situ в развитии инвазивного рака окончательно не определена. В последние годы она рассматривается скорее как индикатор риска развития инвазивной карциномы, а не как истинное предопухолевое поражение. В связи с этим современная терапия дольковой карциномы in situ в большинстве случаев предполагает наблюдение после проведенной биопсии и терапию антиэстрогенами [24].
Протоковая карцинома in situ, в отличие от дольковой, по мнению многих авторов, представляет собой неопластическое внутрипротоковое поражение, характеризующееся эпителиальной пролиферацией, клеточной атипией и потенциальной способностью к инвазии. Этот вид карциномы in situ считают заболеванием, увеличивающим риск развития инвазивного рака молочной железы в 8-10 раз [4, 5]. В зависимости от степени ядерного полиморфизма и внутрипротокового некроза, в меньшей степени от митотической активности и гистологического строения, протоковую карциному in situ подразделяют на три степени дифференцировки. Часто обнаруживаются поражения разной степени дифференцировки в пределах материала одной и той же биопсии или даже в пределах одного протока.
В большинстве случаев типичные морфологические признаки позволяют успешно дифференцировать протоковую и дольковую карциномы между собой. Однако существует ряд таких атипичных форм, как плеоморфная дольковая карцинома in situ, солидная форма протоковой карциномы или карцинома in situ с центральным некрозом (комедонекрозом), встречающаяся как при дольковой, так и при протоковой форме заболевания, псевдоацинарная форма внутридольковой карциномы и смешанный вариант с характерными как для внутридольковой, так и для внутрипротоковой карцином чертами. Эти формы зачастую сложны для однозначной трактовки морфологом. В связи с этим в последние годы широко применяются иммуногистохимические методы исследования, позволяющие эффективно классифицировать карциномы in situ сложной структуры. Для дифференциальной диагностики в этой группе опухолей используется Е-кадхерин – трансмембранный протеин, являющийся одним из основных белков межклеточной адгезии. Потеря мембранной экспрессии Е-кадхерина считается характерным признаком дольковой неоплазии, в то время как большинство протоковых карцином интенсивно экспрессируют белок так же, как и нормальный протоковый эпителий. Однако изредка встречающаяся потеря экспрессии Е-кадхерина клетками протоковой карциномы так же, как и появление экспрессии протеина при дольковых неоплазиях, может вести к диагностическим ошибкам [6]. Поэтому ведется поиск дополнительных характеристик опухоли, которые могут быть значимыми в таких случаях.
Селективная потеря экспрессии Е-кадхерина, протеина клеточной адгезии, в настоящее время считают одной из общепринятых характеристик дольковых неоплазий 11. Основной причиной потери экспрессии при этом виде опухолей является делеция длинного плеча 16 хромосомы, на котором находится ген CDH1, кодирующий Е-кадхерин [13].
Однако, по данным литературы, этот маркер не является абсолютно эффективным, т.к. в 5-10% случаев выявляется экспрессия Е-кадхерина в дольковых неоплазиях, и примерно в таком же проценте случаев протоковых раков экспрессия этого протеина может отсутствовать или быть очень слабой [6, 14, 15]. Ослабление экспрессии Е-кадхерина в протоковых карциномах в первую очередь может быть связано с такими влияющими на экспрессию протеина эпигенетическими нарушениями, как гиперметилирование гена CDH1, или с вторичной модификацией совершенно нормального белка [16]. Однако следует иметь в виду и возможные артефакты, зависящие от проведения иммуногистохимического исследования. Так, Y.J. Choi и соавт., используя два различных вида антител к Е-кадхерину (ECH-6, Cell Marque и NCH-38, Dako) c различными системами детекции (LSAB2 и EnVision), получили дискордантные результаты в 5 случаях из 78 (6,4%) [6]. В то же время аберрантная экспрессия E-кадхерина при дольковых опухолях в ряде случаев может быть связана с неспецифическим связыванием антитела с цитоплазматическими белками P и N-кадхеринами [17] или ошибочной интерпретацией экспрессии протеина на мембранах остаточных клеток протокового эпителия или миоэпителиальных клетках [15]. Ряд исследователей используют как дополнительные маркеры высокомолекулярный цитокератин, специфичный для клеток дольковой неоплазии, и мембранные белки α-, β- и γ-катенины, характерные для протоковых клеток [7, 8] и также участвующие в процессах адгезии.
Целью нашей работы стало определение наиболее эффективной комбинации биологических характеристик для дифференциальной диагностики между протоковыми и дольковыми карциномами in situ, особенно в случаях необычной морфологической структуры опухоли.
Материалы и методы
В исследуемую группу вошли 99 пациенток, проходивших лечение или обследованных в МНИОИ им. П.А. Герцена с 1993 по 2009 гг. по поводу карциномы in situ молочной железы. Среди них были 71 больная с протоковой формой преинвазивной карциномы и 28 с дольковой формой заболевания, что составило 71,7% и 28,3% соответственно. Средний возраст больных, включенных в исследование, – 56,4 года (38-75 лет). 29 (29,3%) пациенток находились в менопаузе, 70 (70,7%) – в репродуктивном периоде. У всех больных, кроме одной, определялось одностороннее поражение молочной железы (98,9%).
Образцы опухолевой ткани для исследования получали методом толстоигольной биопсии (6-6%) или после секторальной резекции (63-63,6%), секторальной резекции с расширенной лимфаденэктомией (21-21,2%), мастэктомии (9-9%).
Биоптаты и образцы операционного материала фиксировали в 10%-ном нейтральном забуференном формалине и заливали в парафиновые блоки после соответствующей проводки. Срезы окрашивали гематоксилином и эозином.
Оценку морфологических характеристик (некроз, поляризация клеток по отношению к базальной мембране) проводили по принципу: 0 – отсутствие признака, 1 – наличие признака.
Для иммуногистохимических исследований отбирали наиболее показательные фрагменты, с которых выполняли срезы толщиной 4 микрона. Срезы наносили на высокоадгезивные стекла и высушивали при температуре 37°С в течение 18 часов. Восстановление антигенной активности проводили в миниавтоклаве 2100 Retrieval (Pick Cell) при 121°С в течение 20 мин. и последующем остывании в течение 90 мин. Восстановление проводили в цитратном буфере рН 6,0. В качестве детектора применяли систему EnVision (Dako), в качестве хромогена – диаминобензидин. Для получения результатов, пригодных для количественной обработки, реакции проводили с помощью автоматического иммуногистостейнера Avtostаiner Dako. Для исследования были выбраны следующие антитела: Е-кадхерин и β-катенин (маркеры клеточной адгезии), CK 5/6 и CK 14 (маркеры базального эпителия), CK-H (34 βE12).
Используемые антитела и условия проведения реакций (метод восстановления антигенной активности и разведения антител) представлены в таблице 1.
Таблица 1. Характеристика использованных антител.
| Наименование | Фирма производитель | Разведение | Условия демаскировки |
|---|---|---|---|
| Е-кадхерин моноклональные | Dako | 1:100 | 121°, pH 6,0 цитратный буфер |
| β-катенин моноклональные | Dako | 1:200 | 121°, pH 6,0 цитратный буфер |
| CK-H (34bE12) | Dako | 1:50 | 121°, pH 6,0 цитратный буфер |
| CK 5/6 | Dako | 121°, pH 6,0 цитратный буфер | |
| CK 14 | Novocastra | 1:70 | 121°, pH 6,0 цитратный буфер |
| ER моноклональные | Dako | 1:35 | 121°, pH 6,0 цитратный буфер |
| PgR моноклональные | Dako | 1:50 | 121°, pH 6,0 цитратный буфер |
Интенсивность реакций, локализованных на мембранах клеток, оценивали полуколичественным способом по балльной шкале от 0 до 3 с помощью анализатора изображения Leica Q550:
0 – отсутствие реакции;
1 – слабая реакция, частичное, точечное окрашивание;
2 – умеренная реакция, полностью окрашенные мембраны;
3 – сильная реакция, полностью окрашенные мембраны.
Пороговым значением позитивности считали обнаружение в препарате более 5% окрашенных клеток. Результаты реакций с антигенами, имеющими ядерную локализацию (рецепторы эстрогенов и прогестеронов), оценивали путем подсчета количества окрашенных ядер на 100 ядер в 3 полях зрения, полученные результаты оценивали по 8-балльной шкале.
Статистическую обработку полученных данных проводили на персональном компьютере в программе «Статистика» (Statsoft, Inc.). Сравнительный анализ параметрических признаков проводился с помощью критерия Стьюдента, непараметрические количественные признаки оценивали с помощью критерия Манна-Уитни. Для сравнения качественных признаков использовали критерий χ 2 и критерий Фишера.
Результаты морфологического исследования
В зависимости от клеточного состава и структурных особенностей дольковой карциномы in situ мы разделили все наблюдения на два основных типа. При первом, классическом типе (19 наблюдений, 68%) клетки, выполняющие просвет ацинусов и концевых протоков, были мелкие и однородные. Ядра клеток округлые, мономорфные, без структуризации хроматина, митозы отсутствовали. Цитоплазма была почти неразличима. Иногда среди мелких однородных клеток встречались более крупные со светлой, оптически пустой цитоплазмой и структурным ядром. При этом клетки, заполняющие просвет ацинусов, в отличие от протоковой карциномы in situ, лежали разрознено. Второй, плеоморфный тип (6 наблюдений, 21,4%) характеризовался нарастанием анапластических признаков. В этом случае ацинусы и концевые протоки были существенно увеличены по сравнению с первым типом. Клетки, выполняющие просветы ацинусов, были больших размеров, ядра клеток более крупные, преимущественно мономорфные, светлые с равномерным распределением хроматина. Митозы встречались редко. В двух случаях (7%) были отмечены черты солидной внутридольковой карциномы, в одном случае (3,5%) выявлялось поражение со смешанными чертами внутридольковой и внутрипротоковой карцином (рис. 1).
Рис. 1. Солидные структуры, клеточный состав которых не позволяет однозначно провести дифференциальный диагноз между высокодифференцированной протоковой и дольковой карциномой in situ. Окраска гематоксилин-эозином, ув. ×40.
Внутрипротоковые карциномы in situ в зависимости от гистологического строения, наличия внутрипротокового некроза, степени ядерного полиморфизма и митотической активности были разделены на две группы по степени дифференцировки – высоко- и низкодифференцированные (табл. 2).
Таблица 2. Варианты архитектоники внутрипротокового рака in situ.
| Варианты | Высокодифференцированный (n=34) | Низкодифференцированный (n=37) | ||
|---|---|---|---|---|
| Абс. | % | Абс. | % | |
| Угревидный | – | – | 19 | 51,4 |
| Солидный | 12 | 35,3 | 2 | 5,4 |
| Криброзный | 7 | 20,6 | 12 | 32,4 |
| Папиллярный | 15 | 44,1 | 3 | 8,1 |
| Стелющийся | – | – | 1 | 2,7 |
Высокодифференцированная внутрипротоковая карцинома in situ (34 случая, 47,9%) была представлена мелкими мономорфными клетками, образующими аркады, микропапиллярные, криброзные или солидные структуры. Ядра однородны и имеют правильное распределение хроматина с малозаметными нуклеолами. В отдельных случаях встречались редкие фигуры митоза. В просвете некоторых протоков имелись слущенные клетки. Некроз и угревидные структуры отсутствовали.
Очаги низкодифференцированной внутрипротоковой карциномы (37 случаев, 52,1%) были образованы резко атипичными клетками, расположенными как в один слой, так и с формированием микропапиллярных, криброзных и солидных структур. Ядра клеток отличались резким полиморфизмом, плохой поляризацией, нечетким контуром и грубым распределением хроматина с четкими нуклеолами. Фигуры митоза и микрокальцинаты встречались часто, но не во всех случаях. Характерным признаком низкодифференцированного внутрипротокового рака in situ являлся угревидный некроз (комедонекроз) с наличием в центре эпителиальных структур некротических масс, окруженных пролиферирующими крупными полиморфными клетками опухоли.
Экспрессия Е-кадхерина была выявлена в 68 образцах внутрипротокового рака in situ (95,7%), причем в большинстве случаев уровень экспрессии был оценен как 3+ (66 образцов, 93%) и лишь в 2 случаях оценивался как 2+. На рисунке 2 представлена характерная картина полного мембранного окрашивания при типичной внутрипротоковой карциноме. Три случая, в которых экспрессия Е-кадхерина отсутствовала, были первоначально охарактеризованы по морфологическим критериям как высокодифференцированная протоковая карцинома in situ солидного строения.
Рис. 2. Положительная экспрессия Е-кадхерина в протоковой карциноме in situ. Ув. ×40.
Во всех наблюдениях классической внутридольковой карциномы первого типа (19 случаев, 68%) было выявлено полное отсутствие экспрессии Е-кадхерина. Среди случаев, квалифицированных при морфологическом исследовании как внутридольковый рак с выраженной клеточной атипией (второй тип), были выявлены 4 случая (14,2%) с наличием полного мембранного окрашивания клеток, причем в трех интенсивность окрашивания была оценена как 3+, в одном – как 2+. Случай, характеризующийся смешанными морфологическими признаками, также показал выраженную экспрессию Е-кадхерина, расцененную как 3+.
Таким образом, исследование экспресии Е-кадхерина доказало его высокую специфичность как маркера, характерного для внутрипротоковой карциномы: его экспрессия определялась при этом виде опухолей достоверно чаще (р=0,0005; RR=6,7; 95% CI 3,21–14,12).
Тем не менее, в 7 случаях слабой или спорной экспрессии Е-кадхерина для уточнения диагноза было проведено иммуногистохимическое исследование с антителами к β-катенину как дополнительному показателю, характерному для протоковых неоплазий. Позитивное мембранное окрашивание было получено в 2 из 3 внутрипротоковых карцином, негативных по экспрессии Е-кадхерина, что подтвердило протоковую природу этих поражений. В одном примере экспрессия β-катенина также была отрицательной, и он был, таким образом, квалифицирован как внутридольковая карцинома. В двух из 4 наблюдений дольковой карциномы in situ с аберрантной экспрессией Е-кадхерина была обнаружена экспрессия β-катенина, что позволило отнести эти опухоли к внутрипротоковым, несмотря на первичный морфологический диагноз. В 2 случаях окрашивание на β-катенин было негативным.
Наряду с исследованием уровня экспресии молекул адгезии было проведено изучение экспрессии высокомолекулярного цитокератина, который ряд авторов считают специфическим маркером долькового эпителия. При оценке полученных результатов было показано, что позитивное окрашивание характерно для большинства случаев классической дольковой карциномы in situ (16 наблюдений из 19, 84%), интенсивность окрашивания варьировала от 2+ до 3+, иммуногистохимическая реакция локализовалась в перинуклеарной области цитоплазмы. Кроме того, позитивное окрашивание опухолевых клеток на высокомолекулярный цитокератин отмечали в 14% случаев внутрипротоковой карциномы (10 из 71), причем в четырех наблюдениях окрашивание было интенсивным. В одном из них экспрессия Е-кадхерина и β-катенина отсутствовала, что позволило дополнительно подтвердить дольковую природу опухоли. В целом, экспрессию высокомолекулярного цитокератина при дольковой карциноме in situ выявляли достоверно чаще, чем при протоковой (р=0,0006; RR=4,05; 95% CI 1,99-8,12).
Было также оценено иммуногистохимическое окрашивание с антителами к цитокератинам 5/6 и 14 типов. Положительная экспрессия цитокератина 5/6 типа была получена в 3 наблюдениях внутрипротокового и 1 внутридолькового рака. Экспрессия цитокератина 14 типа была обнаружена у одной больной протоковой карциномой in situ и у одной внутридольковой карциномой. Коэкспрессия цитокератинов 5/6 и 14 была найдена в 3 образцах протоковой и одной внутридольковой карциномы. Таким образом, экспрессия цитокератинов 5/6 и 14 была обнаружена в 4 случаях протоковой и 2 дольковой карциномы in situ. В остальных наблюдениях эти протеины экспрессировались только миоэпителиальными клетками (рис. 3). Очевидно, что эти маркеры не могут быть использованы для дифференциальной диагностики между дольковыми и протоковыми карциномами in situ. В позитивных по экспресии цитокератинов случаях была исследована экспрессия рецепторов эстрогена и прогестерона. Во всех случаях она отсутствовала, что позволило отнести их к базальноклеточному раку in situ.
Рис. 3. Отрицательная экспрессия СК-5/6 в протоковой карциноме in situ. Положительная экспрессия данного цитокератина в базальных клетках может служить внутренним контролем. Ув. ×10.
Наше исследование подтверждает результаты опубликованных ранее работ, показывающих, что в ряде случаев морфологические признаки не позволяют эффективно дифференцировать внутридольковую и внутрипротоковую карциномы in situ. В первую очередь это относится к нестандартным типам карцином, таким как плеоморфная и псевдоацинозные формы внутридолькового рака, солидная форма внутрипротоковой карциномы и др.
Для выяснения причин потери экспрессии или аберрантной экспрессии Е-кадхерина, обнаруженной нами в 7 (7%) из 99 случаев долькового и протокового рака in situ, было проведено дополнительное иммуногистохимическое исследование с применением антител к β-катенину как альтернативному маркеру протоковой неоплазии. В норме β-катенин в сочетании с α- и γ-катенинами составляет единый связывающий комплекс с Е-кадхерином на клеточной мембране [8]. В ряде случаев при нарушении экспрессии Е-кадхерина по тем или иным причинам экспрессия катенинов сохраняется и может служить альтернативным маркером присутствия связывающего комплекса на мембране [7]. В нашем исследовании дополнительное использование β-катенина в качестве дополнительного маркера протоковых неоплазий позволило квалифицировать 4 опухоли из 7 с аберрантной экспрессией Е-кадхерина как внутрипротоковую карциному, а 3 предположительно отнести к дольковым поражениям.
В дополнение к белкам адгезии нами была изучена экспрессия высокомолекулярного цитокератина как важного показателя, характерного для дольковых неоплазий, успешно использованного некоторыми исследователями ранее [18]. Было получено окрашивание мембран и цитоплазмы клеток большинства дольковых (84%) и части протоковых (14%) карцином in situ. Степень окрашивания, как правило, была слабой или средней степени выраженности. Эти результаты в целом совпадают с данными, полученными другими исследователями. Так, Wheeler и соавт. в своем исследовании, посвященном изучению тубулолобулярных опухолей, отмечали, что часть низкодифференцированных внутрипротоковых карцином умеренно экспрессировали высокомолекулярный цитокератин [19], а Lacroix-Triki с соавт. обнаружили, что окрашивание клеток дольковых карцином в ряде случаев было слабым [20]. По мнению авторов, причиной подобной неоднозначной реакции может быть перекрестная реакция антитела 34βЕ12 с цитокератином 14 типа, который, экспрессируясь в инвазивных карциномах, является признаком неблагоприятного прогноза [21, 22]. Однако значение экспрессии этого маркера при карциномах in situ пока не совсем ясно. Кроме того, причиной дискордантной экспрессии могут быть такие технические особенности метода окрашивания, как выбор титра антител и системы детекции. Тем не менее, окрашивание на высокомолекулярный цитокератин может быть использовано как дополнительный маркер внутридолькового рака in situ, поскольку экспресссию этого маркера выявляли при дольковых раках достоверно чаще (р=0,006).
Исследование экспрессии цитокератинов базального типа (СК5/6 и СК14) также выявило дополнительные характеристики протоковой и дольковой карциномы in situ. При анализе полученных результатов обращает на себя внимание тот факт, что во всех 6 случаях положительной экспрессии СК5/6 и СК14 отсутствовала экспрессия рецепторов эстрогенов и прогестерона, что позволило отнести эти опухоли к базальному типу карцином in situ. Прогностическое значение базалоидной карциномы пока не до конца ясно, однако есть предположения, что подобный тип карцином обладает более агрессивным поведением и чаще ассоциируется с развитием инвазивного рака молочной железы [23].
Таким образом, нами определен алгоритм дифференциальной диагностики между дольковыми и протоковыми карциномами in situ, позволяющий быстро и эффективно различать их между собой, особенно в случае нестандартной или редкой гистологической формы опухоли. Кроме учета морфологических признаков, при дифференциальной диагностике необходимо использование иммуногистохимического исследования, прежде всего с двумя маркерами (Е-кадхерин и β-катенин), помогающими достоверно выявить экспрессию характерных антигенов.
- Foote F., Stewart F. Lobular carcinoma in situ: a rare form of mammary carcinoma. Am. J. Pathol. 1941; 17: 491-499.
- Haagensen C.D., Lane N., Lattes R., Bodian C. Lobular neoplasia (so-called lobular carcinoma in situ) of the breast. Cancer. 1978; 42: 737-769.
- Rosen P.P., Kosloff C., Lieberman P.H. et al. Lobular carcinoma in situ of the breast. Detailed analysis of 99 patients with average follow-up of 24 years. Am. J. Surg. Pathol. 1978; 2: 225-251.
- Page D.L., Dupont W.D., Rogers L.W., Rados M.S. Atypical hyperplastic lesions of the female breast. A long-term follow-up study. Cancer. 1985; 55: 2698-2708.
- Fitzgibbons P.L., Henson D.E., Hutter R.V. Benign breast changes and the risk for subsequent breast cancer: an update of the 1985 consensus statement. Cancer Committee of the College of American Pathologists. Arch. Pathol. Lab. Med. 1998; 122(12): 1053-1055.
- Choi Y.J., Pinto M.M., Hao L., Riba A.K. Interobserver variability and abberant E-kadherin immunostaining of lobular neoplasia and infiltrating lobular carcinoma. Mod. Pathol. 2008; 21: 1224-1237.
- Dabbs D.J., Bhargava R., Chivukula M. Lobular versus ductal breast neoplasms: the diagnostic utility of p210 catenin. Am. J. Surg. Pathol. 2007; 31: 427-437.
- Esposito N.N., Chivukula M., Dabbs D.J. The ductal phenotipic expression of the E-cadherin/catenin complex in tubulolobular carcinoma of the breast: an immunohistochemical and clinicopathologic study. Mod. Pathol. 2007; 20:130-138.
- Sullivan M.E., Seema A.K., Sullu Y. et al. Lobular carcinoma in situ variants in breast cores. Arch. Pathol. Lab. Med. 2010, 134: 1024-1028.
- Mall R., Mitze M., Frixen U.H., Birchmeier W. Differential loss of E-kadherin expression in infiltrating ductal and lobular breast carcinomas. Am. J. Pathol. 1993; 143(6): 1731-1742.
- Wahed A., Connelly J., Reese T. E-cadherin expression in pleomorphic lobular carcinoma: an aid to differentiation from ductal carcinoma. Ann. Diagn. Pathol. 2002; 6(6): 349-351
- Acs G., Lawton T.J., Rebbeck T.R. et al. Differential expression of E-cadherin in lobular and ductal neoplasms of the breast and its biologic and diagnostic implications. Am. J. Clin. Pathol. 2001; 115: 85-98.
- Hwang E.S., Nyante S.J., Chen Y.Y., et al. Clonality of lobular carcinomas in situ and synchronous invasive lobular carcinoma. Cancer. 2004; 100: 2562-2572.
- Da Silva L., Parry S., Reid L., et al. Aberrant expression of E-cadeherin in lobular carcinomas of the breast. Am. J. Surg. Pathol. 2008; 32: 773-783.
- Hwang H., Sullivan M.E., Susnik B. Lobular neoplasia. Diagn. Histopath. 2010; 16(7):337-344.
- Sarrio D., Moreno-Bueno G., Hardisson D., et al. Epigenetic and genetic alterations of APC and CDH1 genes in lobular breast cancer: relationships with abnormal E-cadherin and catenin expression and microsatellite instability. Int. J. Cancer. 2003; 106: 208-215.
- Lehr H.A., Folpe A., Yaziji H,. et al. Cetokeratin 8 immunostaining pattern and E-cadherin expression distinguish lobular from ductal breast carcinoma. Am. J. Clin. Pathol. 2000; 114: 190-196.
- Bratthauer G.L., Moinfar F., Stamatakos M.D., et al. Combined E-cadherin and high molecular weight cytokeratin immunoprofile differentiates lobular, ductal and hybrid mammary intraepithelial neoplasias. Hum. Path. 2002; 33(6): 620-627
- Wheeler D.T., Tai L.H., Bratthauer G.L., et al. Tubulolobular carcinoma of the breast: An analysis of 27 cases of a tumor with hybrid morphology and immunoprofile. Am. J. Surg. Pathol. 2004; 28: 1587-1593.
- Lacroix-Triki M., Mery E., Voigt J.J., et al. Value of cytokeratin 5/6 immunostaining using D5/16 B4 antibody in the spectrum of proliferative intraepithelial lesions of the breast. A comparative study with 34betaE12 antibody. Virchows. Arch. 2003; 442: 548-554.
- Dairkee S.H., Puett L., Hackett A.J. Expression of basal and luminal epithelium-specific keratins in normal, benign and malignant breast tissue. J. Natl. Cancer. Inst. 1988; 80: 691-695.
- Malzahn K., Mitze M., Thoenes M., Moll R. Biological and prognostic significance of stratified epithelial cytokeratins in infiltrating ductal breasts carcinomas. Virchows. Arch. 1998; 433: 119-129.
- Lamovec J., Falconieri G., Salviato T., Pizzolito S. Basaloid carcinoma of the breast: a review of 9 cases, with delineation of a possible clinicopathologic entity. Ann. Diagn. Pathol. 2008; 12(1): 4-11.
- Митрофанова Н.А., Семиглазов В.Ф., Семиглазов В.В., Бусько Е.А., Зайцев А.Н., Топузов Э.Э. Рак молочной железы. М.: МЕДпресс-информ. 2009; 97-101.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Источник