Неудачи ЭКО: эмбриологический этап

1. «Ооцитарный фактор» — это получение в цикле ЭКО яйцеклеток плохого качества. Общеизвестный факт, что с возрастом женщины качество ооцитов стремительно ухудшается.
У пациенток младше 35 лет, довольно редко, но также возможно получение яйцеклеток низкого качества. В таких ситуациях крайне сложно ответить на вопрос, с чем может быть это связано, но, как правило, с генетикой, с гормональной стимуляцией, эндометриозом, с различными эндокринными нарушениями (особенно часто с ожирением).
Сейчас активно ведутся исследования по изучению данного фактора бесплодия. Но, к сожалению, пока они не завершены и не имеют практического значения.
В случае установления ооцитарного фактора (а понять это возможно только при получении ооцитов при пункции фолликулов) предлагается замена протокола гормональной стимуляции, переход на ЭКО в естественном цикле. При неэффективности этих схем, переход на ЭКО с донорскими ооцитами.
Плохое качество сперматозоидов не так прямо связано с возрастом мужчины, больше с различными внутренними и внешними неблагоприятными факторами, но также может быть причиной неудач ЭКО.
2. Неправильное оплодотворение
В яйцеклетке и сперматозоиде в норме содержится по 23 хромосоме. В процессе оплодотворения в яйцеклетке формируется 2 клеточных ядра (пронуклеуса) — 2 pn — женское и мужское. Оплодотворённая яйцеклетка (зигота) содержит в норме 46 хромосом (23 от матери и столько же от отца).
Пронуклеусы в оплодотворённой яйцеклетке становятся видны через 12-14 ч после проникновения в неё сперматозоида. Через 19-22 часа пронуклеусы исчезают и формируется метафазная пластинка, а ещё через 3-4 часа начинается деление зиготы.
Послее дробления зиготы с аномалиями оплодотворения могут быть неотличимы от нормально оплодотворённых ооцитов. Поэтому наблюдение пронуклеусов имеет важное значение — по их количеству оценивается правильное формирование эмбриона.
Встречаются следующие патологии формирования пронуклеусов:
— 1 pn — присутствие в зиготе одного пронуклеуса может говорить об активации яйцеклетки без участия сперматозоида, реже — о слиянии ядер гамет и образование диплоидной зиготы с одним пронуклеусом;
— 3 pn — наличие 3-х пронуклеусов возможно при :
— * оплодотворении одной яйцеклетки 2-мя сперматозоидами;
— * формирование 3-го пронуклеуса из материала невыделившегося второго полярного тельца;
— * формирование 3-го пронуклеуса путём аномального формирования ядерной мембраны ;
— реже встречаются >3 pn.
ИКСИ (введение одного сперматозоида в цитоплазму яйцеклетки) не гарантирует правильного оплодотворения. Это объясняется главным образом сохранением второго полярного тела во время второго мейотического деления ооцита. Но 3 pn при этом варианте оплодотворения встречается реже, по разным данным
В неправильном оплодотворении могут играть роль следующие факторы:
— повышенные уровни эстрогенов в стимулированном цикле;
— продолжительность гормональной стимуляции;
— качество ооцита («гигантские» ооциты предрасположены к неправильному оплодотворению);
— поздний репродуктивный возраст женщины (по данным американских учёных H. J. Kang, Z. Rosenwaks частота оплодотворения и 3 pn достоверно выше у пациенток после 39 лет, несмотря на метод оплодотворения)
3. Остановка развития эмбрионов после правильного оплодотворения
В современных эмбриологических лабораториях процесс культивирования эмбрионов отработан до мелочей и тщательно соблюдается: индивидуальное культивирование эмбриона в планшетных инкубаторах; постоянный многоуровневый контроль условий культивирования; своевременная смена питательных сред, если культивирование происходит в двухступенчатых средах.
Поэтому при стабильных условиях культивирования, причину плохого развития остается искать только в качестве самого материала.
На остановку эмбриогенеза влияет качество как самих яйцеклеток, так и качество сперматозоидов.
Как правило, основное влияние на ход эмбриогенеза оказывает возраст родителей. Хотя и в молодом возрасте может наблюдаться снижение качества яйцеклеток, например, при эндометриозе, неясном генезе бесплодия. Причиной могут быть аномалии в хромосомном наборе самих родителей.
Принято считать, что до 3 дня развития эмбрион живет и развивается на материнских запасах, то есть, остановка или ухудшение развития до 3 суток указывает на плохое качество яйцеклетки.
На 3 сутки развития начинает работать сам геном эмбриона. И здесь добавляются факторы, привнесенные в эмбрион сперматозоидом. К сожалению, очень многие отклонения от нормы в качестве сперматозоидов и хроматина внутри них оказывают влияние на развитие эмбриона и могут вызывать анеуплоидии или недостаточность генома эмбриона. Качество конденсации и организации ДНК сперматозоида является важным фактором развития эмбриона, даже при выполнении ИКСИ.
Но есть данные, что некоторое количество материнской мРНК сохраняется до стадии бластоцисты и может также участвовать в остановке развития.
Хромосомные аномалии, несомненно, вызывают большой процент потерь эмбрионов. Генетические факторы регулируют скорость предимплантационного развития эмбриона. Существует тенденция к увеличению количества анеуплоидных эмбрионов с увеличением возраста. Большая часть анеуплоидий летальна для эмбриона на ранних стадиях развития. Но некоторые анеуплоидии не мешают эмбриону стать бластоцистой хорошего качества, например, при трисомии по 21 хромосоме, или синдроме Дауна.
В связи с этим, пациентам позднего репродуктивного возраста рекомендуется проведение предимплантационного генетического скрининга до переноса эмбриона в полость матки.
Кроме того, у пар более молодого возраста, если в нескольких циклах ЭКО при переносе эмбриона хорошего качества на стадии бластоцисты в однородный, достаточной толщины и хорошо кровоснабжающийся эндометрий беременность не наступает, необходимо выполнение предимплантационного генетического скрининга на все хромосомы. И, соответсвенно, переносить в полость матки эмбрион только с полным хромосомным набором.
Источник
Как проходит оценка качества эмбрионов? FAQ
Центральным звеном клиники ЭКО является эмбриологическая лаборатория. Для каждой попытки ЭКО заводится «Эмбриологический протокол», в котором отражается судьба каждого эмбриона от момента получения ооцитов и до момента переноса или замораживания.
Сразу после получения ооцитов и сперматозоидов производится их морфологическая оценка. По результатам анализа эякулята (спермограмме) принимают решение о способе оплодотворения – ЭКО или ИКСИ.
Описание: День 0. Непосредственно после пункции оценивают зрелость полученных ооцит-кумулюсных комплексов (ОКК). ОКК с прозрачным кумулюсом как правило содержит зрелый ооцит и получает оценку «1-1».При пункции возможно получение зрелых, незрелых, а также дегенеративных и разрушенных яйцеклеток. Точная оценка состояния ооцита возможна только после его очистки перед проведением ИКСИ.
В зрелых, готовых к оплодотворению ооцитах определяется первое полярное тельце. В эмбриологическом протоколе зрелый ооцит обозначают MII.
Если процесс созревания ооцита в фолликуле нарушен или неправильно введен триггер (ХГ), то существует большая вероятность получения незрелых клеток, обозначаемых – MI и GV (Рис.1). Возможна и полная дегенерация ооцита (Deg).
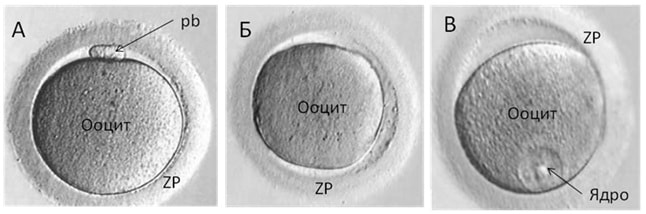
Рис 1. Ооциты, полученные при пункции яичников после удаления кумулюса (денюдации). А — MII, Б – MI, В – GV. Pb – полярное тельце, ZP – блестящая оболочка
Через 18-20 часов после добавления сперматозоидов или ИКСИ (1-е сутки) при нормальном оплодотворении образуются два пронуклеуса. Это предшественники ядер будущих клеток-бластомеров, на которые начинает делиться оплодотворенная яйцеклетка. При правильном оплодотворении оба пронуклеуса четко различимы. В этом случае им присваивают оценку 2pN. Если пронуклеусов не видно, что обычно связано с отсутствием оплодотворения, в протокол записывается 0pN. При неправильном оплодотворении возможно появление нескольких пронуклеусов, что отражается в записи, например 3pN, 6pN и т.д.(Рис2). «Неправильно» оплодотворенные ооциты не пригодны для дальнейшей работы и утилизируются.
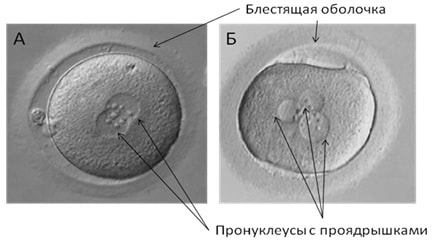
Рис 2. Первый день развития in vitro – формирование зиготы и образование пронуклеусов. А – 2pN (нормальное оплодотворение) – два пронуклеуса Б – 3pN (аномальное оплодотворение) – больше, чем два пронуклеуса.
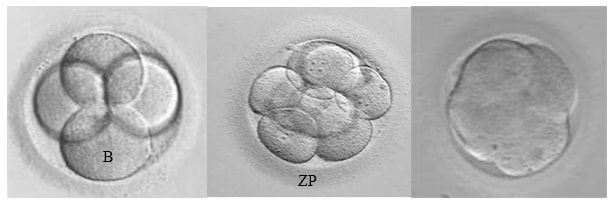
Дальнейшее развитие эмбриона, дробление, происходит в течение пяти-шести дней. Оценка качества эмбрионов проводится через 40-42 часа (2 сутки), 72-74 часа (3 сутки) и 120 часов (5 сутки) после оплодотворения. Дробление эмбриона должно быть симметричным (получаются бластомеры одинакового размера) и равномерным (все бластомеры претерпевают деление). Для наглядности эмбриологи используют численно – буквенную систему оценки качества, где цифра означает количество бластомеров, а буква их качество. Для обозначения эмбриона хорошего качества используется буквенный индекс «А», среднего «B», низкого «С». Возможны и промежуточные варианты, например АВ, ВА, ВС, СВ, когда сложно дать однозначную оценку (Рис3).
2-й день (4А) 3-й день (8А) 4-й день (comp)
Рис 3. Дробление эмбриона в течение первых трех суток in vitro и компактная морула на 4-й день развития. Представлены эмбрионы отличного (А) качества. B – бластомер ZP – блестящая оболочка.
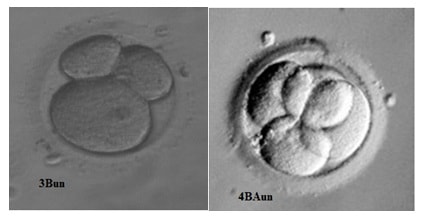
Для второго дня культивирования перспективными считаются эмбрионы с четырьмя бластомерами — 4А, 4АВ, 4В. Для третьего — восьмиклеточные (8А, 8АВ, 8В). Эмбрионы плохого качества (ВС, СВ, С) как правило не переносят, оставляют до пятого дня и при формировании нормальной бластоцисты замораживают или переносят в матку. В случае неравномерного дробления (наличия бластомеров разной величины) потенциал эмбриона к имплантации снижен, и обозначается это приставкой «un», например 3Вun. Наличие фрагментов цитоплазмы обозначают «fr», например 8ВСfr (Рис.4). Оценивается и наличие вакуолей. При их визуализации ставится отметка «vac». В норме каждый бластомер несет одно ядро, если хотя бы в одном бластомере визуализируется больше одного ядра, это называется мультинуклеацией (mN) и указывает на значительную вероятность хромосомной патологии данного эмбриона.
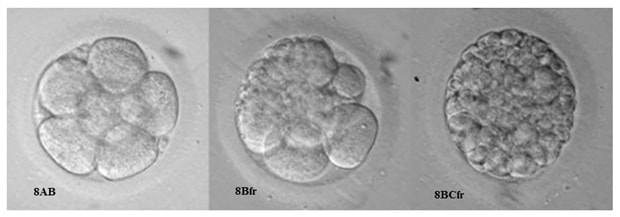
Рис 4. Дробление эмбриона в течение первых трех суток in vitro. Представлены эмбрионы хорошего (ВА, В) и удовлетворительного (ВС) качества. Во втором ряду эмбрионы с неравномерным дроблением (3Bun и 4BAun).
К концу третьих и на четвертые сутки культивирования эмбрион начинает компактизацию (границы его клеток становятся неразличимы) и готовится к образованию бластоцисты. Его клетки могут быть частично (p.comp) или полностью компактизованы (comp) (Рис.5). Обычно оценка эмбрионов на четвертые сутки не проводится ввиду малой информативности данной стадии развития. Однако наличие компактизации на вторые сутки может свидетельствовать об аномальном развитии и обязательно должна отражаться в эмбриологическом протоколе.
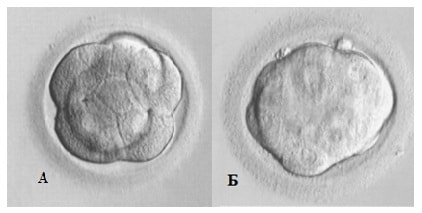
Рис 5. Стадия компактизации 4-е сутки культивирования A – p.comp Б — comp
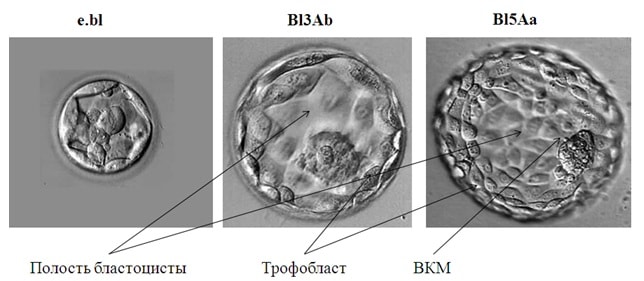
На пятые сутки, примерно через 120 часов после оплодотворения эмбрион образует бластоцисту (Bl) (Рис.6). Оценка качества бластоцист подразумевает ее размер, который отражается цифрами от 1 до 5; состояние внутренней клеточной массы (ВКМ) (от «A» до «С») и окружающих ее клеток – трофобласта (от «а» до «с»). Лучшими для переноса будут бластоцисты размера от 3 до 5, имеющие многоклеточную ВКМ и трофобласт – Bl4Aa, Bl4Ab. Бластоцисты среднего качества обозначаются как – Bl2Bb, Bl3Bb, а плохого – BlCc.
Рис 6. Бластоцисты на пятый день развития in vitro. e.bl – ранняя бластоциста, Bl3Ab – экспандированная бластоциста, Bl5Ab – бластоциста перед хетчингом, ВКМ – внутренняя клеточная масса.
Дальнейшее развитие эмбриона происходит уже в матке после имплантации. Для успешной имплантации бластоцисте необходимо выйти из окружающей ее блестящей оболочки. Данный процесс называется вылупление, или хетчинг. В случае, когда эмбриолог отмечает изменения блестящей оболочки и после криоконсервации эмбрионов процесс самостоятельного вылупления бластоцисты может быть затруднен и его возможно облегчить применяя вспомогательный хетчинг. В нашем центре мы используем наиболее эффективный лазерный вспомогательный хетчинг.
Самая высокая частота оплодотворения получена при переносе эмбрионов на стадии бластоцисты. Так, в нашем центре она составляет 53%. В то время, как при переносе на стадии 6-8 бластомеров – 47%.
Замораживание и ПГД также лучше всего выполнять на стадии бластоцисты. Однако, не все эмбрионы доходят до бластоцисты. Поэтому общепринятым считается следующий подход: если на 5 день культивирования имеется меньше 5 эмбрионов, как минимум один переносят, остальные оставляют до 5 дня. Из достигших бластоцисты еще один может быть перенесен (двойной перенос), остальные замораживают. Если на 3 день эмбрионов 5 и больше, их не переносят и оставляют культивировать до 5 дня. На 5 день одну, реже две бластоцисты переносят, остальные замораживают.
В заключение следует отметить, что описываемые морфологические критерии оценки качества эмбрионов являются основными, необходимыми, но не всегда достаточными для выбора эмбриона для переноса. Так, нередко после переноса эмбрионов высшего качества имплантация не наступает и, наоборот, бывают случаи наступления и успешного развития беременности при переносе эмбрионов плохого качества. Поэтому существуют дополнительные способы прогноза имплантации эмбриона (time-laps, ПГС, анализ метаболитов и др.), которые дополняют морфологические критерии и обеспечивают в совокупности выбор лучшего эмбриона.
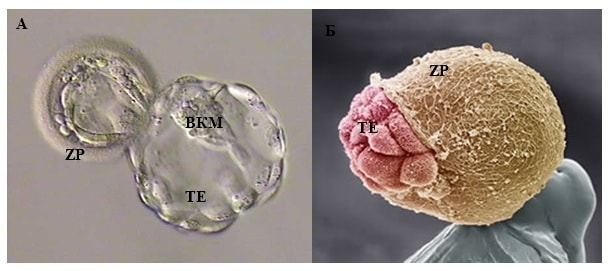
Бластоциста в процессе хетчинга (выхода из блестящей оболочки для имплантации)
А – световая микроскопия HMC контраст Б – Сканирующая электронная микроскопия — ZP – блестящая оболочка TE – трофэктодерма ВКМ – внутренняя клеточная масса
Источник