- Почему атомная масса в таблице Менделеева относительна.
- Относительная атомная и молекулярная массы
- Урок 12. Химия. Вводный курс. 7 класс ФГОС
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Относительная атомная и молекулярная массы»
- Относительная атомная масса элемента
- Относительная атомная масса
- Относительная атомная масса
- История
- ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
Почему атомная масса в таблице Менделеева относительна.
В предыдущей серии мы рассчитали среднюю атомную массу хлора, значение, которое мы можем наблюдать в таблице Менделеева, и обозначили её как Ar ,что означает — Relative atomic mass, то есть, относительная атомная масса.
Почему в химии люди вынуждены оперировать относительными атомными массами и что скрывается за данным понятием? Попробуем разобраться.
Дело в том, что масса атома сама по себе крайне мала, так масса наиболее распространённого изотопа углерода C (12) равна 1,992*10^-23 грамма. То есть, ноль целых, затем идут двадцать три ноля, и лишь после этого получаем значащие после запятой цифры. Оперировать такими маленькими значениями очень неудобно, поэтому химики искали решение данной проблемы, решим её и мы.
Из чего состоит изотоп углерода С (12):
- Из 6 протонов (порядковый номер углерода в таблице Менделеева равен 6)
- 6 электронов ( атом электронейтрален )
- и 6 нейтронов (разница между атомной массой в таблице и порядковым номером).
Среди перечисленных частиц хоть сколько-нибудь значительной массой обладают лишь протоны и нейтроны (массы протона и нейтрона отличаются друг от друга, однако совсем незначительно), чьи массы равны: m (p+) = m (n)
Это значит, что мы можем при небольшом допущении принять так называемую атомную единицу массы (а.е.м.), если поделим массу изотопа углерода C (12) на 12 (сумма числа протонов и нейтронов):
причём данное значение (а.е.м.) будет примерно равно как массе протона, так и массе нейтрона: а.е.м = m (p+) = m (n)
Источник
Относительная атомная и молекулярная массы
Урок 12. Химия. Вводный курс. 7 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Относительная атомная и молекулярная массы»
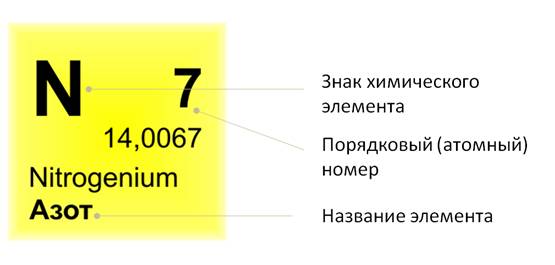
Если посмотреть в периодическую таблицу Д. И. Менделеева, то можно заметить, что все элементы в ней расположены в клетках. В таких клетках изображён знак химического элемента, его название. Вверху клетки указан порядковый, или атомный, номер. Над символом элемента – его название.
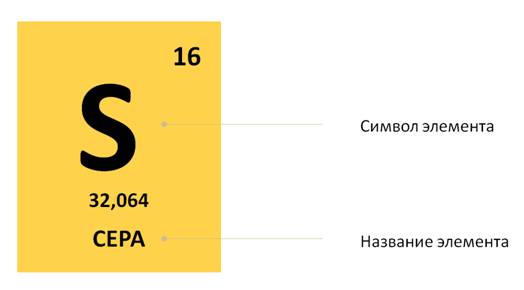
Например, рассмотрим клетку, где расположен элемент сера. Здесь указано название элемента, его символ. Вверху стоит число 16. А что же обозначает нижнее число 32,064?
Это число называется относительной атомной массой. Как известно, важным свойством атомов является их масса, она выражается в граммах, киллограммах, миллиграммах.
Ещё в девятнадцатом веке, когда все учёные наконец-то приняли атомно- молекулярное учение (то есть было доказано, что вещества состоят из молекул и атомов), были рассчитаны атомные массы химических элементов.
Эти массы оказались очень маленькими. Это и понятно, ведь атомы настолько малы, что их не увидишь даже в самые мощные микроскопы.
Для удобства массы атомов химических элементов сравнивают с массой атома самого лёгкого химического элемента – водорода. Масса атома водорода равна 1. Поэтому можно сказать, что масса атома серы в 32 раза больше массы атома водорода.
То есть относительная атомная масса – это величина, которая показывает, во сколько раз масса атома данного химического элемента больше массы атома водорода.
Относительную атомную массу обозначают символом Ar, где буква r – это первая буква английского слова relative, что означает «относительный».
Все значения относительных атомных масс округляют до целого значения по всем правилам округления. Единственным исключением является элемент хлор, у которого относительная атомная масса равна 35,5. Так, относительная атомная масса кислорода – 16, азота – 14, углерода – 12, железа – 56, меди – 64, фтора – 19, алюминия – 27, цинка – 65, фосфора – 31, брома – 80.
Как вы могли заметить, относительная атомная масса является безразмерной величиной.
Как и атомы, молекулы обладают массой. Для того, чтобы найти их массу, нужно сложить массы всех атомов, которые входят в состав молекулы.
То есть относительная молекулярная масса – это сумма относительных атомных масс атомов, входящих в состав молекул.
Например, определим относительную молекулярную массу воды – Н2О. Для этого относительную атомную массу водорода умножаем на 2, так как в молекуле 2 атома водорода, на что нам указывает индекс. Затем складываем относительную атомную массу водорода с относительной атомной массой кислорода. Подставляем значения и получаем результат – 18.
Mr (H2O) = Ar (H) · 2 + Ar (O) = 1 · 2 + 16 = 18
Понятие «относительная молекулярная масса» справедливо только для веществ молекулярного строения, если же вещество состоит из атомов или ионов, тогда вместо относительной молекулярной массы говорят об относительной формульной массе.
Определим относительную молекулярную массу углекислого газа – СО2. Для этого относительную атомную массу углерода складываем с относительной атомной массой кислорода, умноженной на два, так как в молекуле 2 атома кислорода. Подставляем значения относительных атомных масс: 12 складываем с 32 и получаем 44.
Mr (CO2) = Ar (C) + Ar (O) · 2 = 12 + 16 · 2 = 44
Найдём относительную формульную массу NaNO3. Для этого относительную атомную массу натрия складываем с относительной атомной массой азота и относительной атомной массой кислорода, умноженной на три. Подставляем значения относительных атомных масс и получаем 85.
Mr (NaNO3) = Ar (Na) + Ar (N) + Ar (O) · 3 = 23 + 14 + 16 · 3 = 85
Источник
Относительная атомная масса элемента
Абсолютные массы атомов Одним из фундаментальных свойств атомов, является их масса. Абсолютная (истинная) масса атома – величина чрезвычайно малая. Взвесить атомы на весах невозможно, поскольку таких точных весов не существует. Их массы были определены с помощью расчетов.
Например, масса одного атома водорода равна 0,000 000 000 000 000 000 000 001 663 грамма!
Масса атома урана – одного из самых тяжелых атомов, составляет приблизительно 0,000 000 000 000 000 000 000 4 грамма. Записывать и читать эти числа непросто; можно ошибиться, пропустив ноль или добавить лишний. Существует другой способ записи – в виде произведения: 4 ∙ 10−22 (22 – количество нулей в предыдущем числе).
Точное значение массы атома урана – 3,952 ∙ 10−22 г, а атома водорода, самого легкого среди всех атомов, – 1,673 ∙ 10−24 г. Производить расчеты с малыми числами неудобно. Поэтому вместо абсолютных масс атомов используют их относительные массы.
Относительная атомная масса
О массе любого атома можно судить, сравнивая ее с массой другого атома (находить отношение их масс). С момента определения относительных атомных масс элементов использовались различные атомы в качестве сравнения. Своеобразными эталонами для сравнения в свое время были атомы водорода и кислорода.
Единая шкала относительных атомных масс и новая единица атомной массы, принята Международным съездом физиков (1960) и унифицирована Международным съездом химиков (1961). По сегодняшний день эталоном для сравнения является 1/12 часть массы атома углерода. Данное значение называют атомной единицей массы, сокращенно а.е.м
Атомная единица массы (а.е.м.) – масса 1/12 части атома углерода
Сравним, во сколько раз отличается абсолютная масса атома водорода и урана от 1 а.е.м., для этого разделим эти числа одно на другое:
Полученные при расчетах значения и являются относительными атомными массами элементов – относительно 1/12 массы атома углерода.
Так, относительная атомная масса водорода приблизительно равна 1, а урана – 238. Обратите внимание, что относительная атомная масса не имеет единиц измерения, так как при делении единицы измерения абсолютных масс (граммы) сокращаются. Относительные атомные массы всех элементов указаны в Периодической Системе химических элементов Д.И. Менделеева. Символ, при помощи которого обозначают относительную атомную массу – Аr (буква r – сокращение от слова relative, что означает относительный).
Значения относительных атомных масс элементов используются во многих расчетах. Как правило, значения, приведенные в Периодической Системе, округляются до целых чисел. Обратите внимание, что элементы в Периодической Системе размещены в порядке увеличения относительных атомных масс. Например, при помощи Периодической Системы определим относительные атомные массы ряда элементов:
Ar(Na) = 23;
Относительную атомную массу хлора принято записывать равной 35,5!
- Относительные атомные массы пропорциональны абсолютным массам атомов
- Эталоном для определения относительной атомной массы является 1/12 часть массы атома углерода
- 1 а.е.м. = 1,662 ∙ 10−24 г
- Относительную атомную массу обозначают Ar
- Для расчетов значения относительных атомных масс округляют до целых, исключение – хлор, для которого Ar = 35,5
- Относительная атомная масса не имеет единиц измерения
Источник
Относительная атомная масса
А́томная ма́сса, относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода 12 C, поэтому атомная масса этого изотопа по определению равна точно 12. только для свинца изотопа атомная масса не является целым числом, хотя и близка к массовому числу данного изотопа (т. е. суммарному количеству нуклонов — протонов и нейтронов — в его ядре). Разность между атомной массой изотопа и его массовым числом называется избытком массы (обычно его выражают в МэВ). Он может быть как положительным, так и отрицательным; причина его возникновения — нелинейная зависимость энергии связи ядер от числа протонов и нейтронов, а также различие в массах протона и нейтрона.
Зависимость атомной массы от массового числа такова: избыток массы положителен у водорода-1, с ростом массового числа он уменьшается и становится отрицательным, пока не достигается минимум у железа-56, потом начинает расти и возрастает до положительных значений у тяжёлых нуклидов. Это соответствует тому, что деление ядер, более тяжёлых, чем железо, высвобождает энергию, тогда как деление лёгких ядер требует энергии. Напротив, слияние ядер легче железа высвобождает энергию, слияние же элементов тяжелее железа требует дополнительной энергии.
Атомная масса химического элемента (также «средняя атомная масса», «стандартная атомная масса») является средневзвешенной атомной массой всех стабильных изотопов данного химического элемента с учётом их природной распространённости в земной коре и атмосфере. Именно эта атомная масса представлена в периодической таблице, её используют в стехиометрических расчётах. Атомная масса элемента с нарушенным изотопным соотношением (например, обогащённого каким-либо изотопом) отличается от стандартной.
Молекулярной массой химического соединения называется сумма атомных масс элементов, составляющих её, умноженных на стехиометрические коэффициенты элементов по химической формуле соединения. Строго говоря, масса молекулы меньше массы составляющих её атомов на величину, равную энергии связи молекулы. Однако этот дефект массы на 9-10 порядков меньше массы молекулы, и им можно пренебречь.
Определение моля (и числа Авогадро) выбирается таким образом, чтобы масса одного моля вещества (молярная масса), выраженная в граммах, была численно равна атомной (или молекулярной) массе этого вещества. Например, атомная масса железа равна 55,847. Поэтому один моль атомов железа (т. е. их количество, равное числу Авогадро, 6,022·10 23 ) содержит 55,847 граммов.
Прямое сравнение и измерение масс атомов и молекул выполняется с помощью масс-спектрометрических методов.
История
До 1960-х годов атомную массу определяли таким образом, чтобы изотоп кислород-16 имел атомную массу 16 (кислородная шкала). Однако соотношение кислорода-17 и кислорода-18 в природном кислороде, который также использовался в расчётах атомной массы, приводило к наличию двух разных таблиц атомных масс. Химики использовали шкалу, основанную на том, что естественная смесь изотопов кислорода должна была иметь атомную массу 16, тогда как физики присваивали то же число 16 атомной массе наиболее распространённого изотопа кислорода (имеющего восемь протонов и восемь нейтронов).
Источник
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА. Английский ученый Джон Дальтон (1766–1844) на своих лекциях демонстрировал студентам выточенные из дерева модели атомов, показывая, как они могут соединяться, образуя различные вещества. Когда одного из студентов спросили, что такое атомы, он ответил: «Атомы – это раскрашенные в разные цвета деревянные кубики, которые изобрел мистер Дальтон».
Конечно, Дальтон прославился не своими «кубиками» и даже не тем, что в двенадцатилетнем возрасте стал школьным учителем. С именем Дальтона связано возникновение современной атомистической теории. Впервые в истории науки он задумался о возможности измерения масс атомов и предложил для этого конкретные способы. Понятно, что непосредственно взвесить атомы невозможно. Дальтон рассуждал только о «соотношении весов мельчайших частиц газообразных и других тел», то есть об относительных их массах. И поныне, хотя масса любого атома в точности известна, ее никогда не выражают в граммах, так как это исключительно неудобно. Например, масса атома урана – самого тяжелого из существующих на Земле элементов – составляет всего 3,952·10 –22 г. Поэтому массу атомов выражают в относительных единицах, показывающих, во сколько раз масса атомов данного элемента больше массы атомов другого элемента, принятого в качестве стандарта. Фактически это и есть «соотношение весов» по Дальтону, т.е. относительная атомная масса.
В качестве единицы массы Дальтон принял массу атома водорода, а для нахождения масс других атомов он использовал найденные разными исследователями процентные составы различных соединений водорода с другими элементами. Так, по данным Лавуазье, в воде содержится 15% водорода и 85% кислорода. Отсюда Дальтон нашел относительную атомную массу кислорода – 5,67 (в предположении, что в воде на один атом водорода приходится один атом кислорода). По данным английского химика Уильяма Остина (1754–1793) о составе аммиака (80% азота и 20% водорода) Дальтон определил относительную атомную массу азота, равную 4 (также в предположении о равном числе атомов водорода и азота в этом соединении). А из данных по анализу некоторых углеводородов Дальтон приписал углероду значение 4,4. В 1803 Дальтон составил первую в мире таблицу относительных атомных масс некоторых элементов. В дальнейшем эта таблица претерпела очень сильные изменения; основные из них произошли еще при жизни Дальтона, что видно из следующей таблицы, в которой приведены данные из учебников, изданных в разные годы, а также в официальном издании ИЮПАК – Международного союза теоретической и прикладной химии (International Union of Pure and Applied Chemistry).
| Таблица 1. | |||||
| Элемент | Н | Не | С | N | О |
| Дальтон, 1803 | 1 | – | 4,5 | 4 | 5,66 |
| Бецелиус, 1826 | 1 | – | 12,26 | 14,18 | 16,02 |
| Жерар, 1842 | 1 | – | 12 | 14 | 16 |
| Менделеев, 1906 | 1,008 | 4,0 | 12,0 | 14,04 | 16,000 |
| Бьеррум, 1933 | 1,007 | 4,002 | 12,0 | 14,008 | 16,0000 |
| Сиборг, 1945 | 1,008 | 4,003 | 12,010 | 14,008 | 16,000 |
| ИЮПАК, 1993 | 1,00794 | 4,002602 | 12,011 | 14,00674 | 15,9994 |
Прежде всего, обращают на себя внимание непривычные атомные массы у Дальтона: они в несколько раз отличаются от современных! Это объясняется двумя причинами. Первая – неточность эксперимента в конце 18 – начале 19 в. Когда Гей-Люссак и Гумбольдт уточнили состав воды (12,6% Н и 87,4% О), Дальтон изменил значение атомной массы кислорода, приняв ее равной 7 (по современным данным в воде 11,1% водорода). По мере совершенствования методов измерения уточнялись атомные массы и многих других элементов. При этом за единицу измерения атомных масс сначала выбирали водород, потом – кислород, а в настоящее время – углерод.
Вторая причина более серьезная. Дальтон не знал, в каком соотношении находятся атомы разных элементов в различных соединениях, поэтому он принял наиболее простую гипотезу о соотношении 1:1. Так считали многие химики, пока не были надежно установлены и приняты химиками правильные формулы для состава воды (Н2О) и аммиака (NH3), многих других соединений. Для установления формул газообразных веществ использовался закон Авогадро, позволяющий определять относительную молекулярную массу веществ. Для жидких и твердых веществ использовали другие способы (см. МОЛЕКУЛЯРНОЙ МАССЫ ОПРЕДЕЛЕНИЕ). Особенно просто было устанавливать формулы соединений элементов переменной валентности, например, хлорида железа. Относительная атомная масса хлора уже была известна из анализа ряда его газообразных соединений. Теперь, если принять, что в хлориде железа число атомов металла и хлора одинаково, то для одного хлорида относительная атомная масса железа получалась равной 27,92, а для другого – 18,62. Отсюда следовало, что формулы хлоридов FeCl2 и FeCl3, и Ar(Fe) = 55,85 (среднее из двух анализов). Вторая возможность – формулы FeCl4 и FeCl6, и Ar(Fe) = 111,7 – была исключена как маловероятная. Относительные атомные массы твердых веществ помогало находить эмпирическое правило, сформулированное в 1819 французскими учеными П.И.Дюлонгом и А.Т.Пти: произведение атомной массы на теплоемкость – величина постоянная. Особенно хорошо правило Дюлонга – Пти выполнялось для металлов, что позволило, например, Берцелиусу уточнить и исправить атомные массы некоторых из них.
При рассмотрении относительных атомных масс химических элементов, приводящихся в периодической таблице, можно заметить, что для разных элементов они даются с разной точностью. Например, для лития – с 4 значащими цифрами, для серы и углерода – с 5, для водорода – с 6, для гелия и азота – с 7, для фтора – с 8. Отчего такая несправедливость?
Оказывается, точность, с которой определяется относительная атомная масса данного элемента, зависит не столько от точности измерений, сколько от «природных» факторов, не зависящих от человека. Они связаны с непостоянством изотопного состава данного элемента: в разных образцах соотношение изотопов не вполне одинаковое. Например, при испарении воды молекулы с легкими изотопами (см. ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ) водорода переходят в газовую фазу чуть быстрее, чем молекулы тяжелой воды, содержащие изотопы 2 Н. В результате в водяных парах изотопа 2 Н немного меньше, чем в жидкой воде. Многие организмы также разделяют изотопы легких элементов (для них разница в массах более существенна, чем для тяжелых элементов). Так, при фотосинтезе растения отдают предпочтение легкому изотопу 12 С. Поэтому в живых организмах, а также произошедших от них нефти и угле содержание тяжелого изотопа 13 С понижено, а в углекислом газе и образовавшемся из него карбонатах, наоборот, – повышено. Микроорганизмы, восстанавливающие сульфаты, также накапливают легкий изотоп 32 S, поэтому в осадочных сульфатах его больше. В «остатках» же, не усвоенных бактериями, доля тяжелого изотопа 34 S больше. (Кстати, анализируя соотношение изотопов серы, геологи могут отличить осадочный источник серы от магматического. А по соотношению изотопов 12 С и 13 С можно даже отличить тростниковый сахар от свекловичного!)
Итак, для многих элементов приводить очень точные значения атомных масс просто не имеет смысла, поскольку они немного меняются от одного образца к другому. По точности, с какой приводятся атомные массы, можно сразу сказать, происходит ли в природе «разделение изотопов» данного элемента и насколько сильно. А вот, например, для фтора атомная масса приводится с очень высокой точностью; значит, атомная масса фтора в любом его земном источнике постоянна. И это неудивительно: фтор относится к так называемым элементам-одиночкам, которые в природе представлены одним-единственным нуклидом.
В периодической таблице массы некоторых элементов стоят в скобках. Это относится главным образом к актинидам, стоящим после урана (так называемые трансурановые элементы), к еще более тяжелым элементам 7-го периода, а также к нескольким более легким; среди них технеций, прометий, полоний, астат, радон, франций. Если сравнить таблицы элементов, напечатанные в разные годы, то окажется, что эти числа время от времени меняются, иногда в течение всего нескольких лет. Некоторые примеры приведены в таблице.
Причина изменений в таблицах заключается в том, что указанные элементы радиоактивны, у них нет ни одного стабильного изотопа. В таких случаях принято приводить либо относительную атомную массу наиболее долгоживущего нуклида (например, для радия), либо массовые числа; последние приводятся в скобках. Когда открывают новый радиоактивный элемент, то получают вначале лишь один из многих его изотопов – конкретный нуклид с определенным числом нейтронов. Исходя из теоретических представлений, а также экспериментальных возможностей, стараются получить нуклид нового элемента с достаточным временем жизни (с таким нуклидом легче работать), однако удавалось это «с первого захода» не всегда. Как правило, при дальнейших исследованиях выяснялось, что существуют и могут быть синтезированы новые нуклиды с бoльшим временем жизни, и тогда проставленное в Периодической таблице элементов Д.И.Менделеева число надо было заменять. Сопоставим массовые числа некоторых трансуранов, а также прометия, взятые из книг, изданных в разные годы. В скобках в таблице приведены современные данные для периодов полураспада. В старых изданиях вместо принятых в настоящее время символов элементов 104 и 105 (Rf – резерфордий и Db – дубний) фигурировали Ku – курчатовий и Ns – нильсборий.
| Таблица 2. | ||||
| Элемент Z | Год издания | |||
| 1951 | 1958 | 1983 | 2000 | |
| Pm 61 | 147 (2,62 года) | 145 (18 лет) | 145 | 145 |
| Pu 94 | 239 (24100 лет) | 242 (3,76 . 10 5 лет) | 244 (8,2 . 10 7 лет) | 244 |
| Am 95 | 241 (432 года) | 243 (7370 лет) | 243 | 243 |
| Cm 96 | 242 (163 сут) | 245 (8500 лет) | 247 (1,58 . 10 7 лет) | 247 |
| Bk 97 | 243 (4,5 час) | 249 (330 сут) | 247 (1400 лет) | 247 |
| Cf 98 | 245 (44 мин) | 251 (900 лет) | 251 | 251 |
| Es 99 | – | 254 (276 сут) | 254 | 252 (472 сут) |
| Fm 100 | – | 253 (3 сут) | 257 (100,5 сут) | 257 |
| Md 101 | – | 256 (76 мин) | 258 (52 сут) | 258 |
| No 102 | – | – | 255 (3,1 мин) | 259 (58 мин) |
| Lr 103 | – | – | 256 (26 сек) | 262 (3,6 час) |
| Rf 104 | – | – | 261 (78 сек) | 261 |
| Db 105 | – | – | 261 (1,8 сек) | 262 (34 сек) |
Как видно из таблицы, все приведенные в ней элементы радиоактивные, их периоды полураспада намного меньше возраста Земли (несколько млрд. лет), поэтому в природе этих элементов нет и получены они искусственно. По мере совершенствования техники эксперимента (синтез новых изотопов и измерение времени их жизни) иногда удавалось найти нуклиды, живущие в тысячи и даже миллионы раз дольше известных до этого. Например, когда в 1944 на циклотроне в Беркли были поставлены первые опыты по синтезу элемента № 96 (впоследствии его назвали кюрием), то единственная имевшаяся тогда возможность получения этого элемента заключалась в облучении a-частицами ядер плутония-239: 239 Pu + 4 He ® 242 Cm + 1 n. Полученный нуклид нового элемента имел период полураспада около полугода; он оказался очень удобным компактным источником энергии, и позднее его использовали с этой целью, например, на американских космических станциях «Сервейор». В настоящее время получен кюрий-247, который имеет период полураспада 16 млн. лет, что в 36 млн. раз превышает время жизни первого известного нуклида этого элемента. Так что изменения, вносимые время от времени в таблицу элементов, могут быть связаны не только с открытием новых химических элементов!
В заключение – о том, как узнали, в каком соотношении присутствуют в элементе разные изотопы? Например, о том, что в природном хлоре на долю 35 Cl приходится 75,77% (остальное – изотоп 37 Cl)? В данном случае, когда в природном элементе всего два изотопа, решить задачу поможет такая аналогия.
В 1982 в результате инфляции стоимость меди, из которых чеканились одноцентовые монеты США, превысила номинал монеты. Поэтому с этого года монеты делают из более дешевого цинка и лишь сверху покрывают тонким слоем меди. При этом содержание дорогой меди в монете снизилось с 95 до 2,5%, а масса – с 3,1 до 2,5 г. Через несколько лет, когда в обращении находилась смесь монет двух типов, преподаватели химии сообразили, что эти монеты (на глаз они почти неразличимы) – прекрасное пособие для их «изотопного анализа», либо по массе, либо по числу монет каждого типа (аналогия массовой или мольной доли изотопов в смеси). Будем рассуждать так: пусть у нас имеется 210 монет, среди которых есть и легкие, и тяжелые (это соотношение не зависит от числа монет, если их достаточно много). Пусть также общая масса всех монет равна 540 г. Если бы все эти монеты были «легкой разновидности», то общая их масса была бы равна 525 г, что на 15 г меньше действительной. Почему так? Потому что не все монеты легкие: есть среди них и тяжелые. Замена одной легкой монеты на тяжелую приводит к увеличению общей массы на 0,6 г. Нам же надо увеличить массу на 40 г. Следовательно, легких монет имеется 15/0,6 = 25. Таким образом, в смеси 25/210 = 0,119 или 11,9% легких монет. (Конечно, со временем «изотопное соотношение» монет разного типа будет меняться: легких будет все больше, тяжелых – все меньше. Для элементов же соотношение изотопов в природе постоянно.)
Точно так же и в случае изотопов хлора или меди: известна средняя атомная масса меди – 63,546 (ее определили химики, анализируя различные соединения меди), а также массы легкого 64 Cu и тяжелого 65 Cu изотопов меди (эти массы определили физики, используя свои, физические, методы). Если элемент содержит более двух стабильных изотопов, их соотношение определяется другими методами.
Наши монетные дворы – Московский и Санкт-Петербургский тоже, оказывается, чеканили разные «изотопные разновидности» монет. Причина та же – подорожание металла. Так, 10- и 20-рублевые монеты в 1992 чеканились из немагнитного медно-никелевого сплава, а в 1993 – из более дешевой стали, и эти монеты притягиваются магнитом; по внешнему виду они практически не различаются (кстати, часть монет этих годов отчеканены «не в том» сплаве, такие монеты очень редкие, а некоторые стоят дороже золота!). В 1993 чеканились также 50-рублевые монеты из медного сплава, и в том же году (гиперинфляция!) – из стали, покрытой латунью. Правда, массы наших «изотопных разновидностей» монет отличаются не так сильно, как у американских. Тем не менее, точное взвешивание кучи монет дает возможность рассчитать, сколько в них монет каждого сорта – по массе, либо по числу монет, если подсчитано общее их число.
Источник