Гипертрофия миокарда сердца — особенности заболевания
Гипертрофия миокарда сердца — это увеличение, разрастание мышечной массы стенки сердца. Такие изменения приводят к изменению размеров, формы органа, утолщению межжелудочковой перегородки.
Симптомы
Как правило, данная патология обнаруживается случайно, в процессе проведения ЭКГ или Эхо-КГ. Специалисты выделяют такие основные признаки гипертрофии миокарда:
- стенокардию;
- мерцательную аритмию;
- повышенное артериальное давление;
- общую слабость, плохое самочувствие.
Развитие стенокардии происходит в результате сжатия сосудов, обеспечивающих необходимым питанием сердечную мышцу. В конечном итоге происходит увеличение мышцы в размерах. Она начинает потреблять больше кислорода в комплексе с питательными веществами. У пациентов, страдающих от гипертрофии миокарда сердца, также может возникать состояние, в процессе которого замирает сердце на несколько мгновений (не бьется вообще). В этом случае человек теряет сознание.
Диагностика
Как правило, заболевание выявляется при ультразвуковом исследовании. МРТ сердца считается наиболее простым, информативным методом. В определенных случаях заболевание диагностируют при помощи ЭКГ. К дополнительным исследованиям относят: вентрикулографию, коронарографию, а также радиоизотопное исследование.
Профилактика
К числу эффективных профилактических действий по предотвращению развития заболевания относят:
- изменение образа жизни: отказ от курения, употребления алкогольных напитков;
- борьбу с факторами риска: нормализацию массы тела, артериального давления;
- контроль препаратами иперлипидемии и гипертонии (если при коррекции образа жизни отсутствует результат).
В случае контроля препаратами удается поддерживать нормальный уровень сахара, а также контролировать остальные факторы риска, возникающие при сахарном диабете. Соблюдение таких профилактических мер позволяет избегать развития гипертрофии миокарда сердца.
Лечение гипертрофии миокарда
Для проведения квалифицированного лечения необходимо продиагностировать заболевание, а также определить его характер, особенности течения. На основе этих данных подбирается оптимальный способ лечения. В большинстве случаев лечение гипертрофии миокарда состоит в приеме препарата верампила с бета-блокаторами. Комплексное применение лекарств позволяет снизить симптоматику заболевания, а также нормализовать общее состояние больного. В роли дополнительной терапии необходимо соблюдать назначенную диету, а также отказаться от курения, приема алкоголя. Кроме того, необходимо сокращение количества соли, потребляемых продуктов с максимально высоким содержанием жиров. При лечении физические нагрузки должны быть умеренными.
В особо тяжелых случаях требуется хирургическое вмешательство. В этом случае специалист удаляет гипертрофированную часть мышцы. В процессе лечения состояние пациента отслеживается при помощи ЭКГ.
Реабилитация
Как известно, после проведенного лечения, операционного вмешательства требуется полноценная реабилитация. Лечебная диета является неотъемлемой составляющей реабилитационного процесса. В таком случае питаться необходимо до 6 раз в день небольшими порциями. Мучные изделия при этом нужно ограничить, жирные, копченые блюда также исключаются из рациона. Уровень физических нагрузок необходимо снизить. Полноценная реабилитация позволяет пациенту намного оперативнее восстановиться после проведенного лечения.
Записаться на приём
Запишитесь на приём и получите профессиональное обследование в нашем центре
Источник
Мжп утолщена что это значит
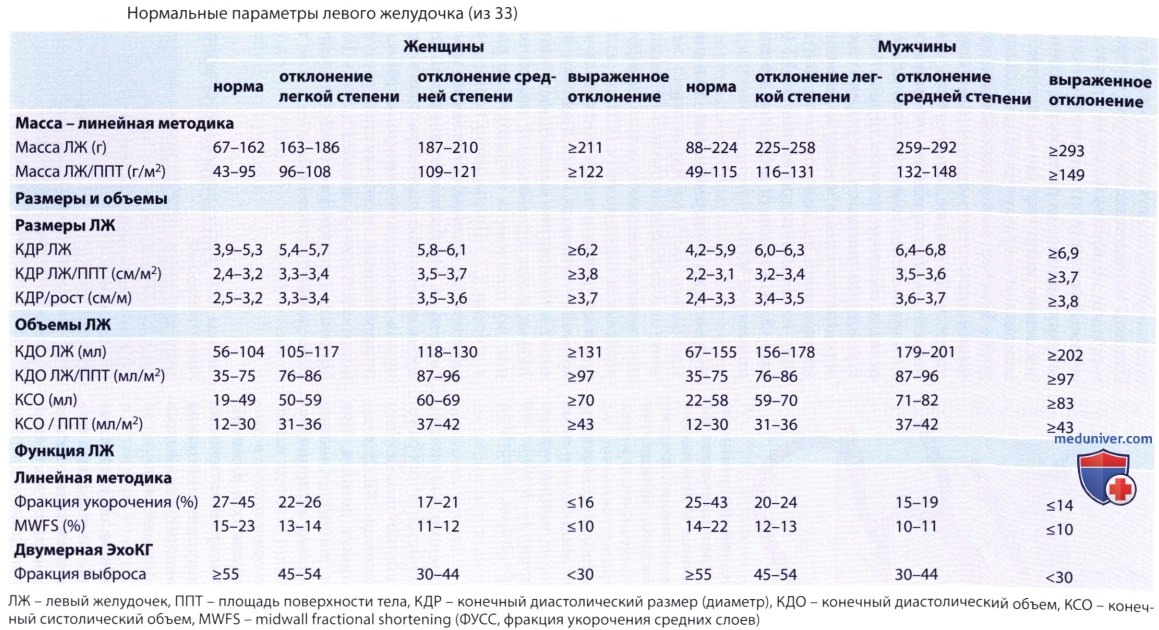
а) Сечения и точки измерений. Основой для оценки массы миокарда являются измерения конечной диастолической толщины перегородки и задней стенки, а также диастолического размера левого желудочка в парастернальном сечении по длинной или короткой оси (двумерная ЭхоКГ или ЭхоКГ в М-режиме).
При этом следует помнить, что измерение толщины межжелудочковой перегородки производится не в месте наибольшей толщины, которое может быть смещено в сторону основания или верхушки желудочка, а на уровне прикрепления сухожильных хорд к створкам митрального клапана, в поперечном к длинной оси направлении. Толщина стенок левого желудочка уменьшается по направлению от основания к верхушке.
б) Типы гипертрофии:
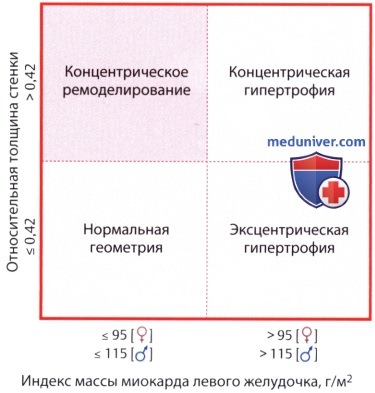
1. Определение. Толщина межжелудочковой перегородки более 12 мм является указанием на гипертрофию, хотя при строгом подходе этот термин можно употреблять только в том случае, если увеличена общая масса левого желудочка. Если отмечается утолщение и задней стенки левого желудочка, говорят о концентрической гипертрофии. Если соотношение толщины перегородки к толщине задней стенки превышает 1/1,3, говорят об асимметричной гипертрофии межжелудочковой перегородки.
Она встречается как при гипертрофической кардиомиопатии, так и на фоне длительной артериальной гипертензии и других заболеваний; с другой стороны, ее может и не быть у пациента с ГКМП. Кроме того, выделяют концентрическую и эксцентрическую гипертрофию левого желудочка в зависимости от того, имеет ли диаметр полости левого желудочка нормальный или уменьшенный размер (концентрическая гипертрофия типична для артериальной гипертензии или аортального стеноза) либо увеличен (типично для аортальной или митральной недостаточности).
В числовом виде это можно выразить показателем относительной толщины стенки (ОТС):
ОТС = 2 ТЗСЛЖ / КДР ЛЖ,
где ТЗСЛЖ — диастолическая толщина задней стенки левого желудочка, а КДР ЛЖ -конечный диастолический размер (диаметр) полости ЛЖ. Тогда эксцентрическая гипертрофия определяется как увеличение массы миокарда желудочка при значении ОТС А у молодых пациентов), а тканевые скорости и параметры деформации характеризуются высоконормальными значениями.
4. Левый желудочек при ожирении. Повышение индекса массы тела ведет к утолщению стенки и дискретному увеличению диаметра левого желудочка, т.е. к увеличению массы миокарда левого желудочка в форме эксцентрической гипертрофии. Статистически значимая связь ожирения с симптоматической сердечной недостаточностью известна и, возможно, реализуется через механизмы гипертрофии. В недавнем исследовании пациентов с излишней массой тела без сахарного диабета и без КБС была выявлена значительно более высокая масса миокарда левого желудочка (как в абсолютном выражении, так и нормализованная к росту пациента или к росту в степени 2,7), а также увеличение толщины стенки желудочка, увеличение размеров предсердий, снижение раннедиастолических скоростей при тканевой допплерографии, повышение интегрального рассеивания и, прежде всего, функциональные изменения, несмотря на нормальный уровень фракции выброса и незначительно измененное отношение Е/А; изменения коррелируют с выраженностью ожирения.
в) Расчет массы миокарда:
1. Геометрические допущения. Традиционно масса левого желудочка рассчитывается на основании линейных размеров (толщина перегородки и задней стенки, а также конечный диастолический размер левого желудочка) с определенными геометрическими допущениями (желудочек как эллипсоид вращения). При этом рассчитанный объем миокарда (в см 3 ) переводится в массу миокарда умножением на принятую плотность миокарда 1,04 г/см 3 . Предложенная формула валидирована результатами секционных исследований, но может претендовать на точность только при нормальной форме левого желудочка:
где КДР ЛЖ — конечный диастолический размер (диаметр) левого желудочка, ТЗСЛЖ -толщина задней стенки, а ТМЖП — толщина межжелудочковой перегородки в миллиметрах.
2. Сечения и режимы изображения. Поскольку глубина сканирования из парастернальной позиции по длинной оси обычно оказывается достаточной, то в большинстве случаев следует предпочесть измерения в двумерном режиме, чтобы избежать «тангенциальных» измерений диаметра полости и толщины стенок. Размеры следует определять от одной границы кровь/ткань до другой. Распространенный сегодня, предпочтительный для распознавания эндокарда режим второй гармоники приводит к большей зернистости изображения и, тем самым, к несколько завышенным результатам измерений толщины и несколько меньшим — для диаметра полости. При этом опубликованные данные основаны исключительно на прежних, негармонических («фундаментальных») режимах исследования (в том числе и приведенные в данной книге таблицы); однако эти различия, по-видимому, незначимы при практическом использовании, поскольку они значительно меньше, чем вариабельность оценки одного пациента разными исследователями.
3. Другие методики расчета. Альтернативным — и очень сложным, но зато более точным — методом вычисления массы миокарда является расчет на основании измерений поперечных сечений желудочка при регистрации ЭхоКГ в двумерном режиме. Основой метода является форма миокарда в сечении по короткой оси на уровне сосочковых мышц (всегда за вычетом самих сосочковых мышц) и определение длинной оси левого желудочка. Но на практике эта методика не используется из-за своей сложности. Наконец, можно использовать метод дисков аналогично методу, применяемому для расчета объемов, если вычесть объем полости из общего объема, ограниченного эпикардом. Эта методика тоже применяется редко, особенно по причине трудности контурирования эпикарда. Существует и способ определения массы миокарда, полностью не зависящий от геометрических допущений — он основан на трехмерной ЭхоКГ. По точности последняя методика равноценна МРТ.
4. Индексация и нормальные значения. При оценке массы миокарда левого желудочка целесообразно проводить индексацию по площади поверхности тела или росту пациента, а также по полу. (Однако индексация по площади поверхности тела, при которой учитывается и вес пациента, приводит к недооценке выраженности гипертрофии у лиц с повышенной массой тела; поэтому предложена индексация по росту в степени 2,7.) Превышение нормального значения, как правило, обозначается как гипертрофия. Опубликованные за последнее время нормальные параметры отличаются, иногда довольно значительно, от ранее использовавшихся, поскольку стали доступны более качественные данные. Причины гипертрофии левого желудочка приведены в таблице ниже.

Редактор: Искандер Милевски. Дата публикации: 26.12.2019
Источник
Современные подходы к лечению больных гипертрофической кардиомиопатией
Полувековая история изучения проблемы гипертрофической кардиомиопатии (ГКМП) отражает значительную эволюцию знаний в области этиологии, патогенеза, диагностики, клинического течения, прогноза и вариантов лечения этого заболевания. За указанный период тол
Полувековая история изучения проблемы гипертрофической кардиомиопатии (ГКМП) отражает значительную эволюцию знаний в области этиологии, патогенеза, диагностики, клинического течения, прогноза и вариантов лечения этого заболевания. За указанный период только в англоязычных изданиях опубликованы более 1000 крупных научных работ. ГКМП — одна из основных и, вероятно, наиболее распространенных форм кардиомиопатий, заболеваний миокарда, сопровождающихся его дисфункцией (Report of the 1995 WHO/ISFC Task Force on the Definition and Classification of Cardiomyopathy) [1].
В 2003 г. создан Международный комитет (ACC/ESC), объединивший американских и европейских экспертов по ГКМП, и опубликовано сообщение, суммировавшее основные положения, включая стратегию лечебных мероприятий [2].
Определение заболевания носит описательный характер. Так, по современным представлениям, ГКМП является преимущественно генетически обусловленным заболеванием мышцы сердца, характеризующимся комплексом специфических морфофункциональных изменений и неуклонно прогрессирующим течением с высокой угрозой развития тяжелых, жизнеугрожающих аритмий и внезапной смерти (ВС). ГКМП характеризуется массивной гипертрофией миокарда левого и/или реже правого желудочка, чаще асимметричного характера за счет утолщения межжелудочковой перегородки (МЖП), нередко с развитием обструкции (систолического градиента давления) выходного тракта ЛЖ при отсутствии видимых причин (артериальная гипертония, пороки и специфические заболевания сердца). Основным методом диагностики остается эхокардиографическое исследование. В зависимости от наличия или отсутствия градиента систолического давления в полости ЛЖ, ГКМП разделяют на обструктивную и необструктивную, что имеет важное практическое значение при выборе тактики лечения. При этом различают 3 гемодинамических варианта обструктивной ГКМП: с субаортальной обструкцией в покое (так называемой базальной обструкцией); с лабильной обструкцией, характеризующейся значительными спонтанными колебаниями внутрижелудочкового градиента давления без видимой причины; с латентной обструкцией, которая вызывается только при нагрузке и провокационных фармакологических пробах (в частности, вдыханием амилнитрита, при приеме нитратов или внутривенном введении изопротеренола).
Типичными являются морфологические изменения: аномалия архитектоники сократительных элементов миокарда (гипертрофия и дезориентация мышечных волокон), развитие фибротических изменений мышцы сердца, патология мелких интрамиокардиальных сосудов [3, 4].
Cимптомы болезни разнообразны и малоспецифичны, связаны с гемодинамическими нарушениями (диастолическая дисфункция, динамическая обструкция путей оттока, митральная регургитация), ишемией миокарда, патологией вегетативной регуляции кровообращения и нарушением электрофизиологических процессов в сердце [5, 6, 7]. Диапазон клинических проявлений крайне велик: от бессимптомных до неуклонно прогрессирующих и трудно поддающихся медикаментозному лечению форм, сопровождающихся тяжелой симптоматикой. При этом первым и единственным проявлением заболевания может стать внезапная смерть.
В настоящее время наблюдается повсеместный рост числа зарегистрированных случаев этой патологии как за счет внедрения в практику современных методов диагностики, так и, вероятно, в связи с истинным увеличением числа больных ГКМП [8, 9]. Согласно данным последних исследований, распространенность заболевания в общей популяции является более высокой, чем считалось ранее, и составляет 0,2% [10, 11]. ГКМП может диагностироваться в любом возрасте, от первых дней до последней декады жизни, однако преимущественно заболевание выявляется у лиц молодого трудоспособного возраста [12, 13]. Ежегодная смертность больных ГКМП колеблется в пределах от 1 до 6%: у взрослых больных составляет 1–3% [14, 15], а в детском и подростковом возрасте у лиц с высоким риском ВС — 4–6% [16, 17].
Общепризнанна концепция о преимущественно наследственной природе ГКМП [18, 19]. В литературе широкое распространение получил термин «семейная гипертрофическая кардиомиопатия». К настоящему времени установлено, что более половины всех случаев заболевания являются наследуемыми [20, 21], при этом основной тип наследования — аутосомно-доминантный. Оставшиеся приходятся на так называемую спорадическую форму; в этом случае у пациента нет родственников, болеющих ГКМП или имеющих гипертрофию миокарда. Считается, что большинство, если не все случаи спорадической ГКМП, также имеют генетическую причину, т. е. вызваны случайными мутациями.
ГКМП — это генетически гетерогенное заболевание, причиной которого являются более 200 описанных мутаций нескольких генов, кодирующих белки миофибриллярного аппарата [2, 22]. К настоящему времени известны 10 белковых компонентов сердечного саркомера, выполняющих контрактильную, структурную или регуляторную функции, дефекты которых наблюдаются при ГКМП. Причем в каждом гене множество мутаций могут становиться причиной заболевания (полигенное мультиаллельное заболевание).
Наличие той или иной ассоциированной с ГКМП мутации признается «золотым» стандартом диагностики заболевания. При этом описанные генетические дефекты характеризуются разной степенью пенетрантности, выраженностью морфологических и клинических проявлений. Тяжесть клинической картины зависит от присутствия и степени гипертрофии. Мутации, которые ассоциируются с высокой пенетрантностью и плохим прогнозом, выражаются большей гипертрофией левого желудочка и толщиной МЖП, чем те, которые характеризуются низкой пенетрантностью и имеют хороший прогноз. Так, было показано, что лишь отдельные мутации ассоциированы с плохим прогнозом и высокой частотой ВС. К ним относятся замены Arg 403 Gln, Arg 453 Cys, Arg 719 Trp, Arg 719 Gln, Arg 249 Gln в гене тяжелой цепи β-миозина, InsG 791 в гене миозин-связывающего белка С и Asp 175 Asn в гене α-тропомиозина [23, 24, 25, 26]. Для мутаций в гене тропонина Т характерна умеренная гипертрофия миокарда, однако прогноз достаточно неблагоприятен, а вероятность внезапной остановки сердца высока [27]. Другие генетические аномалии, как правило, сопровождаются доброкачественным течением и благоприятным прогнозом или занимают промежуточное положение по тяжести вызываемых ими проявлений.
Таким образом, ГКМП характеризуется крайней гетерогенностью вызывающих ее причин, морфологических, гемодинамических и клинических проявлений, разнообразием вариантов течения и прогноза, что существенно затрудняет выбор адекватных и наиболее эффективных лечебных подходов по контролю и коррекции имеющихся нарушений. При этом отчетливо выделяются 5 основных вариантов течения заболевания и исходов:
- стабильное, доброкачественное течение;
- внезапная смерть;
- прогрессирующее течение — усиление одышки, слабости, утомляемости, болевого синдрома (атипичные боли, стенокардия), появление синкопальных состояний, нарушений систолической дисфункции ЛЖ;
- «конечная стадия» — дальнейшее прогрессирование явлений застойной сердечной недостаточности, связанной с ремоделированием и систолической дисфункцией ЛЖ;
- развитие фибрилляции предсердий и связанных с ней осложнений, в частности тромбоэмболических.
Вариабельность прогноза определяет необходимость детальной стратификации риска фатальных осложнений заболевания, поиск доступных прогностических предикторов и критериев оценки проводимого лечения.
По современным представлениям, лечебная стратегия определяется в процессе разделения больных на категории в зависимости от описанных выше вариантов течения и прогноза (рис.).
Все лица с ГКМП, включая носителей патологических мутаций без фенотипических проявлений болезни и пациентов с бессимптомным течением заболевания, нуждаются в динамическом наблюдении, в ходе которого оцениваются характер и выраженность морфологических и гемодинамических нарушений. Особое значение имеет выявление факторов, определяющих неблагоприятный прогноз и повышенный риск ВС (в частности, скрытых прогностически значимых аритмий).
К общим мероприятиям относятся ограничение значительных физических нагрузок и запрещение занятий спортом, способных вызывать усугубление гипертрофии миокарда, повышение внутрижелудочкового градиента давления и риска ВС. Для предупреждения инфекционного эндокардита в ситуациях, связанных с развитием бактериемии, при обструктивных формах ГКМП рекомендуется антибиотикопрофилактика, аналогичная таковой у больных с пороками сердца.
До настоящего времени окончательно не решен вопрос о необходимости проведения активной медикаментозной терапии у наиболее многочисленной группы больных с бессимптомной или малосимптомной формами ГКМП и низкой вероятностью ВС. Противники активной тактики обращают внимание на то, что при благоприятном течении заболевания продолжительность жизни и показатели смертности не отличаются от таковых в общей популяции [28, 29]. Некоторые же авторы указывают на то, что использование в этой группе пациентов β-адреноблокаторов и антагонистов кальция (верапамил) может приводить к сдерживанию гемодинамических нарушений и клинической симптоматики [30, 31]. При этом никто не оспаривает тот факт, что выжидательная тактика в случаях бессимптомного или малосимптомного течения ГКМП возможна лишь при отсутствии признаков внутрижелудочковой обструкции, обмороков и серьезных нарушений сердечного ритма, отягощенной наследственности и случаев ВС у близких родственников.
Следует признать, что лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, пока может быть в большей степени симптоматическим и паллиативным. Тем не менее к основным задачам лечебных мероприятий относятся не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания.
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: β-адреноблокаторы и блокаторы кальциевых каналов (верапамил). Для лечения весьма распространенных при этом заболевании нарушений сердечного ритма используются также дизопирамид и амиодарон.
β-адреноблокаторы стали первой и остаются и по сей день наиболее эффективной группой лекарственных средств, применяемых в лечении ГКМП. Они оказывают хороший симптоматический эффект в отношении основных клинических проявлений: одышки и сердцебиения, болевого синдрома, включая стенокардию, не менее чем у половины больных ГКМП [32, 33, 34], что обусловлено, в основном, способностью этих препаратов уменьшать потребность миокарда в кислороде. Благодаря отрицательному инотропному действию и уменьшению активации симпатоадреналовой системы при физическом и эмоциональном напряжении, β-блокаторы предотвращают возникновение или повышение субаортального градиента давления у больных с латентной и лабильной обструкцией, существенно не влияя на величину этого градиента в покое. Убедительно показана способность β-блокаторов улучшать функциональный статус пациентов в условиях курсового и длительного применения [35]. Хотя препараты не оказывают прямого влияния на диастолическое расслабление миокарда, они могут улучшать наполнение ЛЖ косвенно — за счет уменьшения частоты сердечных сокращений и предупреждения ишемии сердечной мышцы [36]. В литературе имеются данные, подтверждающие способность β-блокаторов сдерживать и даже приводить к обратному развитию гипертрофии миокарда [37, 38]. Однако другие авторы подчеркивают, что вызываемое β-блокаторами симптоматическое улучшение не сопровождается регрессией гипертрофии ЛЖ и улучшением выживаемости больных [39]. Хотя эффект этих препаратов в отношении купирования и предупреждения желудочковых и суправентрикулярных аритмий и внезапной смерти не доказан, ряд специалистов все же считают целесообразным их профилактическое назначение больным ГКМП высокого риска, включая пациентов молодого возраста с отягощенным случаями внезапной смерти семейным анамнезом [40].
Предпочтение отдается β-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают начиная с 20 мг 3-4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой в большинстве случаев 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, так как отсутствие эффекта терапии β-блокаторами, вероятно, связано с недостаточной дозировкой. При этом нельзя забывать о том, что повышение дозировок существенно увеличивает риск известных побочных эффектов.
В настоящее время широко изучается возможность эффективного применения нового поколения кардиоселективных β-блокаторов пролонгированного действия, в частности атенолола, конкора и др. При этом существует мнение о том, что кардиоселективные β-блокаторы у больных ГКМП не имеют преимуществ перед неселективными, так как в больших дозах, к достижению которых следует стремиться, селективность практически утрачивается. Следует отметить, что рекомендуемый к применению у больных ГКМП с тяжелыми суправентрикулярными и желудочковыми аритмиями соталол сочетает в себе свойства неселективных β-блокаторов и антиаритмических средств III класса (кордароноподобный эффект).
Применение блокаторов медленных кальциевых каналов при ГКМП основано на снижении уровня свободного кальция в кардиомиоцитах и нивелировании асинхронии их сокращения, улучшении расслабления миокарда и снижении его сократимости, подавлении процессов гипертрофии миокарда. Среди блокаторов кальциевых каналов препаратом выбора, благодаря наибольшей выраженности отрицательного инотропного действия и наиболее оптимальному профилю фармакологических свойств, является верапамил (изоптин, финоптин). Он обеспечивает симптоматический эффект у 65–80% больных, включая случаи рефрактерности к лечению β-блокаторами, что обусловлено способностью препарата уменьшать ишемию миокарда, в том числе безболевую, и улучшать его диастолическое расслабление и податливость ЛЖ [41, 42, 43]. Это свойство верапамила обеспечивает повышение толерантности больных к физической нагрузке и снижение субаортального градиента давления в покое при меньшей по сравнению с β-блокаторами способности к уменьшению внутрижелудочковой обструкции в случаях физического и эмоционального напряжения и провокации изопротеренолом. Одновременно верапамил снижает периферическое сосудистое сопротивление вследствие вазодилататорного действия [44]. И хотя этот эффект чаще всего нивелируется непосредственным положительным влиянием на диастолическую функцию ЛЖ, у отдельных больных с базальной внутрижелудочковой обструкцией в сочетании с повышенным конечно-диастолическим давлением ЛЖ и склонностью к системной артериальной гипотензии при уменьшении постнагрузки внутрижелудочковый градиент давления может резко возрастать. Это способно приводить к развитию отека легких, кардиогенного шока и даже внезапной смерти [45]. Подобные грозные осложнения фармакотерапии верапамилом описаны также у больных необструктивной ГКМП с высоким давлением в левом предсердии, у которых они обусловлены отрицательным инотропным действием препарата. Очевидно, как важно соблюдать осторожность при начале лечения верапамилом этой категории больных. Прием препарата следует начинать в условиях стационара с малых доз — 20–40 мг 3 раза в день с постепенным их повышением при хорошей переносимости до снижения частоты сердечных сокращений в покое до 50–60 уд/мин. Клинический эффект наступает обычно при приеме не менее 160–240 мг препарата в сутки; более удобны в условиях длительного применения пролонгированные формы (изоптин-ретард, верогалид-ретард). С учетом благоприятного влияния верапамила на диастолическую функцию и величину субаортального градиента давления в ЛЖ, а также доказанной способности увеличивать выживаемость больных ГКМП по сравнению с плацебо [46], целесообразно его профилактическое назначение у асимптоматичных больных ГКМП высокого риска.
Место дилтиазема в лечении ГКМП окончательно не определено. Имеются данные, что в средней дозе 180 мг/сут за 3 приема он оказывает столь же выраженное, как 240 мг верапамила, благотворное влияние на диастолическое наполнение ЛЖ и одинаковый симптоматический эффект, однако в меньшей степени улучшает физическую работоспособность больных [47].
В нашей клинике продолжается проспективное наблюдение (от 1 до 5 лет) более 100 больных ГКМП. Больные были рандомизированы на 3 сопоставимые по количеству, полу, возрасту и тяжести клинических проявлений группы. Пациентам произвольно назначались атенолол или изоптин-ретард; в третьей группе преобладали лица с тяжелыми желудочковыми нарушениями ритма, и им был рекомендован прием соталола. Оценка эффективности различных вариантов медикаментозного лечения проводилась в условиях длительного (не менее 1 года) применения препаратов. Суточные дозы при двухкратном режиме приема титровались индивидуально и составили в среднем 85, 187, 273 мг для атенолола, изоптина и соталола соответственно. Длительная терапия привела к улучшению клинического состояния соответственно у 77, 72 и 83% пациентов каждой группы, что выражалось в достоверном уменьшении основных симптомов, проявлений сердечной недостаточности (СН), увеличении мощности и времени выполненной нагрузки и улучшении показателей качества жизни (на 25, 32 и 34% соответственно). При этом выявлены достоверное (p
С. А. Габрусенко, кандидат медицинских наук
Ю. В. Сафрыгина
В. Г. Наумов, доктор медицинских наук, профессор
Ю. Н. Беленков, доктор медицинских наук, профессор
НИИ кардиологии им. А. Л. Мясникова РК НПК МЗ РФ, Москва
Источник