- Мутации генов BRCA1 и BRCA2
- Эпидемиология мутаций в генах BRCA1 и BRCA2
- Роль мутаций в генах BRCA1 и BRCA2
- Алгоритм тестирования на мутации генов BRCA1 и BRCA2
- Мутации гена EGFR
- Роль рецептора EGFR и мутаций гена EGFR в патогенезе немелкоклеточного рака легкого
- Что такое EGFR?
- Зачем определять статус мутации гена EGFR?
- Какие биоматериалы могут быть отправлены на EGFR-тестирование?
- О Программе тестирования мутаций гена EGFR у пациентов с немелкоклеточным раком легкого
- Каким пациентам необходимо молекулярно-генетическое тестирование на наличие мутации гена EGFR?
- Определение мутации в генах KRAS и NRAS при раке толстой кишки
- Биологические функции генов семейства RAS
- В каких случаях нужно сделать тест на мутацию в генах KRAS и NRAS?
- Что делать, если в опухоли толстой кишки обнаружена мутация в гене KRAS или NRAS?
- Как сдать анализ на мутации в гене KRAS, NRAS, EGFR, BRAF?
- Требования к упаковке материала перед транспортировкой
- Что вам необходимо сделать
- Публикации по теме:
Мутации генов BRCA1 и BRCA2
Тестирование мутаций в генах BRCA1 и BRCA2 в рамках программы «Совершенствование молекулярно-генетической диагностики в Российской Федерации» выполняется у пациенток с платиночувствительным рецидивом распространенного рака яичников.
Эпидемиология мутаций в генах BRCA1 и BRCA2
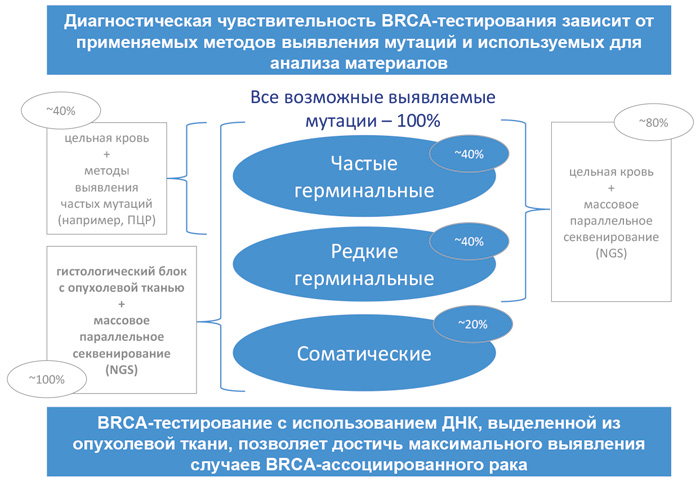
Частота встречаемости BRCA мутаций в популяции – 1:800-1:1000, при этом она зависит от географической локализации и этнической группы. При раке яичников мутации генов BRCA 1/2 выявляются в 22-28% случаев. Частота выявления мутаций BRCA1/2 зависит от используемого метода и тестируемого биоматериала.
Роль мутаций в генах BRCA1 и BRCA2
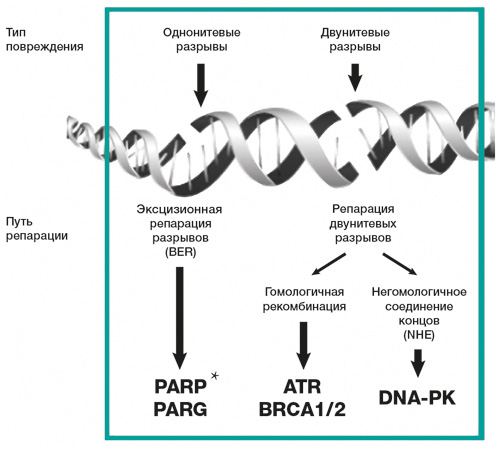
Гены BRCA1/2 относятся к группе генов-супрессоров, вовлеченных в процесс гомологичной репарации двунитевых разрывов ДНК.
Наличие клинически значимых мутаций в генах BRCA1 или BRCA2 вызывает потерю функции белков, кодируемых этими генами, в результате чего нарушается основной механизм репарации двунитевых разрывов ДНК. Альтернативные пути репарации (BER, NHEJ) не способны полностью исключить накопление большого числа ошибок в первичной структуре ДНК (геномная нестабильность), следствием чего является повышенный риск возникновения некоторых злокачественных новообразований (рака молочной железы, рака яичников, рака простаты, рака поджелудочной железы) (рис. 1).
Алгоритм тестирования на мутации генов BRCA1 и BRCA2
При мутации BRCA1/2 эффективной стратегией лечения является применение PARP-ингибитора олапариба. В случаях, когда блокируется фермент PARP, клетки не могут эффективно восстанавливать однонитевые разрывы. Во время репликации ДНК эти однонитевые разрывы переходят в двунитевые. Накопление двунитевых разрывов при нарушении их восстановления в случае мутации BRCA1/2 ведет к селективной гибели опухолевых клеток.
Персонализированной подход к выбору терапии, основанный на результатах молекулярно-генетического тестирования, позволит повысить эффективность лечения рака яичников:
- Наличие клинически значимых мутаций BRCA1/2 позволяет определить пациенток, у которых наиболее эффективна терапия PARP-ингибиторами (олапариб)
- Наличие мутаций BRCA1/2 дает возможность прогнозировать эффективность различных режимов химиотерапии
Знание статуса BRCA позволит более точно определить прогноз заболевания.
Выявление мутаций BRCA1/2 у больных раком яичников определяет необходимость обследования их родственников для выявления здоровых носителей мутации BRCA1/2 и обеспечения диагностики злокачественных новообразований на ранних стадиях, когда лечение наиболее эффективно.
Отрицательный результат теста на частые мутации не гарантирует отсутствие других мутаций в этих генах. При наличии другого злокачественного образования в анамнезе у самой пациентки (рак молочной железы и др.), семейного анамнеза (рак молочной/грудной железы, рак яичников, рак предстательной железы, рак поджелудочной железы и др. у ближайших родственников), рекомендовано проведение консультации клинического генетика.
Для качественного оказания помощи больным раком яичников важно взаимодействие всех специалистов, вовлеченных в процесс выбора режима терапии.
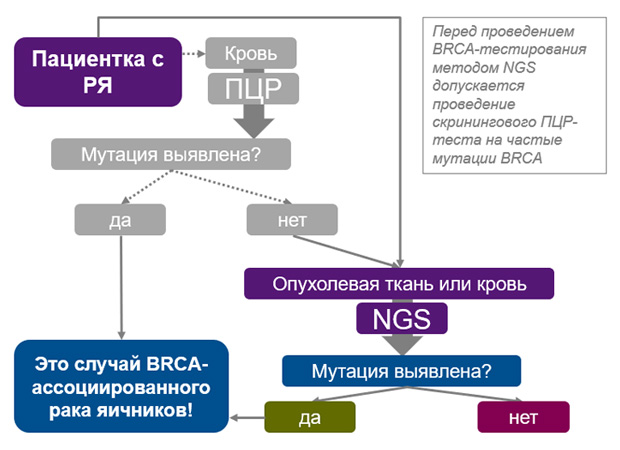
В интересах пациенток в рамках Программы возможна отправка нескольких видов биологического материала: опухолевой ткани (гистологического блока) и/или здоровой ткани (крови или гистологического блока). Однако, только комбинация «опухолевая + здоровая ткань» позволяет выявлять весь спектр мутаций генов BRCA (когда показано) и определять их характер (наследственный или соматический), что имеет огромное значение для медико-генетического консультирования пациенток и их родственников.
Отправка на BRCA-тестирование только здоровой ткани (например, крови) позволяет выявить только герминальные мутации; отправка опухолевой и здоровой ткани позволяет выявить и герминальные и соматические мутации с определением их характера. Соматические мутации генов BRCA выявляются в 6-8% случаев серозного РЯ высокой степени злокачественности и составляют не менее 20% случаев BRCA-ассоциированного рака яичника. Соматические мутации также определяют характер и тактику лечения.
Рекомендуется направлять на BRCA-тестирование одновременно и опухолевый материал пациентки, и здоровую ткань (кровь). Такой подход позволяет с максимальной чувствительностью выявлять случаи BRCA-ассоциированного рака яичников, а также определять герминальный или соматический характер мутации, что может быть важно для дальнейшей диагностики родственников пациенток.
Благодарим ООО «АстраЗенека Фармасьютикалз» за спонсорскую поддержку тестирования.
- Balmana J, Diez O, Rubio IT, Cardoso F. Ann Oncol 2011; 22 (Suppl 6): vi31-vi34.
- Е.Н. Имянитов. Практическая онкология. 2010; Т.11, №4: 258-266.
- Любченко Л.Н., Батенева Е.И., Абрамов И.С., Емельянова М.А., Будик Ю.А., Тюляндина А.С., Крохина О.В., Воротников И.К., Соболевский В.А., Наседкина Т.В., Портной С.М. Наследственный рак молочной железы и яичников. Злокачественные опухоли. 2013; 2: 53-61. DOI: 1100.18027/2224-5057-2013-2-53-61.
- Jackson SP. Drug Discovery World, 2003; Fall: 41-45.
- Л.Н. Любченко, Е.И. Батенева. Медико-генетическое консультирование и ДНК-диагностика при наследственной предрасположенности к раку молочной железы и раку яичников. Пособие для врачей. М.: ИГ РОНЦ, 2014, 64 с.
Войти
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Источник
Мутации гена EGFR
Роль рецептора EGFR и мутаций гена EGFR в патогенезе немелкоклеточного рака легкого
Многочисленные биологические исследования выявили повышенную активность рецептора EGFR и каскада, запускающегося при активации этого рецептора, у больных немелкоклеточным раком легкого.
Что такое EGFR?
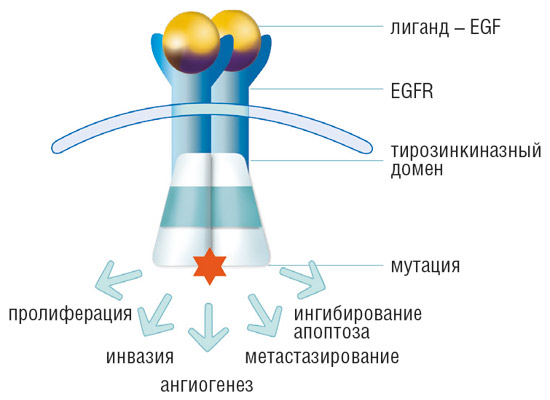
- EGFR – трансмембранный рецептор, активирующийся при связывании с эпидермальным фактором роста, трансформирующим фактором роста-α, амфирегулином.
- При активации EGFR внутри клетки запускается каскад биохимических реакций, приводящих к повышению пролиферации малигнизированных (опухолевых) клеток, росту опухоли, стимуляции процессов инвазии, патологического ангиогенеза и метастазирования.
- Рецептор EGFR кодируется геном EGFR.
В ряде опухолей обнаруживаются аномальные рецепторы эпидермального фактора роста, что обусловлено наличием мутации в соответствующем гене. В клетках с мутацией происходит активация сигнального пути EGFR, что, в свою очередь, инициирует процессы злокачественной трансформации в большинстве опухолей. Сигнальные пути контролируют процессы пролиферации, апоптоза – одного из механизмов клеточной гибели, утраты способности клеток к дифференцировке, процессы ангиогенеза и метастазирования.
Зачем определять статус мутации гена EGFR?
Тест на мутацию гена EGFR предназначен для отбора больных местно-распространенным или метастатическим немелкоклеточным раком легкого на терапию низкомолекулярными ингибиторами EGFR (ингибиторами тирозинкиназы).
Наличие мутаций гена EGFR позволяет выделить группу пациентов с наибольшей вероятностью выраженного ответа на терапию ингибиторами тирозинкиназы (гефитиниб).
Известны активирующие мутации гена EGFR, связанные с чувствительностью либо устойчивостью к ингибиторам тирозинкиназы. Подавляющее большинство мутаций, связанных с чувствительностью (
90%), – это делеции в 19 экзоне (Del19) или замена L858R в 21 экзоне. Опухоли с мутациями Del19 или L858R наиболее чувствительны к терапии ингибиторами тирозинкиназы EGFR. Прочие мутации, связанные с чувствительностью (G719X, L861Q, S768I и некоторые другие), составляют в сумме
5% мутантных случаев.
Инсерции 20 экзона связаны с устойчивостью к ингибиторам тирозинкиназы и составляют
3% опухолей с мутациями. Еще одна мутация, связанная с устойчивостью, – T790M. Частота выявления этой мутации после проведения химиотерапии ингибиторами тирозинкиназы составляет примерно 50%, однако в 1-3% случаев мутация может возникать de novo. Мутация T790M в гене EGFR является наиболее частой причиной возникновения резистентности к проводимой таргетной терапии. Своевременное выявление этой мутации позволяет выяснить причину резистентности и принять решение о смене терапии у пациента. Поэтому для назначения эффективной таргетной терапии всем больным немелкоклеточным раком легкого необходим анализ как на наличие мутаций чувствительности, так и на наличие/отсутствие мутаций устойчивости к ингибиторам тирозинкиназы.
Определение статуса мутации гена EGFR и персонализированный подход к выбору терапии, основанный на результатах молекулярно-генетического тестирования, позволят сделать лечение немелкоклеточного рака легкого более эффективным и приблизиться к международным тенденциям клинической практики.
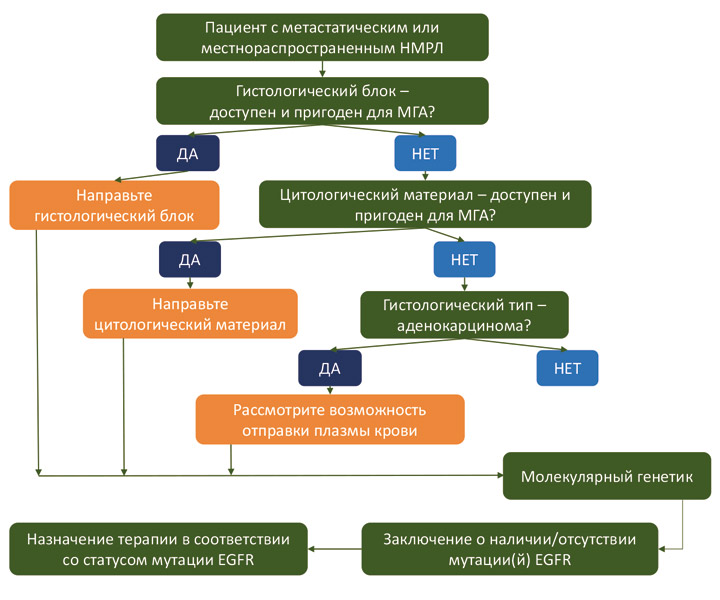
Какие биоматериалы могут быть отправлены на EGFR-тестирование?
Анализ можно выполнить с использованием гистологического материала, цитологического материала или образца плазмы крови. Предпочтительна отправка гистологического материала, так как именно в этом случае достигается максимальная чувствительность анализа. Результативность тестирования по цитологическому материалу сопоставима с результатами, полученными для гистологических блоков. Если у пациента есть цитологический материал, то (в отсутствие гистологического) он представляет собой приемлемую альтернативу для EGFR-тестирования. В случаях, когда у пациента с аденокарциномой легкого отсутствует материал опухоли, следует рассмотреть возможность отправки плазмы крови на EGFR-тест. Несмотря на относительно низкую чувствительность и высокую трудоемкость анализа по плазме крови, он может быть единственной опцией для пациентов, чей опухолевый материал (гистологический или цитологический) утрачен или полностью израсходован на другие исследования.
Алгоритм выбора биоматериала для выполнения EGFR-тестирования приведен на схеме ниже:
Видеоинструкция по получению плазмы крови для EGFR-тестирования:
О Программе тестирования мутаций гена EGFR у пациентов с немелкоклеточным раком легкого
- Тестирование в рамках Программы проводится на всей территории страны.
- Отправка материала и тестирование проводится бесплатно для врачей и пациентов.
Каким пациентам необходимо молекулярно-генетическое тестирование на наличие мутации гена EGFR?
Пациентам с распространенным (местно-распространенным или метастатическим) немелкоклеточным раком лёгкого (в частности: аденокарцинома легкого, крупноклеточный рак, плоскоклеточный и аденоплоскоклеточный рак и др.).
Благодарим ООО «АстраЗенека Фармасьютикалз» за спонсорскую поддержку тестирования.
- Reck M, Clint L. Lung Cancer. 2009 Jan; 63(1): 1-9.
- Lynch T, Bell DW. Sordella Retal. N Engl J Med. 2004 May 20; 350(21): 2129-3.
- Herbst RS, Hyemach JV, Lippman SM. N Engl J Med. 2008 Sep 25; 359(13): 1367-80.
- Gazdar AF, Shigematsu H, Herz J, Minna JD. Trends Mol Med. 2004 Oct; 10(10): 481-6.
- Mok T, et al. N Engl J Med 2009; 361: 947-957.
- Han J, et al. J Clin Oncol 2012; 30: 1122-1228.
- Maemondo M, et al. N Engl J Med 2010; 362: 2380-2388.
- Mitsudomi T, et al. Lancet Oncol 2010; 11: 121-128.
- Zhou C et al. Lancet Oncol 2011; 12: 735-742.
- Rosell R, et al. Lancet Oncol 2012; 13: 239-246.
- Gridelli C, et al. J Clinical Oncol 2012; 30: 3002-3011.
- Wu Y, et al. Lancet Oncol 2014; 15: 213-222.
- Sequist L, et al. J Clin Oncol 2013; 31: 3327-3334.
- Haratani K, Hayashi H, Tanaka T, et al. Ann Oncol 2017; 28(7): 1532-1539.
Войти
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Источник
Определение мутации в генах KRAS и NRAS при раке толстой кишки
Биологические функции генов семейства RAS
Одно из ключевых свойств любой опухоли — это нарушение баланса между клеточным делением, т.е. размножением клеток, и клеточной гибелью. Для того, чтобы процесс деления осуществлялся в норме, необходимо поступление верного сигнала в клеточное ядро. Подобным сигналом являются специальные белки – факторы роста. Они прикрепляются к определённым рецепторам на поверхности клеточной оболочки и запускают внутри клетки ряд последовательных биохимических реакций. Результатом становится производство и накопление внутри клетки белков, которые необходимы для дальнейшего деления.
Гены семейства RAS (KRAS, NRAS и HRAS) – это один из важнейших звеньев сигнальной цепочки внутри клетки. Они передают сигналы к делению от рецепторов к ядру клетки. В норме эта цепочка сигналов (или, по-другому, сигнальный каскад) запускается «по команде» факторов роста. Например, фактором роста может выступать белок EGF (Epidermal Growth Factor ‒ перевод «эпидермальный фактор роста»). EGF и другие белки способны стимулировать рост и деление различных клеток. В случае мутации в каком-либо из генов – KRAS, NRAS или HRAS – происходит самопроизвольная активация передачи импульса к делению, то есть клетки начинают размножаться без команды от фактора роста. Процесс выходит из-под контроля, и опухоль начинает активно расти.
Необходимо отметить, что активирующие мутации не только в этих генах, но и в других звеньях сигнальной цепочки могут приводить к постоянной стимуляции клеточного деления. К таким событиям относятся, например, мутации в генах EGFR, BRAF и др. Упомянутые генетические повреждения в разной степени свойственны опухолям различных органов. Например, мутации в генах семейства RAS (KRAS, NRAS, HRAS) встречаются при раке поджелудочной железы, толстой кишки, лёгкого, кожи и т.д. Мутации EGFR характерны для немелкоклеточного рака легкого, а повреждения BRAF с наибольшей частотой обнаруживаются при меланоме.
В каких случаях нужно сделать тест на мутацию в генах KRAS и NRAS?
Тестирование опухоли на наличие мутаций в генах KRAS и NRAS выполняется пациентам с опухолями толстой кишки. Тест позволяет лечащему онкологу решить вопрос о возможности использования в терапии антител к определенному фактору роста и деления клеток ‒ EGFR. Данные препараты – панитумумуаб или цетуксимаб ‒ блокируют расположенные на мембране клеток рецепторы эпидермального фактора роста (EGFR) и препятствуют росту опухоли.
Если в «нижележащих» генах-участниках сигнальной цепи (KRAS, NRAS или BRAF) присутствует мутация, то использование цетуксимаба и панитумумаба становится неэффективным. То есть препараты не будут препятствовать росту опухолевых клеток, поскольку воздействуют не на те звенья сигнальной цепочки, они не смогут предотвратить подачу сигнала к клетке.
Более того, существуют сведения о том, что ошибочное назначение анти-EGFR терапии пациентам, у которых мутация в перечисленных генах не выявлена, может ускорять рост опухоли. Частота мутаций в гене KRAS при опухолях толстой кишки достигает 50%. Ещё около 10-20% приходится на мутации в генах NRAS и BRAF. Таким образом, при правильном обследовании лечение антителами к EGFR должно назначаться не более 30-40% пациентов с раком толстой кишки, в остальных случаях используются другие схемы терапии.
Что делать, если в опухоли толстой кишки обнаружена мутация в гене KRAS или NRAS?
Обнаружение мутации в гене KRAS или NRAS является абсолютным противопоказанием к использованию цетуксимаба или панитумумаба, т.к. присутствие этих мутаций полностью препятствует противоопухолевому действию данных препаратов. Как упоминалось выше, при ошибочном назначении антител к EGFR пациентам с мутациями в генах RAS может наблюдаться ускорение роста опухоли – именно поэтому полноценное исследование данных генов является обязательным условием для подбора правильной терапии. В случае наличия мутаций в генах KRAS и NRAS в клетках опухоли успешно используются другие разновидности лечения.
Как сдать анализ на мутации в гене KRAS, NRAS, EGFR, BRAF?
Чтобы провести молекулярно-генетическое тестирование, специалистам необходимы опухолевые клетки. Они могут быть получены либо при биопсии, либо в ходе хирургической операции по удалению новообразования. При этом, материал для исследования должен быть подготовлен определенным образом. В противном случае тестирование будет невозможно.
В ходе первичного обследования онкологическому пациенту практически всегда выполняют биопсию, на основании которой происходит патоморфологическое подтверждение диагноза. Для этого полученные клетки пациента проходят многоэтапную химическую обработку. В результате из них создаётся специальный парафиновый блок. С одной стороны, он необходим для получения качественного тонкого среза (толщиной 5 мкм) с целью патоморфологической диагностики. С другой стороны, в правильно подготовленном парафиновом блоке молекулы ДНК надёжно сохраняются на протяжении десятилетий.
Аналогичные манипуляции патологи проводят в отношении опухолевых тканей, удалённых во время операции. Правильное выполнение процедуры фиксации тканей позволяет использовать образцы опухолей для молекулярно-генетического исследования ДНК спустя месяцы и годы после заливки образца в парафин.
Идеальным набором для молекулярно-генетического исследования является следующий комплект: парафиновый блок c тканью опухоли и одно стекло, окрашенное специальными красителями (гематоксилином и эозином). Всё перечисленное хранится в патологоанатомических архивах медицинских учреждений, а окраска гематоксилином и эозином – основная окраска, используемая в современной патоморфологической диагностике. Если медицинское учреждение по какой-либо причине не может предоставить блоки, то для молекулярно-генетического тестирования достаточно 5-10 неокрашенных срезов ткани опухоли на непокрытых стёклах толщиной 3-5 мкм и одно стекло, окрашенное гематоксилином и эозином.
Требования к упаковке материала перед транспортировкой
- Закрывающийся пластиковый пакет или контейнер, либо картонная коробка
- Полное соответствие номеров отправляемых блоков и стёкол в направлении на тест и копии патоморфологического заключения.
- Лабораторные стекла должны быть обёрнуты плотной бумагой для избежания повреждений.
- Хранение производится при комнатной температуре, не допустим нагрев блоков и стёкол выше +50 о С.
В настоящее время многие молекулярно-диагностические исследования выполняются за счет средств территориальных фондов ОМС регионов России (как Санкт-Петербурга, так и остальных субъектов РФ).
Авторская публикация:
Иванцов Александр Олегович
доктор медицинских наук, старший научный сотрудник научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Что вам необходимо сделать
- Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
- Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте, Instagram, Facebook, YouTube и Одноклассники.
- Если вам понравилась статья:
- оставьте комментарий ниже;
- поделитесь в социальных сетях через удобные кнопки:
Публикации по теме:
1. Более того, существуют сведения о том, что ошибочное назначение анти-EGFR терапии пациентам, у которых мутация в перечисленных генах не выявлена, может ускорять рост опухоли.
2. Как упоминалось выше, при ошибочном назначении антител к EGFR пациентам с мутациями в генах RAS может наблюдаться ускорение роста опухоли.
Что из этого верно? Наверное, второе?
Источник