- Лимфоваскулярная инвазия не выявлена что это значит
- Лимфоваскулярная инвазия — Lymphovascular invasion
- СОДЕРЖАНИЕ
- Терминология
- Патология
- Прогностическое значение
- Рак молочной железы
- Уротелиальный рак
- Колоректальный рак
- Скрытая опасность — поражение лимфатических узлов при раке прямой кишки у пациентов с полным ответом опухоли на неоадъювантную химиотерапию
- Введение
- Дизайн
- Источник данных
- Критерии включения
- Объект исследования
- Результаты
- Ограничения
- Заключение
- Лимфоваскулярная инвазия не выявлена что это значит
Лимфоваскулярная инвазия не выявлена что это значит
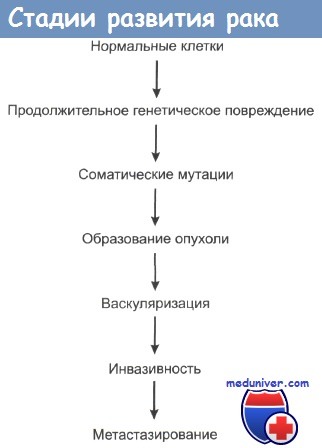
Можно сказать, что раковые клетки в определенной степени не реагируют на механизмы, контролирующие рост и развитие нормальной ткани. При пролиферации нормальной ткани непосредственный контакт клетки со своими соседями обычно служит сигналом к прекращению размножения. Это контактное торможение отсутствует в опухолевых тканях.
При подкожном введении раковых клеток иммунодефицитным мышам происходит рост и развитие опухоли, что никогда не случается при введении здоровых клеток. Раковые клетки отличаются от здоровых по составу мембранных гликопротеинов, по микропотенциалам на клеточной мембране, а также характеризуются повышенным содержанием сиаловой кислоты. Локомоторный клеточный аппарат (микротрубочки и микрофиламенты) раковых клеток деградирует, клетка теряет присущие ей формы, отмечается миграция цитоплазмы раковой клетки в зону контакта со здоровыми клетками.
Одновременно раковые клетки становятся локально инвазивными, хотя биохимические основы этого свойства до сих пор четко не выявлены. Опухолевые клетки часто демонстрируют пониженную адгезивность в сравнении с нормальными клетками. Важным моментом механизма инвазии является секреция определенных ферментов. Некоторые ферменты играют ключевую роль в протеолизе внутриклеточного матрикса, который всегда сопровождает инвазию раковых клеток. К таким ферментам относится семейство матричных металлопротеиназ (ММП), которое включает в себя колллагеназы, желатиназы и стромолизины.
Эти ферменты экскретируются в неактивной форме. Последующий разрыв сульфгидрильной группы и присоединение атома металла (чаще всего цинка) приводят к изменению конформации фермента и переводят его в активное состояние. Тканевые ингибиторы металлопротеиназ (ТИМП) прекращают действие этих ферментов. Некоторые типы тканей изначально обладают повышенной устойчивостью к инвазии. Это, например, компактная костная ткань, ткани крупных сосудов и хрящевая ткань. Предположительно способность к инвазии у опухолевых клеток появляется в результате трансформации нормальных процессов реконструкции и восстановления здоровых тканей. Тем не менее к настоящему моменту неизвестно, какие конкретно изменения генетической структуры раковых клеток ответственны за инвазивный рост.
По мере роста опухоли она выделяет в кровь ангиогенные факторы, которые стимулируют прорастание опухоли кровеносными сосудами и формирование сети капилляров. Сосудистая система кровоснабжения опухоли может стать мишенью для различных видов противораковой терапии. Опухоль стимулирует пролиферацию эндотелиальных клеток, выделяя ангиогенные цитокины, такие как эндотелиальный фактор роста сосудов (ЭФРС), ТФР и факторы роста фибробластов. Эндотелиальные же клетки в свою очередь могут стимулировать рост клеток опухоли. В одном грамме опухолевой ткани может находиться до 10-20 млн эндотелиальных клеток, которые не являются неопластическими.
Антигены нормальных эндотелиальных клеток, включая и профакторы свертываемости крови, могут быть разрегулированы в активно пролиферирующей под действием опухоли эндотелиальной ткани. В дополнение к действию цитокинов, гипоксия, развивающаяся в сети опухолевого кровоснабжения, может стимулировать выбросы ЭФРС и других факторов. В ходе ангиогенеза эндотелиальные клетки внедряются в строму опухоли, активно делятся там с образованием зачатков новых капилляров, которые затем развиваются в сосудистую систему опухоли. Как и в случае инвазии опухолевых клеток, этот процесс идет с участием продуцируемых эндотелием ММП и их естественных ингибиторов.
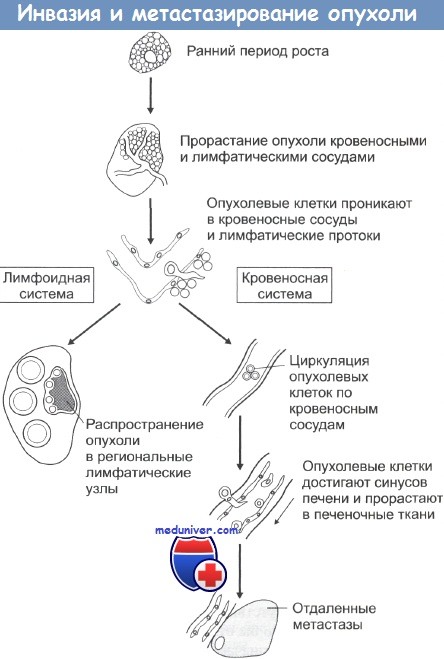
При локальной инвазии рака опухолевые клетки могут попадать в сосудистую систему и давать начало метастазам. Последовательность событий при метастазировании показана на рисунке. Распространение раковых клеток по лимфатической системе, что особенно характерно при карциномах, происходит при попадании опухолевых клеток в лимфатические протоки с последующим оседанием их в местах разветвления протоков и в ближайших лимфатических узлах. Вслед за этим обычно происходит инфильтрация опухолевыми клетками и отдаленных лимфоузлов. Распространение через кровяное русло проходит при проникновении раковых клеток в кровеносные сосуды рядом с местом первичной локализации опухоли либо через грудные протоки. Подхваченные током крови раковые клетки затем захватываются ближайшими капиллярными сетями, чаще всего сетями печени и легких, и оседают в них. При оценке направлений метастазирования очень важно учитывать первичную локализацию опухоли.
Например, опухоли пищеварительного тракта обычно метастазируют через воротную вену в печень. Опухоли также могут метастазировать непосредственно сквозь прилегающие ткани. Так возникающие в брюшной полости новообразования могут очень быстро рассеяться по всему внутрибрюшинному пространству, а клетки рака легкого могут мигрировать через плевру. Некоторые опухоли метастазируют в определенные органы и ткани, другие — бессистемно. Саркомы, например, почти всегда метастазируют в легкие, рак молочной железы поражает также ткани осевого скелета. Тем не менее биологических механизмов, объясняющих такую избирательность, пока не найдено.
Региональные лимфоузлы могут осуществлять барьерную функцию, предотвращая распространение метастазов за пределы области первичной локализации опухоли. До сих пор четко не выяснено, каким образом и за счет каких специфических иммунных механизмов лимфатические узлы создают барьер на пути распространения опухоли.
Проникая в кровеносное русло в районе первичной опухоли, раковые клетки затем могут достигать других органов и тканей. Для того чтобы дать начало новым очагам опухоли, эти клетки на новом месте должны, во-первых, проникнуть в ткани через эндотелий капилляров, а во-вторых, выжить при атаках местных иммунных систем защиты, таких как фагоцитирующие клетки и так называемые естественные киллеры (ЕК).
Способность к инвазированию и расселению в отдаленных органах и тканях у различных видов опухолей сильно варьирует. Эта способность, по-видимому, определяется степенью экспрессии того участка генома, который и обусловливает злокачественный рост клеток. Действительно, со временем почти все раковые опухоли накапливают все больше и больше генетических изменений в своих клетках и приобретают способности к инвазии и метастазированию. Но даже при клиническом обнаружении опухоли метастазы и инвазия могут проявиться лишь спустя несколько лет. Типичным примером является карцинома низкой степени злокачественности. Следует отметить, что даже однотипные виды рака с одинаковой степенью дифференцированности опухолевых клеток по-разному метастазируют у разных больных.
Все это говорит о необходимости поиска молекулярных маркеров, которые смогли бы предсказывать исход течения онкологического заболевания более точно, чем диагностика по гистологическому типу опухоли (хотя последний метод в настоящее время является наиболее точным из всех возможных). Кроме того, даже конкретная опухоль может быть в значительной степени гетерогенной и состоять из клеток, различных по своему метастатическому потенциалу, что было показано на клонированных субпопуляциях, выделенных из одной опухоли. Биологические причины такой вариабельности в настоящее время неизвестны.
Совершенно ясно, что для успешного лечения онкологических пациентов необходимо проводить масштабные исследования в области нахождения механизмов тканевой инвазии, метастатического роста и поиска биологических причин гетерогенности опухолей. Отсутствие гомогенности в опухолях, сходство опухолевых клеток со здоровыми клетками породившей ее ткани, и отсутствие четкого единичного критерия, по которому можно было бы отличить раковую клетку от здоровой, — все это вместе означает, что наши рассуждения о противоопухолевом иммунитете или о механизмах действия лекарственных цитостатических препаратов должны приниматься с изрядной долей скептицизма, особенно если они базируются на экспериментах с гомогенными опухолевыми культурами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Лимфоваскулярная инвазия — Lymphovascular invasion
Лимфоваскулярное вторжение ( LVI или лимфоваскулярная пространство вторжение ) является вторжением из рака в кровеносных сосуды и / или лимфатические сосуды .
СОДЕРЖАНИЕ
Терминология
Лимфа: прозрачная или белая жидкость, которая проходит по сосудам, движется внутри тканей и поддерживает все части тела в чистоте. Сосудистый: сеть кровеносных сосудов организма. Когда рак распространяется на лимфатическую и сосудистую систему, это называется лимфоваскулярной инвазией.
Патология
Лимфоваскулярная инвазия, особенно при карциномах , обычно предшествует распространению на лимфатические узлы, дренирующие ткань, в которой возникла опухоль. И наоборот, рак с распространением лимфатических узлов (известный как метастазы в лимфатические узлы ) обычно имеет лимфоваскулярную инвазию. Метастазы в лимфатические узлы обычно предшествуют вторичным опухолям, то есть отдаленным метастазам .
Обычно считается, что отсутствие LVI в контексте подтвержденного метастазирования в лимфатические узлы связано с ошибкой выборки .
Прогностическое значение
Прогностическая ценность и распространенность лимфоваскулярной инвазии сильно зависит от типа рака. Другими словами, LVI при одном типе рака может быть гораздо менее важным, чем LVI при другом типе рака.
Вообще говоря, это связано с метастазами в лимфатические узлы, которые сами по себе указывают на худший прогноз . В контексте ( гистологически ) подтвержденных метастазов в лимфатические узлы LVI может иметь меньшее прогностическое значение или не иметь прогностического значения.
Рак молочной железы
Вопрос о том, является ли LVI значительным прогностическим фактором при раке груди, широко обсуждается, и нет четкого консенсуса.
Уротелиальный рак
При уротелиальной карциноме LVI является независимым предиктором худшего прогноза, который имеет большую прогностическую силу, чем стадия опухоли .
Колоректальный рак
При спорадической колоректальной карциноме LVI с худшим прогнозом.
Источник
Скрытая опасность — поражение лимфатических узлов при раке прямой кишки у пациентов с полным ответом опухоли на неоадъювантную химиотерапию
Введение
Среди пациентов с раком прямой кишки есть пациенты, у которых после неоадъювантной химиолучевой терапии отмечается полный ответ опухоли. При этом ответ пораженных лимфатических узлов на терапию не так однозначен — клиническая оценка затруднена. Создание инструментов для оценки риска поражения лимфатических узлов позволит выбрать более целесообразную тактику у таких пациентов: выполнение резекции или динамическое наблюдение.
Цель исследования — определение факторов риска для остаточного поражения лимфатических узлов у пациентов со стадией рака прямой кишки ypT0.
Дизайн
Ретроспективное исследование по типу “случай-контроль”.
Источник данных
Поиск данных пациентов проводился в Национальной базе данных по раку (National Cancer Database) с 2006 по 2014 годы.
Критерии включения
В исследование включались пациенты со II/III стадией аденокарциномы прямой кишки, прошедшие химиолучевую терапию с последующей резекцией, и имеющими стадию опухоли ypT0. Больные с метастазами и менее чем двумя оцененными лимфатическими узлами были исключены из исследования. Пациенты были разделены на 2 группы: те, у кого было выявлено поражение лимфатических узлов (ЛУ позитивная группа) и у кого поражение выявлено не было (ЛУ негативная группа).
Объект исследования
Частота возникновения остаточного поражения лимфатических узлов и частота общей выживаемости.
Результаты
В исследование включили 42257 пациентов со стадией II/III опухоли прямой кишки, прошедших химиолучевую терапию с последующей резекцией; у 4170 (9.9%) пациентов оказалась опухоль ypT0 и у 395 (9.5%) пациентов не выявлено поражения лимфатических узлов. ЛУ негативные пациенты (в т.ч. по данным методов визуализации до начала лечения) в 6.2 % случаев перешли к ЛУ позитивными пациентами после химиолучевой терапии и резекции. При проведении мультивариантного анализа наличие следующих факторов: более высокая (до начала лечения) клиническая N-стадия, стадия опухоли III/IV, периневральная и лимфоваскулярная инвазия, повышали риск развития остаточного поражения лимфатических узлов. Высокая Т-стадия имела обратную связь с поражением лимфатических узлов. Общая 5-летняя выживаемость статистически значимо отличалась среди пациентов со стадиями заболевания ypN0, ypN1 и ypN2 (87.4%, 82.2%, и 62.5% соответственно, р=0.002).
Ограничения
Исследование ограничивалось отсутствием клинических деталей в базах данных и невозможностью оценки частоты рецидивов.
Заключение
После проведения химиолучевой терапии и последующей резекции у 10 % пациентов с опухолью прямой кишки стадии ypT0 отмечалось остаточное поражение лимфатических узлов. Клиническая N-стадия до начала лечения и гистологические результаты являются факторами риска возникновения остаточного поражения лимфатических узлов. Всем пациентам при наличии факторов риска показано проведение радикальной операции, несмотря на ответ опухоли на неоадъювантную терапию. У остальных пациентов может быть рассмотрена динамическая тактика.
Источник: Baucom RB et al: Nodal Disease in Rectal Cancer Patients With Complete Tumor Response After Neoadjuvant Chemoradiation: Danger Below Calm Waters. Dis Colon Rectum 2017; 60(12): 1260-1266
Источник
Лимфоваскулярная инвазия не выявлена что это значит
хирург-онколог, маммолог, кандидат медицинских наук
+7 921 945 33 18
+7 981 710 40 41
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
В в клинике онкологических решений ЛУЧ (юридический адрес — Санкт-Петербург, Петровская коса, 1), также работаю с 2002 года в отделении заболеваний молочной железы ФГБУЗ Клиническая больница Российской академии наук. В 2007 году проходил обучение по онкологии в МАПО. С 2007 года являюсь действительным членом ЕВРОПЕЙСКОГО ОБЩЕСТВА МАММОЛОГОВ (EUSOMA) и ЕВРОПЕЙСКОГО ОБЩЕСТВА МЕДИЦИНСКОЙ ОНКОЛОГИИ (ESMO).
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Источник