Некоторые замечания о титровании и точных растворах
Установка титра—одна из ответственнейших операций лабораторной техники. От правильности приготовления титрованного раствора завиеит и результат анализа. Не нужно забывать, что, например, на заводе на основе данных анализа осуществляется контроль за течением технологического процесса и неправильный анализ может повести к тем или иным осложнениям. Так как каждый анализ почти всегда сопровождается титрованием, каждый работник лаборатории должен хорошо освоить технику проведения этой операции.
Нужно помнить несколько правил, относящихся к титрованным растворам.
1. Титрованные растворы должны быть по возможности свежими. Длительное хранение их не должно допускаться. Для каждого раствора есть свой предельный срок хранения.
2. Титрованные растворы при стоянии изменяют свой титр, поэтому их следует иногда проверять. Если же делают особенно ответственный анализ, проверка титра раствора обязательна.
3. Титрованные растворы, на которые действует свет -(растворы AgNO3 и др.), следует хранить в желтых бутылях или в таких, которые бы защищали раствор от действия света.
4. При приготовлении растворов марганцевокнслого калия титр их следует устанавливать не ранее чем через 3—4 дня после приготовления. То же относится ко всём другим растворам, способным изменяться со временем или при соприкосновении с воздухом, стеклом и пр.
5. Титрованные растворы щелочей лучше хранить в бутылях, покрытых внутри парафином, а также защищать их от действия двуокиси углерода воздуха (хлоркальциевая трубка с натронной известью или аска-ритом),
6. Все бутыли с титрованными растворами должны иметь четкую надпись с указанием вещества, нормальности, поправки, времени изготовления раствора и даты проверки титра.
7. При титровании кислых или щелочных растворов полезно применять так называемый раствор-свидетель.
Во время титрования колбу нужно держать левой рукой, а правой рукой управлять краном бюретки, давая стекать жидкости равномерно. При титровании очень большое значение имеет скорость его. Поэтому при повторном титровании одного и того же раствора нужно, чтобы скорость добавления раствора из бюретки была по возможности одинаковой, т. е. в одно и то же время вытекало бы определенное количество жидкости. Положение рук при титровании показано на рис. 352.
Для перемешивания титруемого раствора очень удобно»при-менять магнитные мешалки. В этом случае титрование можно вести как в обычной конической колбе, так и в специальных, приспособленных для титрования темиоокрашенных жидкостей.
При аналитических работах большое внимание нужно уделять расчетам. Они не будут казаться трудными, если с самого начала работы усвоить понятия, которые лежат в основе всех расчетов, т. е. понятия о титре, нормальности и грамм-эквиваленте и о связи между ними.
Например, если взята какая-нибудь навеска нужного вещества, то титр T приготовленного раствора будет равен навеске а, деленной на объем (V) раствора:

Рис. 352. Положение рук при титровании.
Нормальность можно вычислить, если известна навеска а и грамм-эквивалент E растворяемого вещества


Если же раствор готовят в другом объеме, меньшем или большем, чем 1000 мл, навеску рассчитывают на 1 л, и тогда формула для вычисления нормальности примет вид

Эта формула позволяет рассчитывать нормальность раствора из взятой навески независимо от его объема. Между титром, грамм-эквивалентом и нормальностью существует простая зависимость:

Иногда при расчетах пользуются поправкой на нормальность или коэффициент нормальности К. Эта поправка является отношением титра практического T к титру теоретическому (То):

Эта поправка показывает, какому количеству миллилитров точно нормального раствора соответствует 1 мл данного раствора. При умножении результатов титрования (мл) на эту поправку полученный объем приводят к определенной концентрации, например 0,1 н. раствору.
Однако целесообразность пользования поправкой на нормальность очень сомнительна, так как все расчеты можно с успехом делать и без этой поправки, только усложняющей расчет.
При работе с нормальными растворами задача всегда сводится вначале к определению нормальности неизвестного раствора, а затем к определению количества неизвестного вещества, содержащегося в растворе. Таким образом, основной расчетно-аналитической формулой при всех объемных определениях будет

т. е. произведение нормальности известного раствора на объем известного раствора при достижении конца реакции всегда равно произведению нормальности неизвестного раствора на объем последнего. Это произведение показывает число эквивалентов прореагировавших веществ. Отсюда можно определить нормальность неизвестного раствора A2, которая будет равна

(2)
Когда величина N2 известна, применяют общую формулу для определения нормальности по навеске (а);

(3)
Поскольку задачей аналитика является определение Величины а, из этой формулы находят;

(4)
Или, подставив значение N2 из формулы (2),получим:

Приведенные формулы позволяют проводить все расчеты без поправок на нормальность, так как принимается, что она может быть выражена любым целым или дробным числом. Главное во всяком расчете найти количество эквивалентов, при умножении которых на величину грамм-эквивалента всегда получится количество искомого вещества.
Пример. Пусть была взята навеска 0,5000 г руды, содержащей железо. После ее растворения и разбавления полученного раствора До 100 мл в мерной колбе для титрования методом пермангапато-метрии каждый раз берут по 10 мл анализируемого раствора.
Раствор KMnO4-0,0495 н. На титрование пошло: 11,2; 11,1; 11,0; 11,1 мл раствора KMnO4. Берем среднее 11,1 мл. Нормальность раствора 11,1 • 0,0495 = 10 * N2, откуда

Количество Fe в 100 мл раствора (грамм-эквивалент Fe в данном случае равен 55,85):

Чтобы выразить содержание железа в руде в процентах, правую часть равенства умножают на JOO и делят на взятую навеску руды, т. е.
Источник
Коэффициент поправки титранта и пределы его значений.
| 🎓 Заказ №: 22228 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Коэффициент поправки титранта и пределы его значений. Расчет коэффициента поправки для растворов первичных стандартов. Расчеты навески для укрепления раствора титранта и объема растворителя для разбавления титранта.
Решение: Титрованные растворы характеризуются так называемым коэффициентом поправки (поправочным коэффициентом) К. Коэффициент поправки равен отношению экспериментально найденной точной молярной концентрации эквивалента титрованного раствора к предполагаемой молярной концентрации эквивалента. По сути, коэффициент поправки показывает, во сколь-ко раз титрованный раствор крепче или слабее по сравнению с теоретически заданной 335 концентрацией. Например, имеется приблизительно 0,1 н. раствор, для которого К = 1,006. Тогда точное значение нормальности раствора равно: 0,1 • 1,006 = 0,1006 н. То есть данный раствор в 1,006 раз более концентрирован, чем 0,1 н. раствор. 1мл данного раствора соответствует 1,006 мл 0,1 н. раствора. Рекомендуемая величина коэффициента поправки для проведения анализов: 1. Cогласно Государственной Фармакопеи XI издания: 0,9800-1,0200 2. Cогласно ГОСТ 25794.1-83 «Реактивы. Методы приготовления титрованных растворов для кислотно-основного титрования»: 0,9700-1,0300 При отклонении величины коэффициента поправки от данных пределов титрованный раствор необходимо укрепить либо разбавить. Объем воды, необходимый для разбавления, находится по формуле VH O (K 1)V 2 где V объем титрованного раствора.
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Источник
СТАНДАРТИЗАЦИЯ ТИТРОВАННЫХ РАСТВОРОВ
После приготовления проводят стандартизацию титрованных растворов. Под стандартизацией титрованного раствора понимают процесс нахождения точной концентрации активного реагента в растворе.
Согласно ГФ концентрацию титрованных растворов устанавливают с помощью специальных установочных веществ (первичных стандартов) – исходных стандартных веществ. Их обозначают буквами РО (реактив основной). Исходные стандартные вещества(первичные стандарты) – вещества высокой чистоты. Согласно указаниям ОФС «Титрованные растворы» их готовят из реактивов, подвергая дополнительной очистке (сублимируют, перекристаллизовывают).
В основе стандартизации лежит стехиометрическое взаимодействие титранта и первичного стандартного вещества.
Вещества, используемые в качестве первичных стандартов, должны иметь:
– состав, точно соответствующий формуле;
– высокую чистоту (строгая стехиометричность состава);
– устойчивость на воздухе при комнатной температуре (не должны изменяться при хранении);
– отсутствие гигроскопической влаги (должны быть негигроскопичными);
– по возможности большую молярную массу эквивалента для обеспечения минимальной погрешности взвешивания;
Согласно ОФС «Титрованные растворы» в качестве исходных стандартных веществ (реактивов основных (РО); первичных стандартов) для установки концентрации титрованных растворов в титриметрическом анализе используют:
– калия бромат (РО) KBrO3;
– натрия карбонат безводный (РО) Na2CO3;
– натрия хлорид (РО) NaСl;
Нередко для стандартизации титрованных растворов используют вторичные стандарты, содержание активного компонента в которых находят с помощью первичных стандартов.
В качестве вторичных стандартов при стандартизации титрованных растворов согласно ГФ выступают титрованные растворы с установленной концентрацией, которые стехиометрически взаимодействуют со стандартизуемым титрованным раствором.
Например, стандартизацию титрованных растворов аммония тиоцианата (аммония роданида) согласно ГФ следует проводить, используя в качестве вторичного стандарта титрованные растворы серебра нитрата.
Для стандартизации заполняют бюретку приготовленным титрованным раствором и титруют точно отмеренный объем стандартного титрованного раствора (вторичный стандарт) или точную навеску исходного стандартного вещества (реактив основной (РО); первичный стандарт). В ряде случаев при стандартизации точно отмеренный объем приготовленного титрованного раствора титруют стандартным титрованным раствором (вторичный стандарт).
Точку конца титрования (ТКТ) при стандартизации приготовленного титрованного раствора определяют тем же методом, которым она будет устанавливаться в методике количественного определения анализируемого ЛС согласно НД – по индикатору, методом потенциометрии, амперометрии и др. При стандартизации титрованного раствора должен быть использован тот же состав среды, в котором он будет использоваться.
Способ приготовления титрованного раствора, методика стандартизации, установочное вещество, температурный режим, скорость титрования (при необходимости), защита от воздействия окружающей среды (титрование в атмосфере инертного газа и др.), способ расчета концентрации и поправочного коэффициента (К) титрованного раствора приводится в статье на титрованный раствор соответствующего наименования в ОФС «Титрованные растворы».
Согласно ГОСТу для расчета концентрации приготовленного титрованного раствора в ГФ приведены 2 способа:
– по навеске химически чистого вещества (первичный стандарт);
– по титрованному раствору известной концентрации (вторичный стандарт).
На основании найденной истинной концентрации рассчитывают поправочный коэффициент к молярной концентрации (К) приготовленного титрованного раствора, который характеризует точность приготовления титрованного раствора.
Поправочный коэффициент показывает отношение реально полученной (экспериментально установленной) концентрации титрованного раствора к теоретически заданной или отношение его истинного и теоретического титров:
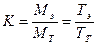
где Мэ, Мт – соответственно экспериментально установленная и теоретическая концентрация стандартизуемого титрованного раствора, М (моль/л); Тэ, Тт – соответственно истинное и теоретическое содержание растворенного вещества в стандартизуемом титрованном растворе, мг/мл.
Для обеспечения точности измерения молярной концентрации и поправочного коэффициента используют калиброванную посуду. При определении поправочного коэффициента проводят не менее трех параллельных титрований. Титрование ведут в конических колбах вместимостью 250 мл.
Если результаты титрования отличаются друг от друга менее чем на 0,05 мл, то для расчета К берут среднее арифметическое из полученных результатов. Если расхождения между отдельными титрованиями превышает 0,05 мл, то титрование повторяют до тех пор, пока не будут получены сходимые результаты.
Расхождение между коэффициентами поправки по каждой навеске установочного вещества (первичного стандарта) или по каждому объему раствора установочного вещества (вторичный стандарт) не должны превышать 0,001. Относительная погрешность определения поправочного коэффициента не должна превышать ±0,2%. Для этого следует титровать не менее 20,0-30,0 мл раствора (0,05·100/25 = 0,2%) и пользоваться мерными колбами и пипетками, предварительно проверенными на точность калибровки. Точность приготовления титрованных растворов является необходимым условием высокой точности титриметрических способов количественного определения фармацевтических субстанций и лекарственных средств.
Поправочный коэффициент нужно определять при 20 0 С. При этой же температуре рекомендуется проводить количественное определение титриметрическими методами с помощью титрованных растворов. Если титрованные растворы применяют при других температурах, то коэффициент поправки устанавливают при соответствующей температуре и используют температурную поправку.

Если титрованный раствор устойчив, соблюдены условия хранения и нет других указаний в НД, то коэффициент поправки проверяют один раз в месяц. В случае изменения титра титрованного раствора в процессе хранения под действием различных факторов окружающей среды (например, реактив Фишера, раствор иодмонохлорида, раствор иода), то согласно НД каждый раз перед применением заново определяют его титр (реактив Фишера) или параллельно проводят контрольный опыт на титрованный раствор.
Поправочный коэффициент согласно ГФ должен укладываться в интервал 0,9–1,1(т.е. отличаться от заданной концентрации не более чемна ±10%). В случаях, когда значения поправочных коэффициентов не укладываются в указанные пределы, растворы необходимо укрепить или разбавить.
Для РАЗБАВЛЕНИЯ титрованных растворов (поправочный коэффициент К больше 1,1) нужно добавить растворитель, рассчитав его объем по формуле:
V, мл = (К — 1,0) · (W – Wi) ; (8)
где V – объем растворителя, который нужно добавить для доведения поправочного коэффициента (К) до нормы, мл; W – заданный для приготовления объем титрованного раствора, мл; Wi – объем приготовленного титрованного раствора, израсходованный при установлении концентрации, мл.
Результат умножения соответствует количеству растворителя в мл, которое нужно прибавить к приготовленному раствору для доведения поправочного коэффициента (К) до требуемого значения.
ПРИМЕР:Поправочный коэффициент 500 мл 0,1 М раствора натрия гидроксида равен 1,15. Приведите расчет доведения поправочного коэффициента (К) до нормы.
РЕШЕНИЕ: Так как поправочный коэффициент (К) больше 1,10, то раствор следует разбавить, добавив воду в количестве:
(1,15 — 1,0) ·500 = 75 (мл).
ЗАКЛЮЧЕНИЕ: Раствор следует разбавить, добавив 75 мл воды.
Для УКРЕПЛЕНИЯ титрованного раствора (поправочный коэффициент К меньше 0,9) нужно добавить вещество, рассчитав его количество по формуле:
а, г = (1,0 – К) · m; (11)
где а– количество вещества, которое нужно добавить для доведения поправочного коэффициента до нормы, г; m– навеска вещества, взятая для приготовления заданного объема титрованного раствора, г.
ПРИМЕР:2000 мл 0,1 М раствора натрия гидроксида (Mr 40,0) приготовлены из навески массой 8,0 г (m). Поправочный коэффициент полученного раствора равен 0,85 (К). Приведите расчет доведения поправочного коэффициента (К) до нормы.
РЕШЕНИЕ: Раствор следует укрепить (поправочный коэффициент (К) меньше 1,0), добавив натрия гидроксид в количестве:
а, г = (1,0 – К) · m = (1,0 — 0,85) · 8 = 1,2.
ЗАКЛЮЧЕНИЕ: Раствор следует укрепить, добавив 1,2 г натрия гидроксида.
После добавления рассчитанного количества растворителя или исходного вещества проводят повторное (трехкратное) определение поправочного коэффициента. При соответствии поправочного коэффициента (К) требованиям ГФ титрованный раствор готов к употреблению.
Титрованные растворы, более разбавленные, чем представленные в ОФС «Титрованные растворы» (0,05; 0,02; 0,01; 0,001М), готовят непосредственно перед использованием путем разведения водой, свободной от углерода диоксида. При этом поправочные коэффициенты титрованных растворов для кислотно-основного и осадительного титрования, полученных путем разбавления более концентрированных исходных титрованных растворов, используют такие же, как и у исходных растворов.
Поправочные коэффициенты титрованных растворов для окислительно-восстановительного титрования, полученных путем разбавления более концентрированных исходных титрованных растворов, устанавливают заново.
Титрованные растворы готовят и хранят в стеклянных бутылках, склянках с тубусом, растворы щелочей – в полиэтиленовых бутылках, плотно закрытых пробками. Склянки с тубусом или бутыли для титрованных растворов светочувствительных веществ должны быть темного стекла или окрашены черным лаком.
Титрованные растворы следует тщательно оберегать от потери влаги и от разбавления водой, так как при этом изменяется их титр. Титрованные растворы хранят в помещениях при комнатной температуре в местах, защищенных от попадания прямых солнечных лучей, возможно дальше от источников тепла. При необходимости титрованные растворы защищают от воздействия углерода диоксида и влаги воздуха. При появлении капель испарившейся жидкости в верхней части бутылей с титрованным раствором бутыли необходимо тщательно взболтать. Титрованные растворы, в которых при хранении появились хлопья или осадок, применять нельзя.
На склянках с титрованными растворами должно быть указано название раствора, заданная молярная концентрация, коэффициент поправки, применяемый индикатор, дата (число, месяц, год) и температура установления поправочного коэффициента. Согласно ГОСТу допускается вместо заданной молярной концентрации и коэффициента поправки указывать значение точной молярной концентрации с четырьмя значащими цифрами после запятой.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник





