- Правило Хунда: в чём оно заключается, примеры, формулировка
- Содержание:
- Пример доказательства правила Хунда
- Последствия правила Гунда
- ХУНДА ПРАВИЛО
- Полезное
- Смотреть что такое «ХУНДА ПРАВИЛО» в других словарях:
- хунда
- См. также в других словарях:
- ХУНДА ПРАВИЛА
- Полезное
- Смотреть что такое «ХУНДА ПРАВИЛА» в других словарях:
Правило Хунда: в чём оно заключается, примеры, формулировка
Содержание:
Фридрих Хунд (в некоторых источниках Гунд) – немецкий ученый, внесший вклад в развитие атомной физики. Большую часть жизни посвятил квантовой механике, спектроскопии. Он создатель более 250 научных статей.
В 1927 г. ученый в области химии Фридрих Хунд сформулировал правило, которое отражает порядок заполнения орбиталей. Это открытие позволило разгадать многие загадки нашей планеты. Формулировка правила Гунда: электроны в ячейках располагаются таким образом, чтобы суммарный спин был максимальным.
Пример доказательства правила Хунда
Орбиталь в химии обозначается в виде пустого квадрата ◻. В нем могут располагаться электроны, которые рисуют в виде стрелок вверх ↑ или вниз ↓. На заполненной орбитали находится два электрона .
В принципе Гунда центральное место занимает спиновое квантовое число (направление стрелок в ячейке). Стрелке вверх соответствует спин +1/2, а стрелке вниз — -1/2. Каждый атом сначала стремится обладать максимальным спином, т. е. первым в ячейку входит электрон со спином +1/2. Поэтому при записи атомной орбитали по правилу Хунда в ячейках первый электрон обозначается стрелкой вверх.
Например, в атоме на р-орбитали располагаются три электрона. Для р-орбитали характерно три ячейки. Электроны могут располагаться разными способами:
Чтобы определить, какой из вариантов верен, необходимо посчитать магнитное спиновое квантовое число для каждого случая.
Т. о. исходя из максимальной суммы спинов, верен последний вариант.
Последствия правила Гунда
Явление ферромагнетизма железа, кобальта, никеля – следствие закона Гунда. 3d-подоболочки этих химических элементов заполнены только частично. В данной ситуации спиновые магнитные моменты не компенсируются. В железе из шести 3d-электронов пять обладают параллельными спинами. У каждого атома железа суммарный спиновой момент большой.
Из-за того что внутри атома электроны отталкиваются и возникло правило Гунда. В итоге энергия атома уменьшается с увеличением расстояния между электронами. Для электронов из одной подоболочки характерны одинаковые направления спинов и различные величины магнитного квантового числа. Поэтому они определяются волновыми функциями с отличными распределениями в пространстве. Электроны с параллельными спинами находятся на большом расстоянии друг от друга, по сравнению со спаренными электронами. Такая конфигурация имеет меньшую энергию и, значит, является более устойчивой.
Источник
ХУНДА ПРАВИЛО
— правило для нахождения самых глубоких уровней энергии, соответствующих определённой э л е к т р о н н о й к о н ф и г у р а ц и и атома при н о р м а л ь-н о й с в я з и спиновых и орбитальных моментов образующих эти конфигурации электронов, когда уровни энергии характеризуются квантовыми числами S, L (см. Атом, Атомные спектры). В случае нормальной связи моментов (см. Связь векторная )при заданном квантовом числе S полного спинового момента атома и при заданном квантовом числе полного орбитального момента атома L получается с п е к т р а л ь н ы й т е р м 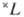
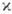
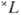
Согласно X. п., эмпирически установленному в 1925 Ф. Хундом (F. Hund), самый глубокий терм, соответствующий рассматриваемой электронной конфигурации, обладает наибольшим возможным значением S и наибольшим возможным для данного S значением L. Это правило всегда выполняется для н о р м а л ь н ы х э л е к т р о н н ы х к о н ф и г у р а ц и й, соответствующих наиб. прочной связи всех электронов и состоящих из эквивалентных электронов, и полностью подтверждается квантовомеханич. расчётами. Напр., для конфигурации р 2 получаются (при учёте Паули принципа )термы 1 S, 1 D, 3 Р, а для конфигурации d 2 — термы 1 S, 1 D, 1 G, 3 P, 3 F; в первом случае самый глубокий терм, согласно X. п., 3 Р, во втором — 3 F.
Для данного терма 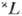
X. п. в сочетании с правилом нахождения наиб. глубокого уровня энергии для нормальных и обращённых мультиплетных термов (это правило иногда ошибочно наз. вторым X. п.) позволяет определить для нормальной конфигурации атома самый глубокий (основной) уровень энергии в тех случаях, когда в атоме частично заполнена наиб. слабо связанными электронами одна оболочка типа пр 6 , nd 10 или nf 14 (при наличии в атоме лишь полностью укомплектованных электронных оболочек осн. уровнем атома является уровень 1 S 0 , а при наличии одного внеш. электрона ns — уровень 2 S l/2 ). Ниже приведены самые глубокие уровни энергии 
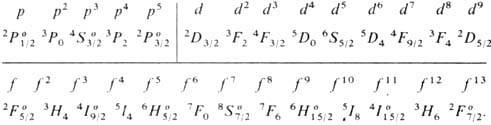
Отметим, что особенно глубоко (по сравнению с уровнями меньшей мультиплетности) лежат уровни 4 S 3/2 , 6 S 5/2 и 8 S 7/2 для оболочек p 6 , d 10 и f 14 , заполненных как раз наполовину, т. е. для конфигураций р 3 , d 5 и f 7 .
Лит.:Hund F., Linienspektren und periodisches System der Eie-mente, В., 1927; Ландау Л. Д., Лифшиц Е. М., Квантовая механика. Нерелятивистская теория, 4 изд., М., 1989; Ельяшевич М. А., Спектры редких земель, М., 1953; его же, Атомная и молекулярная спектроскопия, М., 1962; Собельман И. И., Введение в теорию атомных спектров, 2 изд., М., 1977. М. А. Ельяшевич.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1988 .
Полезное
Смотреть что такое «ХУНДА ПРАВИЛО» в других словарях:
Правило Хунда — определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спинового квантового числа электронов данного подслоя должен быть максимальным. Сформулировано Фридрихом Хундом в 1925… … Википедия
Правило Клечковского — (также Правило n+l; также используется название правило Маделунга) эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах. Правило Клечковского гласит: Заполнение электронами орбиталей в атоме… … Википедия
правило Хунда — Hundo taisyklė statusas T sritis fizika atitikmenys: angl. Hund’s rule vok. Hundsche Regel, f rus. правило Хунда, n pranc. règle de Hund, f … Fizikos terminų žodynas
ХУНДА ПРАВИЛА — приближенные правила, определяющие относит. расположение энергетич. уровней атома. Получены Ф. Хундом в 1927 в результате анализа атомных спектров. Формулировка X. п. предполагает, что состояние многоэлектронного атома можно описать, указав т.… … Химическая энциклопедия
МАГНЕТИЗМ — 1) особая форма вз ствия между электрич. токами, между токами и магнитами (т. е. телами с магнитным моментом) и между магнитами; 2) раздел физики, изучающий это взаимодействие и св ва в в (магнетиков), в к рых оно проявляется. Основные проявления … Физическая энциклопедия
P-элементы (химические) — p элементами называют химические элементы, в атомах которых электрон с наивысшей энергией занимает p орбиталь. p элементами являются: в 1 м периоде нет p элементов во 2 м периоде B Ne в 3 м периоде Al Ar в 4 м периоде Ga Kr в 5 м периоде In Xe в… … Википедия
p-элементы — Для улучшения этой статьи желательно?: Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное. Добавить иллюстрации … Википедия
Принцип Паули — Эта статья о квантовой физике. О сходной по названию шутке научного юмора см. Эффект Паули. Квантовая м … Википедия
МОЛЕКУЛА — (новолат. molecule, уменьшит. от лат. moles масса), наименьшая ч ца в ва, обладающая его осн. хим. св вами и состоящая из атомов, соединённых между собой химическими связями. Число атомов в М. составляет от двух (Н2, О2, HF, KCl) до сотен и тысяч … Физическая энциклопедия
Мнемоника — Содержание 1 Основной метод запоминания в современной мнемонике 2 История … Википедия
Источник
хунда
1 Hund’s rule
2 Hundscher Regel
3 règle d’Hund
4 Hund rule
См. также в других словарях:
ХУНДА ПРАВИЛО — правило для нахождения самых глубоких уровней энергии, соответствующих определённой э л е к т р о н н о й к о н ф и г у р а ц и и атома при н о р м а л ь н о й с в я з и спиновых и орбитальных моментов образующих эти конфигурации электронов,… … Физическая энциклопедия
ХУНДА ПРАВИЛА — приближенные правила, определяющие относит. расположение энергетич. уровней атома. Получены Ф. Хундом в 1927 в результате анализа атомных спектров. Формулировка X. п. предполагает, что состояние многоэлектронного атома можно описать, указав т.… … Химическая энциклопедия
ХУНДА СЛУЧАИ СВЯЗИ — различные случаи связи отд. составляющих полного момента импульса двухатомной молекулы или линейной многоатомной молекулы. Учитываются при расчете энергии молекулы как предельные случаи взаимодействия между электронным и вращат. движениями.… … Химическая энциклопедия
ХУНДА ПРАВИЛА — приближённые правила, определяющие относит. расположение энергетич. уровней атома. 1. Из состояний атома с заданной электронной конфигурацией ниже по энергии те, к рые отвечают ббльшим значением суммарного спина 5. 2. Из состояний атома с… … Естествознание. Энциклопедический словарь
У Хунда — Гарри У (Harry Wu; кит. 吳弘達 Wú Hóngdá, род. 1937, Шанхай) известный китайский диссидент и правозащитник, проведший в китайских лагерях 19 лет. В настоящее время является гражданином США и проживает в Вашингтоне (?). Биография У Хунда… … Википедия
Правило Хунда — определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спинового квантового числа электронов данного подслоя должен быть максимальным. Сформулировано Фридрихом Хундом в 1925… … Википедия
правило Хунда — Hundo taisyklė statusas T sritis fizika atitikmenys: angl. Hund’s rule vok. Hundsche Regel, f rus. правило Хунда, n pranc. règle de Hund, f … Fizikos terminų žodynas
Петро́ва — Хунда́дзе спо́соб — (Б.А. Петров, 1898 1973, советский хирург; Г.Р. Хундадзе, р. 1906 г., советский хирург) способ увеличения подвижности трансплантата при создании искусственного пищевода из тонкой кишки, заключающийся в мобилизации корня брыжейки кишки … Медицинская энциклопедия
Харри Ву — Гарри Ву (Harry Wu; кит. 吳弘達 Wú Hóngdá, род.1937, Шанхай) известный китайский диссидент и правозащитник, проведший в китайских лагерях 19 лет. В настоящее время является гражданином США и проживает в Вашингтоне (?). Биография Ву Хунда родился в… … Википедия
МОЛЕКУЛА — (новолат. molecule, уменьшит. от лат. moles масса), наименьшая ч ца в ва, обладающая его осн. хим. св вами и состоящая из атомов, соединённых между собой химическими связями. Число атомов в М. составляет от двух (Н2, О2, HF, KCl) до сотен и тысяч … Физическая энциклопедия
Метод молекулярных орбиталей — Молекулярная орбиталь пероксида водорода Теория молекулярных орбиталей (МО) дает представление о распределении электронной плотности и объясняет свойства молекул. В этой теории квантово механические зависимости для атома распространены на более… … Википедия
Источник
ХУНДА ПРАВИЛА
приближенные правила, определяющие относит. расположение энергетич. уровней атома. Получены Ф. Хундом в 1927 в результате анализа атомных спектров.
Формулировка X. п. предполагает, что состояние многоэлектронного атома можно описать, указав т. наз. электронную конфигурацию — набор тех состояний, в к-рых находятся отдельные электроны. В общем случае данной электронной конфигурации отвечает неск. разных энергетич. состояний атома. Каждое из них в силу сферич. симметрии атома можно классифицировать по суммарному орбитальному моменту (квантовое число L = 0, 1, 2, . отвечает соотв. состояниям S, Р, D-типов), суммарному спину (квантовое число S) и полному моменту импульса атома как целого (квантовое число J, к-рое при заданных L и S меняется от L + S до |L — S | с шагом 1). Напр., атом С в низших состояниях можно описать электронной конфигурацией Is 2 2s 2 2
2 ; > общее число состояний, отвечающих такой конфигурации, с учетом вырожденности нек-рых уровней равно 15. При стандартном обозначении символом 2S+l Lj состояния атома С — 1 S0, 3 P0, 3 Р 1, 3 Р 2, 1 D2.
Наиб. распространены след. X. п.:
1. Из состояний атома с заданной электронной конфигурацией ниже по энергии те, к-рые отвечают большим значениям S.
2. Из состояния атома с заданной конфигурацией и заданным спином Sниже по энергии те, к-рые отвечают большему значению L.
С X. п. тесно связан важный для теории мол. орбиталей принцип заполнения: из неск. конфигураций молекулы ниже по энергии те, для к-рых сумма значений орбитальных энергий атомов меньше.
X. п. ограничены в осн. низколежащими состояниями атомов при условии, что влияние электронной корреляции (взаимной обусловленности движений электронов) достаточно мало и не нарушает границ применимости одноконфигурационного приближения (см. Конфигурационного взаимодействия метод). Основанием для выполнения первого правила является тесная связь между симметрией пространств. части волнoвой ф-ции атома и симметрией ее спиновой части, существующая согласно Паули принципу. По этой же причине первое X. п. обычно выполняется и для молекул.
Второе X. п. имеет более ограниченную применимость и определяется в осн. тем, насколько значимо межэлектронное отталкивание в анализируемых состояниях. Это правило выполняется иногда и для линейных молекул (при замене Lна модуль проекции момента кол-ва движения на ось молекулы).
Для нек-рых типов состояний удается найти дополнит. правила, отвечающие изменению энергии атома при данной конфигурации и данных L и Sв зависимости от J. Эти правила связаны со спин-орбитальным взаимодействием и др. тонкими эффектами. Напр., если в конфигурации есть лишь одна частично заполненная оболочка, то при заполнении оболочки менее чем на половину («нормальный мультиплет») энергия растет с повышением J. В остальных случаях с ростом J энергия убывает («обращенный мультиплет»). Так, для атома С описанные правила подтверждаются эксперим. значениями энергий возбуждения из основного состояния 3 Р 0: энергия перехода в, состояние 3 Р 1 равна 0,2 кДж/моль, в состояния 3 Р 2 — 0,5, 1 D2 —121,9, 1 S0 —259,0 кДж/моль.
X. п. часто нарушаются, т. к. одноконфигурационные модели атомов и молекул довольно редко бывают надежны. С появлением прецизионных эксперим. данных о спектрах атомов они теряют свое значение.
Лит.: Собельман И. И., Введение в теорию атомных спектров, М., 1977; Абаренков И. В., Братцев В. Ф., Тулуб А. В., Начала квантовой химии, М., 1989.
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Полезное
Смотреть что такое «ХУНДА ПРАВИЛА» в других словарях:
ХУНДА ПРАВИЛА — приближённые правила, определяющие относит. расположение энергетич. уровней атома. 1. Из состояний атома с заданной электронной конфигурацией ниже по энергии те, к рые отвечают ббльшим значением суммарного спина 5. 2. Из состояний атома с… … Естествознание. Энциклопедический словарь
Правило Хунда — определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спинового квантового числа электронов данного подслоя должен быть максимальным. Сформулировано Фридрихом Хундом в 1925… … Википедия
МУЛЬТИПЛEТНОСТЬ — (от лат. multiplex многократный), число квантовых состояний молекулы, различающихся только ориентацией суммарного электронного спина. Для мол. систем, в к рых спин орбитальное взаимодействие пренебрежимо мало, состояния с разл. ориентацией спина… … Химическая энциклопедия
Мнемоника — Содержание 1 Основной метод запоминания в современной мнемонике 2 История … Википедия
Хунд, Фридрих — Фридрих Хунд нем. Friedrich Hund … Википедия
Правило Клечковского — (также Правило n+l; также используется название правило Маделунга) эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах. Правило Клечковского гласит: Заполнение электронами орбиталей в атоме… … Википедия
МОЛЕКУЛЯРНЫЕ СПЕКТРЫ — спектры испускания, поглощения и комбинационного рассеяния света (КРС), принадлежащие свободным или слабо связанным между собой молекулам. Типичные М. с. полосатые, они наблюдаются в виде совокупности более или менее узких полос в УФ, видимой и… … Физическая энциклопедия
МАГНЕТОХИМИЯ — раздел физ. химии, изучающий взаимосвязь между магн. и хим. свойствами веществ. Исторически первым магнетохим. подходом к изучению строения веществ считают известные правила Паскаля (P. Pascal, 1910 13), связывающие магнитную восприимчивость… … Физическая энциклопедия
КОНФИГУРАЦИOННОГО ВЗАИМОДЕЙСТВИЯ МЕТОД — (метод взаимодействия конфигураций), квантовохим. метод приближенного решения ур ния Шрёдингера для многоэлектронной мол. системы в основном и возбужденных состояниях. Основан на адиабатическом приближении и позволяет в принципе находить… … Химическая энциклопедия
Источник


