- Хронический гастрит, ассоциированный с Helicobacter pylori
- Симптомы
- Классификация
- Причины
- Диагностика
- Лечение
- Информационный блок для пациентов
- IX Международная студенческая научная конференция Студенческий научный форум — 2017
- ОСОБЕННОСТИ ТЕЧЕНИЯ HP-АССОЦИИРОВАННЫХ И НЕ АССОЦИИРОВАННЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЖЕЛУДКА И ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ.
- Хронический гастрит ассоциированный с нр что это значит
Хронический гастрит, ассоциированный с Helicobacter pylori
Хронический гастрит, ассоциированный с Helicobacter pylori (Хронический хеликобактерный гастрит) — воспаление слизистой оболочки желудка, возникающее под воздействием бактерии Helicobacter Pylori (хеликобактер пилори).
Helicobacter pylori (Н.pylori) — грамотрицательная микроаэрофильная бактерия, колонизирующая слизистую оболочку желудка и ассоциированная с атрофическим гастритом, язвенной болезнью желудка и двенадцатиперстной кишки, аденокарциномой и экстранодальной В-клеточной MALT-лимфомой желудка.
ИНСТИТУТ АЛЛЕРГОЛОГИИ И КЛИНИЧЕСКОЙ ИММУНОЛОГИИ располагает:
спектром услуг для точной диагностики заболеваний
специальными программами лечения
При выявлении сопутствующих заболеваний проводятся консультации со специалистами смежных областей (оториноларингологи, эндокринологи, неврологи, гастроэнтерологи, дерматовенерологи), консилиумы с Докторами медицинских наук.
Внимание! Helicobacter pylori является провокатором онкологических новообразований в ЖКТ.
Симптомы
- Изжога, отрыжка, тошнота.
- Болевые ощущения в эпигастрии после приема пищи.
- Сухость во рту, горький привкус.
- Снижение аппетита.
- Запоры, диарея.
- Белый налет на языке.
Классификация
Хронический гастрит, вызванный Helicobacter pylori (К29.5)
Причины
Внимание! Helicobacter pylori может передаваться от одного человека другому при нарушениях правил личной гигиены!
Helicobacter pylori продуцируют высокоактивный фермент уреазу, каталазу, муциназу, которые приводят к изменению качественных характеристик желудочного сока. Helicobacter pylori при проникновении в пилорический отдел желудка, в котором присутствует высокое содержание мочевины, создает щелочную среду, превращая мочевину в аммиак, что приводит к запуску механизма патогенеза инфекции: деструктивные процессы на молекулярном, клеточном и тканевом уровне, цитотоксические эффекты, нарушение секреции, компенсаторные реакции желез, интенсивную воспалительную реакцию с преобладанием нейтрофильной инфильтрации и большим числом в слизистой оболочке плазматических клеток, продуцирующих IgA.
- Нарушение режима питания и неправильное питание.
- Курение.
- Алкоголизм.
- Психологически тяжелые, стрессовые состояния.
Диагностика
ИНСТИТУТ АЛЛЕРГОЛОГИИ И КЛИНИЧЕСКОЙ ИММУНОЛОГИИ располагает фундаментальной базой, позволяющей провести весь комплекс диагностических и лечебных мероприятий, соответствующих уровню международных стандартов. Многие из лечебно-диагностических методов разработаны сотрудниками нашего Института.
Диагноз устанавливается на основании клинической картины и анамнеза пациента, физикального исследования, лабораторной диагностики, эндоскопии (гастроскопия) и др. исследований.
При необходимости консультативную помощь Вам могут оказать смежные специалисты, опытные врачи, разрабатывающие новые методы диагностики и лечения в этих направлениях медицины.
Уреазный дыхательный тест — самый инновационный и точный анализ на Helicobacter pylori! Лучший метод контроля качества лечения!
Принцип действия основан на способности Хеликобактера пилори разлагать мочевину на аммиак и углекислый газ. Обследование на концентрацию аммиака в выдыхаемом воздухе позволяет определить наличие бактерий в вашем организме.
Уреазный дыхательный тест широко используется:
- для первичной диагностики;
- оценки хода антихеликобактерной терапии;
- проверки эффективности уже проведенной терапии.
Уреазный дыхательный тест безвреден!
Методы диагностики инфекции H.pylori делятся на инвазивные, требующие проведения эндоскопического исследования, и неинвазивные. Объем и методы диагностики определяет врач-гастроэнтеролог.
- Общий анализ крови.
- Эндоскопия (фиброгастроскопия)
- УЗИ органов брюшной полости.
- Дыхательный тест (уреазный тест).
- Анализ секреторной функции.
- Биопсия и гистологический анализ тканей.
- Серологическое исследование крови.
- Иммуноферментный анализ кала.
Лечение
Лечение направлено на достижение ремиссии заболевания и предупреждение дальнейшего прогрессирования атрофии и развития осложнений
- Антацидные препараты (для нормализации кислотности желудочного сока).
- Гастропротекторы (препараты, защищающие (обволакивающие) слизистую оболочку).
- Противомикробные препараты.
- Прокинетические препараты.
- Индивидуальный подбор диеты.
Подбор лекарственной терапии должен производиться индивидуально с учетом тяжести течения заболевания, наличия сопутствующих заболеваний, возраста пациента и риска возможных побочных эффектов.
Просим Вас не заниматься самолечением на основании данных сети Интернет!
Информационный блок для пациентов
- Отказ от нездоровых привычек.
- Соблюдение диеты.
- Своевременная диагностика и лечение инфекционных заболеваний.
- Мероприятия по восстановлению иммунитета.
Диета при хроническом гастрите
Данная диета носит рекомендательный характер, подбор диеты должен производиться индивидуально!
Продукты, которые можно включать в рацион питания:
- супы (овощные, крупяные, молочные)
- отварное нежирное мясо и рыба
- яйцо всмятку, паровой омлет
- свежий некислый творог, сыры
- подсушенный пшеничный хлеб
- несдобное печенье
- хорошо разваренные каши
- вермишель и лапша из белой муки
- пюре овощные
- салаты, винегреты, заправленные растительным маслом
- некислые фруктово-ягодные соки с мякотью
- молоко и молочные продукты (ряженка, йогурты)
- щелочные минеральные воды без углекислоты.
- некрепкий чай
Продукты, которые рекомендуется исключить из рациона питания:
- сокогонные продукты и блюда (мясные, рыбные, грибные бульоны)
- продукты с соединительной тканью (хрящи, кожа птицы и рыбы, жилистое мясо)
- жирные сорта мяса и рыб;
- консервированные продукты;
- свежий хлеб, изделия из теста, из муки грубого помола, пшено
- блины, пироги, пирожные;
- овощи, содержащие грубую клетчатку (горох, фасоль, бобы, репа), грибы;
- незрелые и фрукты и ягоды с грубой кожицей
- кислые фруктово-ягодные соки
- продукты на основе какао-масла или какао-бобов (шоколад), крепкий чай, газированные напитки.
Источник
IX Международная студенческая научная конференция Студенческий научный форум — 2017
ОСОБЕННОСТИ ТЕЧЕНИЯ HP-АССОЦИИРОВАННЫХ И НЕ АССОЦИИРОВАННЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЖЕЛУДКА И ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ.
Заболевания желудочно-кишечного тракта представляют серьезную медицинскую и социально-экономическую проблему.
По статистике ФГБУ «Центрального научно-исследовательского института организации и информатизации здравоохранения» Минздрава России за 2013 – 2014 годы зарегистрировано 982 713 детей (0-14 лет) с заболеваниями ЖКТ. Превалирующее большинство составили такие болезни, как гастрит и гастродуоденит (961 708 детей).
В Пермском крае за 2013 – 2014 годы зарегистрировано 23 045 детей с патологией ЖКТ, 22 574 из них с заболеваниями — гастрит и гастродуоденит (ГД).
По данным различных авторов, частота встречаемости HP-не ассоциированных хронических гастритов в развитых станах равна 10%, что значительно уступает количеству инфицированных HP пациентов (до 75%).В связи с выше изложенным, изучение данной проблемы является весьма актуальной в настоящее время.
Цель исследования
Изучить особенности проявления гастритов и гастродуоденитов в зависимости от наличия инфицированности HP.
Материалы и этапы исследованияИсследование было выполнено в ГДКБ № 9 им. П.И.Пичугина. Все пациенты проходили обследование и лечение в соматическом отделении за период с 03.2016 – 05.2016.Первым этапом исследования являлось анкетирование, по специально разработанной анкете, содержащей данные об условиях жизни, питании, перенесенных заболеваниях, особенностях наследственности.На втором этапе – изучение особенностей анамнеза и объективного статуса.На завершающем этапе – сравнение анкетных данных, особенностей клиники, объективного статуса и разультатов параклинических данных у двух групп пациентов (1 группа – с наличием НР-инфекции, 2 гркппа – без НР-инфекции).
Полученные результатыКак видно из рисунка 1, хронические заболевания желудка и ДПК чаще всего встречаются в школьном возрасте: 18% в младшем школьном возрасте и 27% в старшем школьном возрасте, что соответствует литературным данным.
Рис.1 Распределение пациентов по половому и возрастному признаку (%).
При оценке предрасполагающих факторов риска внутри обследованных групп показал, что у пациентов с НР – положительными результатами исследования выступают: скученное проживание семьи, низкий социальный уровень, отягощенная наследственность и наличие НР-инфицирования у других членов семьи, а так же несоблюдение принципов рационального питания.У пациентов с отрицательными результатами исследования на НР ведущую роль в возникновении патологии играет нерациональное питание и стрессовые факторы.
Рис.2 Предрасполагающие факторы к возникновению гастритов/ГД (%)
Особенности клинической картины показали, что ведущими жалобами у пациентов были боли и диспептические расстройства. Характеристика болевого абдоминального синдрома представлена в таблице № 1.
Как следует из таблицы № 1, у пациентов 1-ой группы боль носила ноющий характер (22%), локализовалась преимущественно в мезогастрии (28%) и не была связана с приемом пищи (40%). У пациентов 2-ой группы боль так же не была связана приема пищи (54%). Характер боли был различным – тянущая (28%), ноющая (20%) и режущая (6%). Локализация боли наблюдалась чаще всего, в эпигастрии (22%) и правом подреберье (20%).
Таблица № 1Характеристика болевого абдоминального синдрома (абс.)
Симптомы
Группы обследованныхдетей
Источник
Хронический гастрит ассоциированный с нр что это значит
Хронический гастрит является наиболее распространенным заболеванием и занимает одно из первых мест в структуре заболеваний тракта. По оценке различных авторов, он встречается у 50–80% населения нашей страны [1, 2]. Открытие Н.pylori австралийскими учеными и в 1983 году явилось поистине революционным и вызвало невероятный прогресс в гастроэнтерологии. Современным интернистам это принесло «понимание того, что микроорганизм H.pylori является важным участником формирования таких патологических состояний, как острый и хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки, рак и желудка» [3] и позволило выйти на разработку новых, более эффективных этиопатогенетических принципов лечения и профилактики этих заболеваний.
Helicobacter pylori (Н.pylori) — грамотрицательная микроаэрофильная бактерия, колонизирующая слизистую оболочку желудка и ассоциированная с атрофическим гастритом, язвенной болезнью желудка и двенадцатиперстной кишки, аденокарциномой и экстранодальной желудка. H.pylori является одним из самых распространенных возбудителей инфекционных заболеваний. Согласно некоторым оценкам, более половины населения мира инфицированы этим микроорганизмом. Инфекция H.pylori часто не имеет клинических проявлений. Только у определенной части инфицированных с течением времени развивается хронический атрофический гастрит и рак желудка. В 2005 году первооткрыватели бактерии — Робин Уоррен (Robin Warren) и Барри Маршал (Barry Marshall) — были удостоены Нобелевской премии по физиологии и медицине «за открытие бактерии Helicobacter pylori и ее роли в развитии гастрита и язвы желудка». Интенсивное изучение H.pylori показало, что у 80% больных, страдающих раком желудка, в анамнезе была зафиксирована инфекция H. pylori. Это явилось одной из причин, по которым в 1995 году Международная ассоциация по изучению рака (IARC, ВОЗ) признала H.pylori канцерогеном I класса.
Новые европейские рекомендации по инфекции H.pylori, представленные на очередном XXIV заседании Международной рабочей группы по изучению Helicobacter pylori и родственным бактериям при хронических воспалительных процессах пищеварительного тракта и раке желудка (XXIVth International Workshop on Helicobacter and related bacteria in chronic digestive inflammation and gastric cancer) 11–13 cентября 2011 года, были посвящены не только новым подходам к терапии, но и современным методам диагностики инфекции Н.pylori. Эти методы делятся на инвазивные и неинвазивные. Все инвазивные методы диагностики предусматривают проведение эндоскопического исследования с забором биопсийного материала — биоптатов слизистой оболочки желудка. Эндоскопическое исследование является одним из самых важных методов оценки слизистой оболочки желудка у пациентов с H.pylori ассоциированной патологией. Применение узкоспектральной эндоскопии в комбинации с оптическим увеличением изображения позволяет дифференцировать патологические изменения, которые при обычной эндоскопии не могут быть выявлены. Неинвазивные методы — это различного рода иммунологические исследования, позволяющие определять наличие антител в сыворотке крови или бактериального антигена Н.pylori в фекалиях, ПЦР исследование с определением ДНК Н.pylori в фекалиях и уреазный дыхательный тест с С13 или С14 меченным атомом углерода.
История открытия Helicobacter pylori
Впервые идея об инфекционном развитии гастрита возникла в конце ХХ века, когда в желудке животных были найдены спиралевидные бактерии. В 1893 году G. Bizzozero выявил спиралевидные бактерии в париетальных клетках желудка собак. В 1896 году H. Salomon установил, что эти бактерии могут передаваться от зараженных мышей кошкам и собакам. Первые описания спиралевидных бактерий в желудке человека принадлежат W. Krienitz (1906) и A. Luger (1917), которые обнаружили их на изъязвившейся карциноме желудка. Дальнейшие исследования проводились на операционном и биопсийном материалах. L. Barron обнаружили «спирохеты» в 37% случаев в желудках, резецированных по поводу язвенной болезни и карциномы. В 1940–1954 годах S. Freedberg и описали спиралевидные бактерии и их локализацию на большом гастробиопсийном материале, в том числе у больных раком желудка. Более подробное описание бактерий желудка человека в биоптатах больных с хроническим гастритом и язвенной болезнью было опубликовано в 1975 и 1979 годах в работах и , которые не только выявили спиралевидные бактерии, но и указали на признаки воспаления слизистой оболочки желудка в участках их колонизации [4]. Таким образом, к началу годов прошлого столетия появились доказательства, указывающие на инфекционную природу хронического гастрита. В период с 1979 по 1981 годы австралийский патологоанатом , изучающий биопсийный материал с морфологическими признаками активного гастрита, обнаружил спиралевидные бактерии, похожие на Campylobacter jejuni, и назвал их организмы. После чего гастроэнтеролог , сопоставив клинические данные и морфологические изменения слизистой оболочки желудка, высказал предположение, что этот микроорганизм может являться причиной развития активного гастрита у людей. Свою гипотезу в последующем он подтвердил, выпив чистую культуру этого микроорганизма. В 1982 году и удается из биопсийного материала, взятого из пилорического отдела желудка человека с активным гастритом, культивировать на стандартной кампилобактерной среде бактерии, которые по своим морфологическим и биохимическим свойствам были похожи на бактерии рода Campylobacter. Выделенный микроорганизм был назван Campylobacter pyloridis. Свои результаты и впервые доложили на II международном рабочем совещании по изучению кампилобактерной инфекции в Брюсселе и в том же 1983 году опубликовали в журнале Lancet [5]. В 1989 году и группа ученых окончательно идентифицировали бактерию, дав ей название Helicobacter pylori [6]., а в 1998 году был полностью расшифрован ее геном. Таким образом, в 1983 году была открыта новая страница в изучении этиопатогенетических механизмов развития хронических воспалительных процессов СОЖ и подтверждена правильность инфекционной теории развития гастрита. Активизировались исследования вокруг этой проблемы в различных областях медицины — патоморфологии, гастроэнтерологии, микробиологии, иммунологии, генетики, эпидемиологии и фармакологии. Изучение патогенных свойств H.pylori привело к переосмыслению взглядов на патогенез и принципы лечения не только хронического гастрита и язвенной болезни, но и аденокарциномы и экстранодальной . Была установлена прямая зависимость клинической манифестации и частоты рецидивирования хронического гастрита, язвенной болезни и степени обсемененности H.pylori слизистой оболочки, а также возникло понимание взаимосвязи предраковых состояний слизистой оболочки желудка и инфицированности H.pylori. По оценке известного эпидемиолога D. Forman, до 75% случаев рака желудка в развитых странах и около 90% в развивающихся странах может быть связано с инфекцией H.pylori [7]. В 1994 году Международное агентство по изучению рака отнесло хеликобактерную инфекцию к канцерогенам первого порядка [8]. Многочисленные эпидемиологические исследования выявили широкое распространение инфекции H.pylori, в настоящее время инфицированы более половины населения в мире [9]. Анализ распределения эпидемиологических особенностей рака желудка и распространенности инфекции в различных регионах мира показывает связь между смертностью от рака желудка, инфицированностью населения H.pylori, тяжестью условий жизни. В целом риск заболеть раком желудка при длительной персистенции инфекции может возрасти до 4–6 раз (табл. 1) [10, 11].
Таблица 1. Распространенность инфекции H.pylori и смертность от рака желудка в странах с различным уровнем
| Страна | Инфицированность H. pylori, % | Смертность (рак желудка) |
| Китай Россия и Япония | 80-100 60-80 | Более 30 человек на 100 000 населения |
| Алжир Коста-Рика Кот-Дивуар Нигерия Чили Эквадор | 75-95 | Более 30 человек на 100 000 населения |
| Австралия Бельгия Великобритания Израиль Канада Новая Зеландия США Франция | 4 5 9 15 13,6 5 23 20 | Менее 10 человек на 100 000 населения |
Приведенные данные свидетельствуют о более высокой заболеваемости раком желудка в тех регионах, где выше показатели заболеваемости H.pylori ассоциированным гастритом.
Современные методы лабораторной диагностики инфекции Helicobacter pylori
С момента открытия Н.pylori прошло чуть более тридцати лет. За этот период времени было разработано большое количество методов лабораторной диагностики, позволяющих выявлять и идентифицировать этот микроорганизм. Однако в настоящее время ни один из существующих методов лабораторной диагностики инфекции Н.pylori не универсален. Пределы возможностей этих методов могут быть ограничены не только их чувствительностью, но, зачастую, зависят от возраста пациента, его индивидуальных особенностей, стадии заболевания, а также индивидуальных особенностей течения инфекции. Все существующие на сегодняшний день методы лабораторной диагностики инфекции Н.pylori делятся на две большие группы: инвазивные и неинвазивные методы (табл. 2).
Таблица 2. Методы лабораторной диагностики инфекции Н.pylori
| Инвазивные методы | Неинвазивные методы |
| Бактериологический метод Гистологический метод Молекулярно-биологический метод (ПЦР) Фазово-контрастная микроскопия Быстрый Уреазный тест | Серологический метод Молекулярно-биологический метод (ПЦР) Уреазный дыхательный тест |
Принципиальное значение для практики имеет проведение диагностики Н.pylori инфекции до лечения (первичная диагностика), и после проведения противохеликобактерной терапии (контроль эффективности выбранной схемы лечения). Первичная диагностика Н.pylori инфекции должна осуществляться методами, непосредственно выявляющими бактерию или продукты ее жизнедеятельности в организме больного. Таким требованиям удовлетворяют следующие методы диагностики:
1. Бактериологический метод — посев биоптата слизистой оболочки желудка или двенадцатиперстной кишки на среду с целью выделения чистой культуры Н.pylori.
2. Дыхательный тест — определение в выдыхаемом больным воздухе изотопов С13 или С14, которые выделяются в результате расщепления в желудке больного меченой мочевины под действием фермента уреазы Н.pylori.
3. Быстрый Уреазный тест — определение уреазной активности в биоптате слизистой оболочки желудка или двенадцатиперстной кишки путем помещения его в жидкую или гелеобразную среду, содержащую субстрат, буфер и индикатор.
4. Гистологический метод — золотой стандарт диагностики Н.pylori инфекции и хронического гастрита.
Бактериологический метод является единственным методом исследования, обладающим 100% специфичностью. Он позволяет выделить чистую культуру Н.pylori, провести ее идентификацию, изучить морфологические, биохимические и биологические свойства бактерий. В эпидемиологической практике выделение чистой культуры Н.pylori необходимо для внутривидового типирования штаммов, что может быть использовано при мониторинге для дифференциации между реинфекцией новым штаммом и рецидивированием инфекции, которое может быть обусловлено тем же штаммом. В научной практике бактериологический метод важен, так как позволяет изучать факторы патогенности Н.pylori и изготовлять препараты для серологической диагностики. Как и любой метод диагностики, бактериологический метод исследования обладает не только достоинствами, но и недостатками, которые зачастую ограничивают его широкое использование в клинической практике. К недостаткам этого метода относятся, прежде всего, необходимость специального лабораторного оборудования, реактивов, специальных питательных сред, а также обученных специалистов. Все это сопряжено с большими материальными затратами. Результаты бактериологического исследования отсрочены от момента взятия биопсийного материала минимум на 3–5 дней, а при необходимости получения данных о чувствительности Н.pylori к антибактериальным препаратам длительность исследования увеличивается и составляет в среднем 6–7 дней. Кроме того, для проведения бактериологического исследования необходимо проведение эзофагогастродуоденоскопии с забором биопсийного материала.
Уреазный дыхательный тест (УДТ) основан на способности уреазы разлагать мочевину до НСО3I и NH4+. Из НСО3I образуется СО2, который попадая в кровоток затем транспортируется в легкие. Для проведения УДТ необходима мочевина, меченная радиоактивным углеродом 13С или 14С. Чаще в клинической практике используется нерадиоактивный стабильный углерод 13С. 14С используется реже, так как является источником излучения низкоэнергетических β-частиц, которые обнаруживаются сцинтиляционным счетчиком. Изотоп количественно определяют газовым спектрометром. В начале исследования берутся две фоновые пробы выдыхаемого воздуха. Далее пациент съедает легкий завтрак и тестовый субстрат и в течение одного часа, с интервалом в 15 минут у него берут по четыре пробы выдыхаемого воздуха. Уровень радиоактивного изотопа в выдыхаемом воздухе определяется в течение 10–30 минут. Затем пробирки направляются на . Результат выражается как приращение 13СО2 — д13СО2, его экскреция (%о) и считается положительным при значениях выше 5%о. В ряде стран используется определение изотопического отношения концентраций 13СО2/12СО2, что позволяет свести к минимуму влияние на конечный результат методических и инструментальных погрешностей.
Быстрый урезаный тест основан на определении в биоптате слизистой оболочки желудка местной уреазной активности H.pylori. Быстрота изменения окраски индикатора (с желтого цвета на красный или малиновый) зависит от уреазной активности, которая в свою очередь зависит от количества бактерий. К недостаткам теста относится его инвазивность, невозможность морфологической оценки состояния слизистой оболочки желудка, а также получение ложноотрицательных (при малом количестве микробных тел) или ложноположительных результатов (контаминирование материала другими уреазопродуцентами, например H.heilmannii — спиралевидной бактерии рода Helicobacter, которую возможно обнаружить у 0,25% пациентов при проведении гастроскопии [12]).
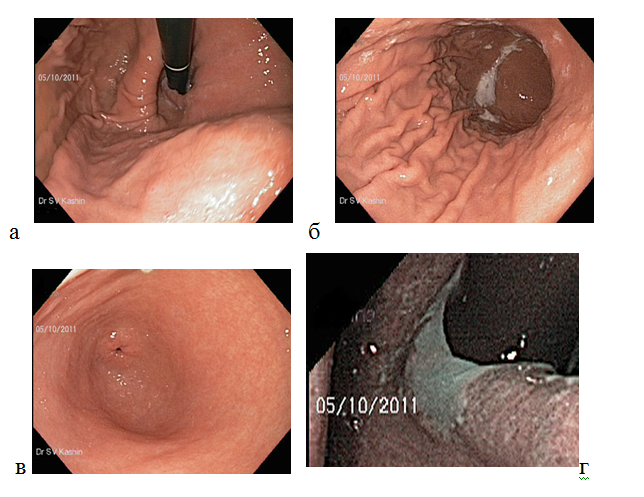
Гистологический метод — золотой стандарт диагностики инфекции H.pylori, который является наиболее объективным методом, так как позволяет обнаружить возбудитель инфекции, определить положение бактериальных тел в слизи, покрывающей слизистую оболочку желудка, наблюдать взаимоотношение Н.pylori с апикальной мембраной эпителиоцитов, а также определить пути взаимодействия бактерии с тканями макроорганизма (рис. 2). Забор биопсийного материала производится из зон слизистой оболочки желудка с признаками наиболее активного воспалительного процесса (максимально выраженная гиперемия и отeк). Биопсия и забор материала для диагностики инфекции из области дна язв и эрозий, а также из их краев, является ошибкой, так как в них нет эпителиальных клеток, обладающих свойствами, необходимыми для адгезии и колонизации Н.pylori. Поскольку бактерии Н.pylori могут быть распределены неравномерно в различных отделах желудка, для повышения чувствительности метода, а также для оценки состояния слизистой оболочки и определения типа и локализации гастрита, степени его выраженности биоптаты целесообразно брать из антрального, фундального отделов, а также области угла желудка (рис. 1).
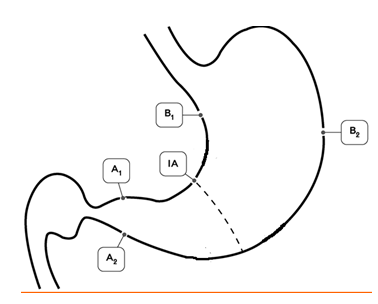
Рисунок 1. Схема выполнения биопсии слизистой оболочки желудка с целью достоверной диагностики инфекции H.Pylori и гастрита в пяти зонах желудка: две биопсии — в антральном отделе (А1 и А2), две биопсии — в теле желудка (В1 и В2) и одна биопсия в зоне угла желудка (IА).
Рисунок 2. Диагностика инфекции Н.pylori при окраске гистологического препарата красителем акридиновым оранжевым, бактерии определяются в виде мелких, слегка извитых палочек, находящихся в слое слизи над поверхностью эпителия желудка в непосредственной близости от слизистой оболочки желудка и на поверхности эпителиальных клеток.
Классификация количественной и качественной оценки инфекции H. pylori, степени воспаления при гастрите, атрофии и кишечной метаплазии была предложена в Сиднейской системе и ее Хьюстонской модификации, однако эта система не позволяла оценивать прогноз повреждения. Современная классификация и оценка степени и стадии гастрита OLGA (Operative Link for Gastritis Assessment) основана на оценке стадийности и степени выраженности атрофического гастрита в фундальном и антральном отделах желудка [13, 14]. Под степенью гастрита понимается выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией — выраженность атрофии. Чем выше выраженность атрофии и больше объем поражения слизистой оболочки желудка, тем выше риск развития неоплазии. Таким образом, новая система определения стадии гастрита OLGA обеспечивает определение прогноза развития предраковых изменений, позволяет клиницисту получить представление о распространенности повреждения слизистой оболочки желудка и степени риска развития рака желудка [15, 16].
Цитологический метод применяется преимущественно в России. Метод основан на выявлении бактериальных тел в биоптатов слизистой оболочки желудка. Мазки окрашиваются по методу . Бактерии располагаются в слизи, имеют спиралевидную или формы. Помимо Н.pylori при цитологическом исследовании выявляется также клеточная инфильтрация, представленная лимфоцитами, нейтрофилами, плазматическими клетками и эозинофилами. По преобладанию тех или иных клеток можно приблизительно судить об активности и выраженности воспаления. Цитологическое исследование позволяет выявить наличие пролиферативных процессов, метаплазии и дисплазии, а также оценить степень их выраженности. Можно обнаружить и неопластические изменения, однако определить глубину инвазии невозможно. Метод эффективен при правильной подготовке цитологического препарата и взятии материала из нескольких участков желудка. Чувствительность метода составляет порядка 15%.
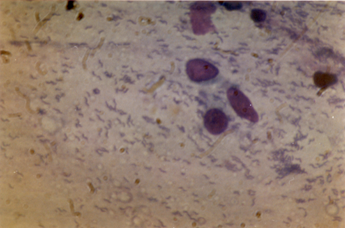
Рисунок 3. Цитологическая диагностика H.pylori инфекции: множественные бактерии спиралевидной формы определяются в при окраске по .
В последние годы в клинической практике начал использоваться серологический скрининг заболеваний желудка, включающий определение в сыворотке крови антител класса G к H.pylori (.pylori IgG), пепсиногена I (РG1) и гастрина 17 (G17). Анти- H.pylori IgG являются наилучшим маркером наличия гастрита и обладают высокой чувствительностью и низкой специфичностью в диагностике атрофического гастрита. РG1 и G17 указывают на наличие атрофического гастрита с высокой специфичностью и низкой чувствительностью. Комбинация этих трех тестов (Гастропанель, Биохит, Финляндия) обладает высокой чувствительностью (83%) и специфичностью (95%) в диагностике атрофического гастрита [17]. В проведенном на базе Ярославской областной клинической онкологической больницы и Медицинском центре диагностики и профилактики (г. Ярославль) исследовании, заключавшемся в определении у больных ранним раком желудка и мультифокальным атрофическим гастритом, была обнаружена функциональная недостаточность слизистой оболочки тела желудка (низкий уровень PG1), полученные значения PG1 в этих группах пациентов были достоверно ниже по сравнению с группами больных антральным атрофическим и неатрофическим гастритами. Это свидетельствует о том, что сывороточный PG1 может рассматриваться в качестве маркера риска развития рака желудка. При атрофии антрального отдела желудка происходит снижение выработки постпрандиального G17. Серологический метод с определением G17, РG1 и анти H. pylori IgG может служить методом скрининга атрофического гастрита и рака желудка в крупнопопуляционных исследованиях ввиду его очевидных преимуществ — удобства и безопасности для пациента наряду с высокой эффективностью. Использование серологического теста для выявления предопухолевой патологии и рака желудка на ранних стадиях может способствовать улучшению своевременной диагностики данной патологии, что в итоге должно положительным образом сказаться на уровне заболеваемости и смертности [18].
Генотипирование Helicobacter pylori
Несмотря на высокий процент инфицирования населения H.pylori, подавляющее большинство инфицированных лиц не имеют клинических проявлений на момент диагностики, но они, тем не менее, представляют собой группу риска, в которой с течением времени развивается хронический гастрит, может развиться язвенная болезнь, предраковые изменения слизистой оболочки, а также аденокарцинома желудка. К настоящему времени у двух штаммов H.pylori (J99 и 26695) определены полные последовательности генома. Геном H.pylori содержит ¬ 1600 генов [19]. Ряд генов, продуктами которых являются белки CagA, VacA, IceA, BabA, считаются факторами патогенности. Ген cagA ( — маркер gene) островка патогенности — cag () кодирует белки IV секреторной системы H.pylori, функция которой состоит в доставке эффекторных молекул микроорганизма в клетки макроорганизма. Они позволяют H.pylori модулировать метаболизм эпителиоцитов слизистой оболочки желудка, включая и экспрессию протоонкогенов. Продукты генов, входящих в состав островка патогенности, способны переносить cagA непосредственно в эпителиоциты слизистой оболочки желудка, где он подвергается фосфорилированию, что приводит к изменению цитоскелета и морфологическому изменению эпителиоцитов. Другой фактор патогенности H.pylori — ген vacA ( cytotoxin), присутствующий фактически у всех штаммов H.pylori, является цитотоксином, который экскретируется и повреждает эпителиальные клетки желудка. Относительно недавно описанный ген iceA (induced by contact with epithelium) существует в двух аллельных формах — iceA1 и iceA2. Предполагается, что iceA1 является маркером хронического гастрита и язвенной болезни желудка. У больных, инфицированных H.pylori c генотипом iceA1, инфильтрация собственной пластинки слизистой оболочки желудка нейтрофилами выше, чем у инфицированных H.pylori с другим генотипом. Факторы бактериальной адгезии на эпителий желудка человека также могут вносить вклад в специфический тропизм и патогеность штаммов H.pylori. Ген babA (blood group adhesin) является медиатором адгезии H.pylori с системой антигенов Lewis (Le) на эпителиальных клетках желудка. In vitro было показано, что H.pylori специфически связывается с поверхностью клеток слизистой желудка и регулируется фукосилированными антигенами этой группы. В исследованиях, проведенных в НИИ медицины под руководством , показано, что H.pylori характеризуется не только структурной, но и функциональной вариабельностью, и степень функциональной гетерогенности H.pylori штаммов характеризует состояние слизистой желудка у больных ранним раком желудка и хроническим гастритом. Функциональная гетерогенность бактерии, обнаруженная на фоне структурной (нуклеотидной) идентичности штаммов в пределах одного желудка, может характеризовать как адаптацию микроорганизма к морфологически разным по строению отделам желудка (антрум, тело и свод), так и адаптацию микроорганизма к патологическим процессам (неопластический процесс или хроническое воспаление), протекающих на слизистой желудка. Основную часть вариабельных белков H.pylori составляют , белки цикла трикарбоновых кислот и белки теплового стресса [20]. Практическую значимость имеет распределение генотипов H.pylori при различных заболеваниях. Так штаммы СagA оказывают более значимое воздействие на прогноз течения хронического гастрита и прогрессии атрофии, чем штаммы без СagA. Штаммы бактерий с типом s1VacA чаще ассоциированы с H.pylori ассоциированной патологией желудка, чем штаммы s2VacA, а штаммы BabA2 в наибольшей степени связаны с аденокарциномой (р = 0.033) в отличие от VacAs1 [21–23].
Новые эндоскопические технологии диагностики хронического гастрита, ассоциированного с H.pylori
Эндоскопическое исследование — один из самых важных методов оценки слизистой оболочки желудка. Применение дополнительных методик и техник, таких как эндоскопия в узком спектре света, эндоскопия с оптическим увеличением изображения, хромоэндоскопия, позволяют детально изучить структурные особенности слизистой оболочки желудка.
Увеличительная эндоскопия
Первое эндоскопическое исследование с применением оптического увеличения эндоскопического изображения желудка было выполнено еще в 1967 году в Японии (Okuyama) [24]. Это послужило отправной точкой для развития новых эндоскопических технологий, направленных на изучение мельчайших структур поверхности слизистой оболочки. В настоящее время существует два способа увеличения — электронное и оптическое. Изображение, полученное при помощи электронного увеличения, имеет такое же разрешение, как и обычное эндоскопическое изображение. В то время как при применении оптического увеличения становятся видимыми мельчайшие детали, которые невозможно обнаружить при обычном исследовании. Эндоскопы с увеличением оснащены с подвижными линзами в дистальной части аппарата и по своей функциональности сопоставимы с обычными световыми микроскопами. Довольно часто эндоскопическое исследование с увеличением применяется совместно с хромоскопией. Однако применение красителей не позволяет визуализировать микрососудистую архитектонику, что очень важно в дифференциальной диагностике неопластических изменений, к тому же эта дополнительная манипуляция увеличивает время исследования.
Узкоспектральная эндоскопия (narrow band imaging — NBI) — это новая оптическая диагностическая методика, которая основана на использовании специальных оптических фильтров, суживающих спектр световой волны. Обычные эндоскопические системы используют практически весь видимый световой спектр от 400 до 800 нм. Новая система использует преимущества в основном двух световых волн длиной 415 и 445 нм в диагностике сосудистых структур слизистой оболочки пищеварительного тракта, так как эти световые волны хорошо поглощаются гемоглобином. Таким образом, световые фильтры позволяют получить детальное изображение сосудистого рисунка тканей, его изменений, характерных для патологических участков воспалительного генеза, а также для предраковых заболеваний и ранних форм рака. Кроме этого, новая эндоскопическая система повышает контрастность изображения, что создает эффект виртуальной хромоскопии. С технической точки зрения применение функции узкого спектра света в желудке без оптического увеличения нецелесообразно в связи с тем, что получаемое изображение оказывается слишком темным и «шумным». Это происходит того, что при растяжении стенок желудка воздухом во время исследования его просвет становится слишком большим. Поэтому гораздо важнее и актуальнее проводить исследование в узком спектре света совместно с увеличением [25]. Первоначально хромоскопия и эндоскопия в узком спектре света в комбинации с увеличением применялись для оценки раннего рака желудка перед эндоскопической резекцией слизистой оболочки. С дальнейшим внедрением этих технологий в клиническую практику методики оценки микрососудистой архитектоники и микроструктуры поверхности слизистой оболочки стали успешно применятся для диагностики многих других патологических состояний желудка, таких как H.pylori ассоциированный гастрит, кишечная метаплазия, атрофия [26].
Нормальная слизистая оболочка желудка
В желудке выделяют четыре анатомических зоны: кардия, фундальный отдел (дно желудка), тело желудка, пилорический (антральный) отдел. Поверхность слизистой оболочки всех отделов желудка выстлана однослойным призматическим железистым эпителием. Для рельефа внутренней поверхности желудка характерно наличие трех видов образований — продольных желудочных складок, желудочных полей и желудочных ямочек. Желудочные складки (plicae gastricae) образованы слизистой оболочкой и подслизистой основой. Желудочные поля (areae gastricae) представляют собой отграниченные друг от друга бороздками участки слизистой оболочки. Они имеют многоугольную форму и размер поперечника от 1 до 16 мм. Наличие полей объясняется тем, что железы желудка располагаются группами, отделенными друг от друга прослойками соединительной ткани. Поверхностно лежащие вены в этих прослойках просвечивают в виде красноватых линий, выделяя границы между полями. Желудочные ямочки (foveolae gastricae) — это углубления эпителия в собственной пластинке слизистой оболочки. Они встречаются по всей поверхности желудка. Число ямочек в желудке достигает почти трех миллионов. Желудочные ямочки имеют микроскопические размеры, но величина их неодинакова в различных отделах желудка. В кардиальном отделе и теле желудка их глубина составляет всего ¼ толщины слизистой оболочки. В пилорической части желудка ямочки более глубокие. Они занимают около половины толщины всей слизистой оболочки [27]. При обычном эндоскопическом исследовании нормальная слизистая оболочка желудка цвета, ее цвет зависит от степени васкуляризации и растяжения — чем больше растяжение, тем бледнее слизистая оболочка. Слизистая оболочка имеет мелкозернистую поверхность благодаря наличию желудочных полей (рис. 4) [28].
Рисунок 4. Нормальная слизистая оболочка тела желудка при стандартном осмотре в белом световом режиме. Вид тела желудка (а) при инверсии (изгибе дистального конца эндоскопа на 180о) и (б) — при прямом осмотре эндоскопом; (в) — слизистая оболочки антрального отдела желудка; (г) — осмотр в узкоспектральном режиме: более контрастное изображение поверхности слизистой оболочки кардиального и субкардиального отделов желудка, мелкозернистая структура эпителия, четкая граница с плоским эпителием пищевода (указана стрелками).
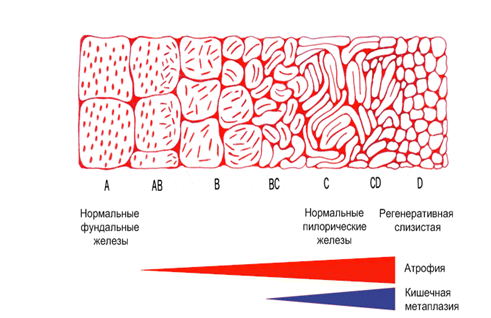
Применение узкоспектральной эндоскопии в комбинации с оптическим увеличением изображения позволяет дифференцировать патологические изменения, которые при обычной эндоскопии не могут быть выявлены. Однако следует отметить, что применение этих технологий не может полностью обеспечить различение абсолютно нормальной слизистой оболочки от гастрита с минимальными изменениями. При осмотре слизистой оболочки с увеличением оцениваются две основные характеристики — микроструктура поверхности слизистой оболочки (ямочный рисунок — pit pattern) и микрососудистая структура (рисунок субэпителиальной капиллярной сети (subepithelial capillary network — SECN). Более тридцати лет назад Sakaki предложил классификацию типов рисунка слизистой оболочки желудка при использовании фиброскопа с увеличением в 30 раз. Согласно этой классификации (рис. 5), выделяют чистые типы (А, В, С, D) и смешанные типы (АВ, ВС, CD). Типы, А и В соответствуют нормальной слизистой оболочке. Дальнейшие изменения рисунка ямок свидетельствуют о более выраженных предопухолевых изменениях, таких как атрофия и кишечная метаплазия (показаны красной и синей полосами в нижней части рисунка). Для диспластических изменений и опухолевого процесса типы рисунка могут соответствовать С (полосатый тип) и D (нерегулярный, зернистый, ячеистый рисунок) типам рисунка.
А — точечные ямки (dotted pits)
В — короткие линейные ямки (short linear pits)
С — полосатые борозды (striped grooves)
D — ячеистые борозды ( grooves)
Рисунок 5. Схема классификации типов рисунка поверхности слизистой оболочки желудка при увеличительной эндоскопии (по Sakaki).
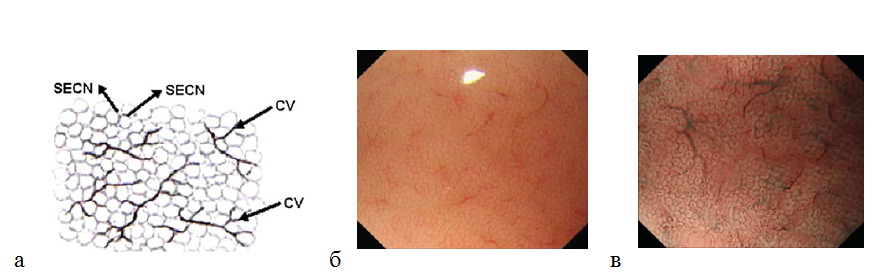
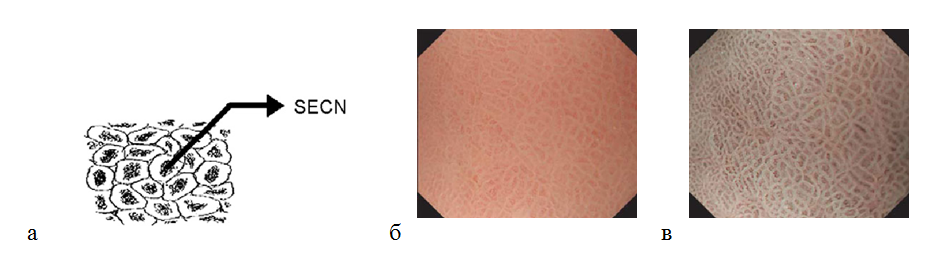
Оценивая микрососудистую архитектонику в теле желудка, можно определить рисунок субэпителиальной капиллярной сети (SECN) в виде пчелиных сот ( network) с коллекторными венулами. Полигональные петли субэпителиальных капилляров окружают каждую желудочную ямку, формируя под эпителием сеть в виде пчелиных сот. Далее ветви сосудистой сети сходятся в коллекторные венулы. При осмотре в узкоспектральном режиме с оптическим увеличением изображения микроструктура поверхности слизистой оболочки становиться более отчетливой: определяются ямки округлой или овальной формы. Ямки гистологически соответствуют желудочным железам. Коллекторные венулы (CV) располагаются глубже, чем субэпителиальная капиллярная сеть, поэтому при осмотре в узком спектре света имеют более насыщенный зеленый цвет. Так как в режиме NBI участки с большей васкуляризацией становятся темными, наблюдается специфическая картина слизистой оболочки тела желудка: светлые участки окружены темным ободком [29] (рис. 6). Правильная форма и взаиморасположение сосудов и структур слизистой оболочки являются наиболее важными ее характеристиками для дифференцировки нормальной и патологически измененной слизистой оболочкой желудка.
Рисунок 6. (а) — рисунок (схема) субэпителиальной капиллярной сети (SECN) в виде пчелиных сот с коллекторными венулами (CV); (б) — нормальная слизистая оболочка тела желудка: эндоскопическое изображение поверхности слизистой оболочки с увеличением изображения: субэпителиальный капиллярный рисунок в виде пчелиных сот с коллекторными венулами; (в) — эндоскопия с увеличением изображения в узкоспектральном световом режиме: более отчетливо видны желудочные ямки округлой или овальной формы, сосудистый рисунок.
Нормальная слизистая оболочка в антральном отделе
Слизистая оболочка антрального отдела желудка имеет другую картину. При исследовании микрососудистой архитектоники определяется кольцеобразная () субэпителиальная капиллярная сеть. Коллекторные венулы визуализируются реже, так как они находятся в более глубоких частях собственной пластинки, в отличие от тела желудка. Ямки имеют линейный или сетчатый рисунок. Каждый субэпителиальный капилляр расположен в апикальной части желудочной ямки в виде кольца, которое разделяется линейными или сетчатыми бороздками. В отличие от слизистой оболочки тела желудка, в антральном отделе более темные участки окружены светлым ободком (рис. 7). По размерам эти структуры в антральном отделе больше, чем в теле желудка.
Рисунок 7. (а) — кольцеобразная субэпителиальная капиллярная сеть (SECN) в антральном отделе желудка; (б) — нормальная слизистая оболочка антрального отдела желудка: эндоскопическое изображение поверхности слизистой оболочки с увеличением изображения: кольцеобразный субэпителиальный капиллярный рисунок; (в) — эндоскопия с увеличением изображения в узкоспектральном световом режиме: более отчетливо определяется кольцеобразный субэпителиальный капиллярный рисунок и сетчатая микроструктура поверхности слизистой оболочки.
Источник