- Сульфаты
- Содержание
- Свойства
- Происхождение (генезис)
- Использование
- Качественные реакции
- См. также
- Литература
- Ссылки
- Примечания
- Полезное
- Смотреть что такое «Сульфаты» в других словарях:
- Серная кислота
- Основные свойства оксида серы 4, с какими веществами взаимодействует
- Оксид серы (IV) или диоксид — что это за вещество
- Основные физические и химические свойства, с какими веществами взаимодействует
- Качественные реакции, как проходит горение
- Как получить, особенности применения
Сульфаты
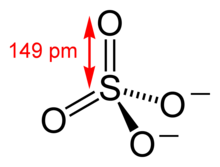
Сульфа́ты — минералы, соли серной кислоты H2SO4. В их кристаллической структуре обособляются комплексные анионы SO4 2− . Наиболее характерны сульфаты сильных двухвалентных оснований, особенно Ba2+, а также Sr 2+ и Ca 2+ . Более слабые основания образуют основные соли, часто весьма неустойчивые (например сульфаты окисленного железа), более сильные основания — двойные соли и кристаллогидраты.
Содержание
Свойства
- Твёрдость 2—3,5
- Удельный вес 1,5—6,4
- Окраска разнообразная, большей частью светлая
- Показатель преломления 1,44-1,88, двупреломление большей частью низкое
- Большинство сульфатов хорошо растворимы в воде
Происхождение (генезис)
Образуются в условиях повышенной концентрации кислорода и при относительно низких температурах, то есть вблизи земной поверхности. Большей частью экзогенные, хемогенные (в месторождениях солей). Сульфаты Cu, Zn и других близких элементов образуются при разрушении сульфидов. В природе встречается 180 минералов сульфатов и на их долю приходится
Использование
Некоторые из сульфатов добывают для различных технических целей (гипс, барит и др.). для химической промышленности (мирабилит и др.), как руды Mg и др.
Качественные реакции
- Реакция с хлоридом бария даёт белый кристаллический осадок сульфата бария[1] :

- Реакция с ацетатом свинца(II) даёт белый кристаллический осадок сульфата свинца[1] :

См. также
Литература
- Геологический словарь, Т. 2. — М .: Недра, 1978. — С. 287.
Ссылки
Примечания
- ↑ 12 Аналитическая химия. — М .: Высшая школа, 1973. — С. 248.
| Wikimedia Foundation . 2010 . ПолезноеСмотреть что такое «Сульфаты» в других словарях:СУЛЬФАТЫ — (ново лат., от sulfur сера). Серно кислые соли. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. СУЛЬФАТЫ новолатинск., от sulfur, сера. Серноватистокислые соли. Объяснение 25000 иностранных слов, вошедших в… … Словарь иностранных слов русского языка СУЛЬФАТЫ — соли или эфиры серной кислоты Н2SO4. Соли Средние (напр., К2SO4) и кислые, или гидросульфаты (КНSO4), кристаллы. Средние соли распространены в природе (см. Сульфаты природные). Эфиры диорганилсульфаты ROSO2OR и органилсульфаты ROSO2ОМ (R… … Большой Энциклопедический словарь СУЛЬФАТЫ — м лы, соли серной кислоты H2SO4. В кристаллической структуре их обособляются комплексные анионы [SO4]2 . Наиболее характерны С. сильных двухвалентных оснований, особенно Ва2+, а также Sr2+ и Са2+. Более слабые основания образуют основные соли и… … Геологическая энциклопедия СУЛЬФАТЫ — СУЛЬФАТЫ, соли и эфиры серной кислоты H2SO4. Соли средние (например, K2SO4) и кислые, или гидросульфаты (KHSO4), кристаллы. Средние соли распространены в природе (например, гипс). Эфиры применяют в органическом синтезе, как растворители … Современная энциклопедия СУЛЬФАТЫ — СУЛЬФАТЫ, ов, ед. сульфат, а, муж. (спец.). Соли серной кислоты. | прил. сульфатный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова Сульфаты — СУЛЬФАТЫ, соли и эфиры серной кислоты H2SO4. Соли средние (например, K2SO4) и кислые, или гидросульфаты (KHSO4), кристаллы. Средние соли распространены в природе (например, гипс). Эфиры применяют в органическом синтезе, как растворители. … Иллюстрированный энциклопедический словарь СУЛЬФАТЫ — соли серной кислоты H2S04, содержащие ион SO2 ; или ион HSO гидросульфаты, а также природные минералы (С. меди, цинка, железа, свинца и др.), образующиеся при разрушении (см.). Большинство С. (за исключением CaS04, SrS04 и BaS04) хорошо… … Большая политехническая энциклопедия сульфаты — ов; мн. (ед. сульфат, а; м.). [от лат. sulphur сера] Хим. Соли серной кислоты. Природные с. (класс минералов). * * * сульфаты соли или эфиры серной кислоты H2SO4. Соли средние (например, K2SO4) и кислые, или гидросульфаты (KHSO4), кристаллы.… … Энциклопедический словарь Сульфаты — (от лат. sulphur, sulfur сера) сернокислые соли, соли серной кислоты H2SO4. Имеются два ряда С. средние (нормальные) общей формулы Mg2SO4 и кислые (Гидросульфаты) MHSO4, где М одновалентный металл. С. кристаллические вещества,… … Большая советская энциклопедия СУЛЬФАТЫ — соли или эфиры серной кислоты H2SO4. Соли средние (напр., K2SO4) и кислые, или гидросульфаты (KHSO4),кристаллы. Средние соли распространены в природе (см. Сульфаты природные). Эфиры диорганилсульфаты ROSC2OR и органилсульфаты ROSO2OM (R органич.… … Естествознание. Энциклопедический словарь Источник Серная кислотаСерная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха. Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам. Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот. ПолучениеИзвестны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой. Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов: В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом: Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты: В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную: В упрощенном виде нитрозный способ можно записать так: Химические свойстваВ водном растворе диссоциирует ступенчато. Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты. KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль) 2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль) С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки. Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа. Реакции с металлами Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после — не реагируют с ней. Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2. Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты) Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2. Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет. Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2. Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет об H2S, если же написано, что выделилось простое вещество — речь о сере (S). © Беллевич Юрий Сергеевич 2018-2021 Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. Источник Основные свойства оксида серы 4, с какими веществами взаимодействуетОксид серы (IV) или диоксид — что это за веществоОксид серы (IV) является кислотным оксидом, бесцветным газообразным веществом, обладающим резким запахом (как у загорающейся спички) и хорошо растворимым в воде. Источник: wikipedia.org Источник: wikipedia.org Химическая формула диоксида серы: Основные физические и химические свойства, с какими веществами взаимодействуетВещество S O 2 под названием сернистый газ является ядовитым. Диоксид серы тяжелее воздуха более чем в два раза. При комнатной температуре в одном объеме воды растворяется примерно 40 объемов сернистого газа, что сопровождается образованием сернистой кислоты H 2 S O 3 . При повышении давления при комнатной температуре вещество сжижается. Оксид серы (IV) представляет собой один из основных компонентов вулканических газов. Физические характеристики оксида серы (IV):
Оксид серы (IV) относится к кислотным оксидам. Благодаря содержанию в веществе серы в степени окисления + 4 S O 2 способен играть роль и окислителя, и восстановителя в химических реакциях. Являясь кислотным оксидом, сернистый газ вступает в химические реакции со щелочами и оксидами щелочных и щелочноземельных металлов. Взаимодействие оксида серы (IV) с гидроксидом натрия сопровождается образованием либо кислой соли (при условии избытка сернистого газа), либо средней соли (если щелочь в избытке): S O 2 + 2 N a O H ( и з б ) → N a 2 S O 3 + H 2 O S O 2 ( и з б ) + N a O H → N a H S O 3 Уравнение реакции оксида серы (IV) с основным оксидом натрия: S O 2 + N a 2 O → N a 2 S O 3 В процессе реакции оксида серы (IV) с водой образуется сернистая кислота. Данный процесс является обратимым. Это связано со способностью сернистой кислоты распадаться в значительной степени в водном растворе, что приводит к образованию оксида и воды. S O 2 + H 2 O ↔ H 2 S O 3 У S O 2 наиболее ярко выражены восстановительные свойства. В процессе взаимодействия вещества с окислителями повышается степень окисления серы. Окисление оксида серы кислородом на катализаторе в жестких условиях (процесс является обратимым): 2 S O 2 + O 2 ↔ 2 S O 3 Обесцвечивание бромной воды сернистым ангидридом: S O 2 + B r 2 + 2 H 2 O → H 2 S O 4 + 2 H B r Процесс окисления сернистого газа с помощью азотной кислоты протекает легко: S O 2 + 2 H N O 3 → H 2 S O 4 + 2 N O 2 Процесс окисления оксида серы (IV) с помощью озона: S O 2 + O 3 → S O 3 + O 2 Окисление сернистого газа оксидом свинца (IV): S O 2 + P b O 2 → P b S O 4 При контакте с сильными восстановителями S O 2 может проявлять окислительные свойства. Взаимодействие с сероводородом приводит к восстановлению сернистого газа до молекулярной серы: S O 2 + 2 Н 2 S → 3 S + 2 H 2 O Окисление оксидом серы (IV) угарного газа и углерода: S O 2 + 2 C O → 2 С О 2 + S S O 2 + С → S + С O 2 Качественные реакции, как проходит горениеКачественная реакция на сернистый газ и на сульфит-ион представляет собой процесс обесцвечивания раствора перманганата калия: 5 S O 2 + 2 H 2 O + 2 K M n O 4 → 2 H 2 S O 4 + 2 M n S O 4 + K 2 S O 4 Двуокись серы является продуктом горения серы или горящих материалов, в состав которых входит сера: Δ H = − 297 к Д ж / м о л ь С целью повышения интенсивности горения сжиженную серу (140-150°C, 284–302°F) распыляют с помощью специальной насадки, что приводит к образованию мелких капель серы, обладающих большой площадью поверхности. Реакция является экзотермической. В процессе температура повышается до 1000-1600°C. Произведенное тепло по большей части утилизируют с помощью производства пара, который в дальнейшем может быть преобразован в электрическую энергию. Сходным образом происходит горение сероводорода и сероорганических соединений. К примеру: 2 Н 2 S + 3 О 2 → 2 Н 2 О + 2 S O 2 В процессе обжига сульфидных руд, например, пирита, сфалерита и сульфида ртути, аналогично происходит выделение : 4 F e S 2 + 11 O 2 → 2 F e 2 O 3 + 8 S O 2 2 Z n S + 3 O 2 → 2 Z n O + 2 S O 2 H g S + O 2 → H g + S O 2 4 F e S + 7 O 2 → 2 F e 2 O 3 + 4 S O 2 Данные реакции, протекающие при извержении вулканов, в комплексе служат наиболее крупным источником диоксида серы. В результате таких явлений может происходить выброс миллионов тонн S O 2 . Как получить, особенности примененияСуществуют разные способы получения оксида серы (IV). Сжигание серы на воздухе: Горение сульфидов и сероводорода: 2 H 2 S + 3 O 2 → 2 S O 2 + 2 H 2 O 2 C u S + 3 O 2 → 2 S O 2 + 2 C u O Оксид серы (IV) получают в результате реакции взаимодействия сульфитов с более сильными кислотами. В качестве примера можно привести реакцию сульфита натрия с серной кислотой: N a 2 S O 3 + H 2 S O 4 → N a 2 S O 4 + S O 2 + H 2 O При обработке концентрированной серной кислотой неактивных металлов получают S O 2 . К примеру, такой результат можно наблюдать при взаимодействии меди с концентрированной серной кислотой: C u + 2 H 2 S O 4 → C u S O 4 + S O 2 + 2 H 2 O Сферы применения оксида серы (IV):
Источник |
|---|