- Химическое равновесие. Принцип Ле Шателье
- Понятие химического равновесия
- Признаки химического равновесия
- Принцип Ле Шателье
- Влияние температуры на химическое равновесие
- Влияние давления на химическое равновесие
- Влияние концентрации на химическое равновесие
- Константа химического равновесия
- Примеры решения задач
- Задачи для самостоятельного решения
- Химическое равновесие
Химическое равновесие. Принцип Ле Шателье
Материалы портала onx.distant.ru
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
константа химической реакции Кс есть отношение:
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGT о = – RTlnK (2)
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
Вещество
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
Решение.
ΔG298 о = 2·(- 16,71) кДж = -33,42·10 3 Дж.
lnK = 33,42·10 3 /(8,314× 298) = 13,489. K = 7,21× 10 5 .
Задача 3. Определите равновесную концентрацию HI в системе
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х) 2 /((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔН о Т » ΔН о 298, а ΔS о T » ΔS о 298.
Решение.
Если К = 1, то ΔG о T = — RTlnK = 0;
ΔН о 298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 10 3 Дж;
ΔS о 298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества
газообразных веществ, то равновесие сместится вправо в реакции 3.
2. При некоторой температуре равновесные концентрации в системе:
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
К = 4; исходная концентрация HBr составляет 1,5 моль/л.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
[H2] = 0,5 моль/л; [S] = 1,5 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
становится равной 1. Примите, что ΔН о Т≈ΔН о 298, а ΔS о T≈ΔS о 298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
равна 3,4·10 -5 . Вычислите Δ G о 500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔG о f,800(С3Н6(г)), если ΔG о f,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л;
исходная концентрация О2 составляет 0,20 моль/л.
Источник
Химическое равновесие





В общем виде химическая реакция может быть представлена уравнениями: аА + bB = cC + dD; Vпр = k1 [A] a [B] b ; Vобр. = k2 [С] с [D] d .
Так как при химическом равновесии Vпр. = Vобр., следовательно k1 [A] a [B] b = k2 [С] с [D] d . Для преобразования делим обе части равенства на выражение k2 [С] с [D] d : 

Величина Кр как отношение постоянных величин есть величина постоянная, называемая константой равновесия. Концентрации реагентов при установившемся равновесии называются равновесными концентрациями.
Например: 2СO + O2 = 2СO2, 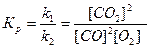
Концентрации реагирующих веществ не влияют на константу равновесия, так как константы скорости реакций, отношением которых она является, не зависят от концентрации. Но k1 и k2 зависят от температуры и меняются с изменением температуры по-разному, поэтому Кр зависит от температуры.
При неизменных внешних условиях состояние (положение) равновесия сохраняется сколь угодно долго. При изменении внешних условий положение равновесия изменяется, так как нарушается равенство Vпр. = Vобр. Через некоторое время после изменения условий установится новое равновесие, но при других равновесных концентрациях. Переход системы из одного равновесного состояния в другое называется смещением равновесия(сдвигом равновесия).
Закономерное влияние внешних условий (концентраций реагентов, температуры, давления) на положение равновесия обратимых химических реакций было установлено в 1847 году французским ученым Ле-Шателье. Принцип Ле-Шательезвучит следующим образом: “Если на систему, находящуюся в равновесном состоянии, оказать какое-либо внешние воздействие (изменение температуры, давления, концентрации), то равновесие в системе сместиться в сторону той реакции, которая сводит это воздействие к минимуму”
1. При увеличении концентрации какого-либо вещества, участвующего в равновесии, равновесие смещается в сторону расхода данного вещества, а при уменьшении концентрации – в сторону его образования.
Например, в системе 2СO + O2 = 2СO2 при увеличении концентрации кислорода равновесие сместится в сторону его расходования, т.е. вправо, в сторону образования СО2.
2. При увеличении давления путем сжатия системы равновесие смещается в сторону меньшего числа молекул газа, т.е. в сторону понижения давления, а при уменьшении давления равновесие сместится в сторону большего числа молекул газа, т.е. в сторону увеличения давления.
Например, в системе 2СO + O2 = 2СO2 при увеличении давления равновесие сместится в сторону меньшего числа молекул газа, т.е. вправо, в сторону образования СО2, так как в левой части три молекулы газа, а в левой всего две. ся в равновесном состоянии, оказать какое-либо внешние воздействие ( на положение равновесия обратимых химических реакций был

3. При увеличении температуры равновесие смещается в направлении эндотермической реакции, а при уменьшении – в направлении экзотермической реакции.

Экзотермической реакций называется реакция, идущая с выделением тепла (ΔН 0).

При увеличении температуры в данной системе равновесие сместится влево, в сторону исходных реагирующих веществ, так как обратная реакция является эндотермической.
Принцип Ле-Шателье подтверждается и распространяется не только на химические, но и на различные физико-химические равновесные процессы. Смещение равновесия при изменении условий таких процессов, как кипение, кристаллизация и растворение, происходит в соответствии с данным принципом.
Растворы
Растворы имеют огромное значение в минеральной и органической жизни Земли, в науке, технике, строительстве.
Раствор — однородная в фазовом отношении сложная система переменного состава.
 Т в е р д ы е (минералы, сплавы) Т в е р д ы е (минералы, сплавы) |
| Растворы |
| Ж и д к и е (раствор NaCl в воде) |
| Г а з о о б р а з н ы е (воздух – 21 % О2 + 78 % N2 + 1 % др. газов) |
Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкость) и растворенного вещества. Например: раствор газа в жидкости – кислород в воде; раствор твердого вещества в жидкости – сахар в воде; раствор жидкости в жидкости – серная кислота в воде. В случае смеси жидкостей растворителем является жидкость, которая содержится в большем количестве. Кроме того, жидкими растворами являются и те, в которых растворитель не вода, а другая жидкость (спирт, ацетон, толуол, керосин и др.).
Способность вещества растворяться всегда ограничена, исключение составляют жидкости, смешивающиеся друг с другом в разных соотношениях, например вода и этиловый спирт. Количество вещества, которое может раствориться при данной температуре в определенном количестве растворителя, называется растворимостью (S). Единицы измерения растворимости г или моль растворенного вещества в 1 дм 3 растворителя; г растворенного вещества в 100 г растворителя. Растворимость разных веществ в воде при постоянной температуре различается весьма сильно. Хорошо растворимыми считаются вещества, которые растворяются в воде более 10 г/л. Слабо растворимые – растворяются в воде в диапазоне от 0,01 до 10 г/л. Практически нерастворимые – растворяются в воде менее 0,01 г/л. Раствор, в котором при данной температуре вещество больше растворяться не может, называется насыщенным (С= S, здесь С – концентрация растворенного вещества). Ненасыщенный раствор содержит меньше растворенного вещества, чем насыщенный (С S). Растворимость веществ обычно зависит от температуры. Растворимость большинства твердых и жидких веществ с повышением температуры увеличивается, газообразных — уменьшается.
Растворение — сложный физико-химическийц процесс. С одной стороны, растворяющееся вещество удаляется с поверхности кристалла и равномерно распреде- ляется по объему растворителя — физический процесс (диффузия). Скорость диффузии оказывает значительное влияние на скорость растворения. С другой — частицы растворенного вещества и растворителя взаимодействуют друг с другом — химический процесс (сольватация). Если растворителем является вода, то говорят о гидратации растворенного вещества. Гидратная оболочка довольно прочно связана с частицами растворенного вещества и при его выделении из раствора входит в состав кристаллов.
CuSO4 — вещество белого цвета; CuSO4 5H2O – кристаллогидрат меди — вещество синего цвета. Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Помимо наличия кристаллогидратов, доказательством того, что растворение хими- ческий процесс, является тепловой эффект при растворении. Например, если поместить в стакан с водой твердую соль NH4NO3, то в результате растворения последней темпе- ратура раствора понижается так сильно, что стакан примерзает к поверхности,на которой стоит, если она смочена водой; при добавлении H2 SO4 в стакан с водой последний заметно нагревается.
Установлено, что тепло поглощенное при растворении (отрицательный тепловойэффект ) затрачивается на разрушение кристаллической решетки и диффузия раство- ряющегося вещества на весь объем раствора (физический
процесс). Причиной положительного теплового эффектаслужит образование сольватов (химический процесс).
Общий тепловой эффект растворения — алгебраическая сумма положительного и отрицательного тепловых эффектов. В зависимости от природы растворяемого вещества соотношение положительного и отрицательного эффектов при растворении меняется и, следовательно, меняются величина и знак суммарного теплового эффекта.
Любой растворитель характеризуется параметрами: давление насыщенного пара, осмотическое давление, температуры кипения и замерзания. Для разбавленных растворов неэлектролитов аналогичные свойства изменяются пропорционально концентрации растворенного вещества и описываются законами Ф. Рауля и Я. Вант-Гоффа.
I закон Рауля
Давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем. При этом чем больше концентрация растворенного вещества, тем больше понижается давление пара над раствором.
P = P o × c o ,
где c o – молярная доля растворителя в растворе; Р и Р о — соответственно давление пара растворителя над раствором и растворителем.
II закон Рауля
Температура кипения раствора Т2 выше температуры кипения чистого растворителя Т1 ( DТкип = Т2 — Т1). При этом чем выше концентрация раствора, тем выше температура кипения.
DТкип = Е×С .
Растворы замерзают при более низкой температуре, чем чистый растворитель. При этом, чем выше концентрация растворённого вещества, тем ниже температура замерзания
DТзам = К×С,
где С – концентрация раствора; Е – эбулиоскопическая постоянная, которая равна повышению температуры кипения при растворении 1 моля вещества в 1 кг растворителя; К – криоскопическая постоянная, которая численно равна понижению температуры замерзания при растворении 1 моль вещества в 1 кг растворителя.
Закон Вант-Гоффа
Осмотическое давление равно такому давлению, которое нужно приложить к раствору для предотвращения проникновения в него растворителя
p = С× R×T ,
где p — осмотическое давление; R – газовая постоянная, равная 8,314 Дж/К×моль;
Источник







