- Стадии рака
- Классификация TNM
- Стадии злокачественной опухоли
- Сторожевой лимфатический узел
- Степень злокачественности
- Шкала Глисона при раке простаты
- Классификации рака печени
- Почему важно установить стадию злокачественной опухоли?
- Диффузные глиомы
- Классификация диффузных глиом
- Диагностика диффузной глиомы
- Прогностические маркеры диффузной глиомы
- Лечение диффузной глиомы
Стадии рака
Все опухоли (или, на языке врачей — новообразования) делят на две большие группы: доброкачественные и злокачественные. Первые обычно не опасны для жизни, а вторые, если человек не получает лечения, приводят к гибели. В 2015 году от рака во всем мире умерло почти 9 миллионов человек.
Фатальность злокачественных опухолей связана с двумя их главными свойствами, которые, собственно, и отличают их от доброкачественных новообразований:
- Инвазивный (инфильтрирующий) рост: злокачественные клетки прорастают в окружающие ткани и разрушают их.
- Метастазирование: раковые клетки могут отрываться от первичной опухоли и мигрировать по организму, давая начало вторичным очагам в разных органах. Многих онкологических больных убивают именно метастазы.
Для врача важно понимать, насколько сильно рак успел распространиться в организме пациента. Ведь от этого зависит лечение и прогноз. Для того чтобы упростить эту задачу и внести четкость, в течении каждого онкологического заболевания принято выделять определенные стадии.
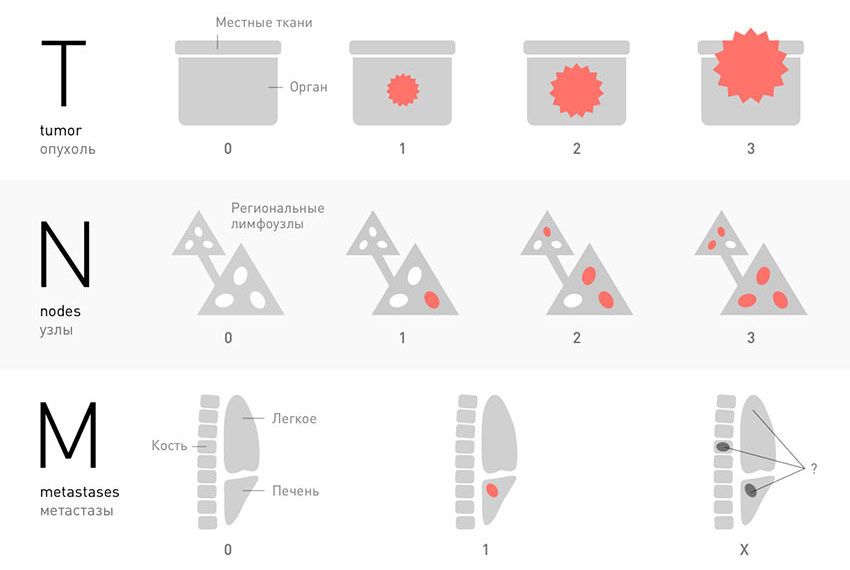
Классификация TNM
В большинстве случаев, для того чтобы установить стадию рака, ориентируются на три характеристики злокачественной опухоли, которые соответствуют трем буквам аббревиатуры TNM. К каждой букве приписывают индекс в виде цифры или специального обозначения.
T — tumor. Эта буква обозначает первичную опухоль, ее размеры, прорастание в стенку органа, соседние ткани:
- TX — первичную опухоль не удается оценить.
- Tis — «рак на месте» (in situ). Это самая ранняя стадия, когда опухоль очень мала и не прорастает в соседние ткани. Считается, что она находится в состоянии равновесия: новые опухолевые клетки образуются с той же скоростью, что погибают старые.
- T0 — первичная опухоль не обнаруживается.
- T1-T4 — цифра увеличивается параллельно размерам опухоли.
N — nodus. Когда раковые клетки отрываются от первичной опухоли и мигрируют с током лимфы, в первую очередь они попадают в близлежащие (регионарные) лимфатические узлы. Можно сказать, что это первые баррикады на пути распространения рака в организме. В зависимости от того, обнаружены ли опухолевые клетки в регионарных лимфатических узлах, N может принимать значения:
- NX — не удается оценить регионарные лимфоузлы.
- N0 — регионарные лимфатические узлы «чистые».
- N1-N3 — в регионарных лимфоузлах обнаружены раковые клетки. Увеличение цифры соответствует большей вовлеченности лимфатических узлов.
M — metastasis. Эта буква показывает, обнаружены ли в теле больного отдаленные метастазы — вторичные очаги в различных органах:
- M0 — отдаленных метастазов нет.
- M1 — обнаружены отдаленные метастазы.
Классификация TNM применима для большинства видов рака. Она позволяет очень подробно описывать злокачественные опухоли. В пределах основных групп выделяют подгруппы, их обозначают с помощью букв, например: T1a, T1b, T1c.
Однако, зачастую система TNM оказывается слишком громоздкой и не совсем удобной. Существует ее упрощенный вариант, когда возможные сочетания значений T, N и M сводят к пяти стадиям.
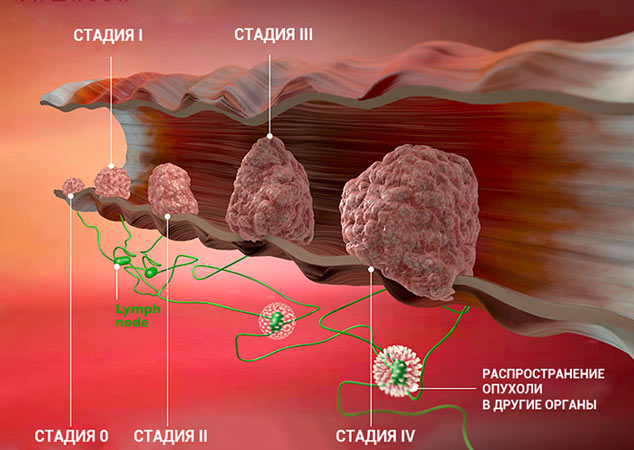
Стадии злокачественной опухоли
Часто онкологи обозначают стадию рака римской цифрой от I до IV. Эта классификация основана на TNM, но она проще и зачастую удобнее:
- Стадия 0 — «рак на месте».
- Стадии I–III — локальное распространение. Опухоль может иметь различные размеры, на разную глубину прорастать в стенку органа, распространяться в соседние ткани или регионарные лимфоузлы.
- Стадия IV — рак с отдаленными метастазами.
Это очень приблизительное описание стадий. Деление зависит от типа рака, от того, в каком органе он находится. Для того чтобы обозначить подстадию, к букве приписывают цифру. Например, стадия I может делиться на подстадии IA и IB.
Сторожевой лимфатический узел
Когда хирург оперирует онкологического пациента, зачастую ему приходится решать сложную задачу: стоит ли удалять регионарные лимфатические узлы? Если в них есть раковые клетки, и они будут оставлены в организме больного, произойдет рецидив. Если же удалить «чистые» лимфоузлы, это чревато осложнением в виде лимфедемы — отека на руке или ноге из-за нарушения оттока лимфы.
Раньше врачи нередко предпочитали меньшее из зол и удаляли лимфатические узлы «на всякий случай». Современные хирурги уже не действуют вслепую и могут более точно определить показания к лимфодиссекции. Это стало возможно благодаря появлению сентинель-биопсии или биопсии сторожевого лимфатического узла.
Сторожевым называется лимфатический узел (или группа лимфатических узлов), который первым принимает лимфу, оттекающую от злокачественной опухоли. Его можно обнаружить во время операции: для этого нужно ввести в опухоль флуоресцентный краситель или препарат с радиоактивной меткой. Препарат проникает в лимфатические сосуды, затем в сигнальный лимфоузел и «прокрашивает» его. Лимфатический узел удаляют и проверяют, нет ли в нем раковых клеток.
Для обозначения состояния сигнального лимфоузла используют специальную классификацию:
- pNX(sn) — не удается оценить лимфатический узел.
- pN0(sn) — в сторожевом лимфоузле нет раковых клеток.
- pN1(sn) — сторожевой лимфоузел поражен раковыми клетками.
Если в сигнальном лимфоузле обнаружена опухолевая ткань — это показание к удалению регионарных лимфоузлов.
Степень злокачественности
Злокачественность и степень дифференцировки — два показателя, которые тесно взаимосвязаны. Они описывают внешний вид раковых клеток под микроскопом. Степень дифференцировки показывает, насколько раковая клетка отличается от здоровой. Если она высокая — опухолевая ткань похожа на здоровую. Низкодифференцированные раковые клетки полностью теряют сходство с нормальными.
Чем ниже степень дифференцировки и выше злокачественность, тем агрессивнее ведет себя рак и быстрее распространяется в организме. Для оценки используют гистологическую классификацию:
- GX — не удается определить степень дифференцировки опухоли;
- G1 — высокая степень дифференцировки;
- G2 — средняя степень дифференцировки;
- G3 — низкая степень дифференцировки;
- G4 — недифференцированная злокачественная опухоль.
Шкала Глисона при раке простаты
Для того чтобы оценить степень злокачественности и агрессивности рака предстательной железы, используют шкалу Глисона, разработанную в 1960-х годах. В зависимости от того, как опухолевая ткань выглядит под микроскопом, ей присваивают оценку от 1 до 5. Чем ниже оценка, тем более высокодифференцированными и менее злокачественными являются клетки. Патологоанатом должен выявить два преобладающих типа ткани и выставить две оценки. Итоговая сумма баллов может колебаться от 2 до 10. Чем она больше, тем агрессивнее ведет себя опухоль, и выше риски.
Классификации рака печени
Классификация TNM не очень хорошо отражает течение злокачественных опухолей печени, поэтому в разных странах были созданы специальные классификации печеночно-клеточного рака. Например, многие врачи используют Барселонскую клиническую классификацию. В ее рамках выделяют следующие стадии рака печени:
- Стадия 0 — очень ранний рак. Размер опухоли менее 2 см, она не прорастает в сосуды, нет сателлитных (добавочных) очагов. Больной чувствует себя хорошо, функция печени удовлетворительная.
- Стадия A — ранний рак. Имеется единичная опухоль размерами 2–5 см либо не более трех опухолей размерами до 3 см. Функция печени удовлетворительная, симптомов нет.
- Стадия B — промежуточная. В печени много узлов, но они не прорастают в кровеносные сосуды, больной не предъявляет жалоб.
- Стадия C — распространенный рак. Ухудшается функция печени, из-за этого появляются симптомы. Опухоли прорастают в кровеносные сосуды, либо раковые клетки распространяются в регионарные лимфоузлы, возникают отдаленные метастазы.
- Стадия D — поздний рак. Состояние пациента сильно ухудшается, печень не может адекватно справляться со своими функциями.
В некоторых странах практикуется классификация итальянской программы по изучению рака печени (CLIP). В ней учитывается четыре фактора: состояние функции печени, распространение опухолевых очагов (больше или меньше половины печени), уровень альфа-фетопротеина (опухолевый маркер) и наличие тромбоза портальной вены. По каждому показателю врач выставляет оценку 0, 1 или 2 балла. Выживаемость пациентов зависит от суммы баллов:
- 0 — 42,5 месяца.
- 1 — 32 месяца.
- 2 — 16,5 месяца.
- 3 — 4,5 месяца.
- 4 — 2,5 месяца.
- 5–6 — 1 месяц.
В соответствии с системой CLIP, всех больных печеночно-клеточным раком можно поделить на две группы: 0–2 балла — значительно более благоприятный прогноз; более 2 баллов — значительно менее благоприятный прогноз.
В 1985 году была предложена классификация Okuda, в которой учитываются: степень поражения печени, наличие асцита (скопления жидкости в брюшной полости), изменение уровня альбумина и билирубина в крови. В соответствии с классификацией Okuda, выделяют три стадии рака печени:
- I стадия: опухоль распространилась менее чем на половину печени, асцита нет, уровень альбумина умеренно снижен, билирубин повышен.
- II стадия: выявляются 1–2 признака прогрессирования процесса (поражение более половины печени, асцит, снижение альбумина менее 3 мг/дл, повышение билирубина более 3 мг/дл).
- III стадия: выявляются 3–4 признака прогрессирования.
Почему важно установить стадию злокачественной опухоли?
Знание стадии рака по TNM и другим системам помогает онкологу решать важные задачи:
- Правильно спланировать лечение.
- Определить прогноз.
- Проконтролировать, насколько эффективно работает лечение.
- Оценивать поведение опухоли в динамике.
Единые классификации помогают врачам из разных клиник и стран «разговаривать на одном языке». Видя стадию опухоли, диагностированную в другой клинике, онколог четко понимает, что это значит, и как дальше работать с пациентом.
Источник
Диффузные глиомы
Классификация диффузных глиом
1) Астроцитома с мутацией IDH1/2
2) Астроцитома без мутации IDH1/2
3) Астроцитома с неопределенным IDH-статусом (NOS)
4) Олигодендроглиома (с обязательным наличием мутации IDH1/2 и ко-делеции 1p/19q)
Диагностика диффузной глиомы
Диффузные глиомы обычно клинически не проявляются и бывают обнаружены случайным образом при выполнении КТ/МРТ головного мозга по причине черепно-мозговой травмы, мигрени, головокружения итд.
В остальных случаях манифестация заболевания представляет собой пароксизимальную симптоматику (эпилепсию) в самых разнообразных проявлениях. Достаточно редко диффузные глиомы вызывают неврологический дефицит.
Компьютерная томография в диагностике диффузных глиом имеет ограниченный характер. не всегда соответствующие изменения могут быть верно интерпретированы рентгенологом (и нейрохирургом).
«Золотым стандартом» исследования является МРТ. МР-семиотика диффузных глиом достаточно однозначна: они выглядят гипоинтенсивными в Т1WI и гиперинтенсивными в T2WI и FLAIR (NB! в редких случаях несоответствия режимов T2WI и FLAIR практически со 100%-ной вероятностью речь идет об астроцитоме с мутацией IDH1/2). Диффузные глиомы обычно расположены в белом веществе мозга, но олигодендроглиомы чаще вовлекают кору и содержат петрификаты (соли кальция).
Диффузные глиомы редко накапливают контрастный препарат при МР-исследовании, однако и его наличие не может является достоверным признаком принадлежности опухоли к другой гистологической группе (анапластическая астроцитома или анапластическая олигодендроглиома). Для исключения/подтверждения этого диагноза необходимо выполнить ПЭТ-КТ головного мозга с 11С-метионином.
Прогностические маркеры диффузной глиомы
Открытие генетических маркеров диффузных и злокачественных глиом определило необходимость очередного пересмотра всей классификации опухолей ЦНС в 2016 году.
Основным маркером для опухолей этой группы является мутация IDH½. Его присутствие статистически достоверно связано с лучшим прогнозом лечения астроцитарных глиом.
Для постановки диагноза олигодендроглиомы его наличие необходимо (как и ко-делеции 1p/19q).
MGMT-статус: его определение целесообразно только в группе IDH-негативных глиом для выбора схемы адъювантной терапии.
Известный факт биологического поведения диффузных глиом — в течение 7−10 (иногда более) лет они подвергаются малигнизации (озлокачествления), переходя в группу злокачественных глиом grade III-IV. (Клинический случай №4).
Лечение диффузной глиомы
Основной метод лечения пациентов с диффузными глиомами – хирургический. Операция позволяет получить материал для морфологического и генетического исследований и тем самым установить точный диагноз.
Другой задачей хирургического лечения является максимально радикальное удаление опухоли с сохранением функционального статуса пациента.
К сожалению, предсказать по снимку, к какой из 3 групп диффузных глиом относится та или иная опухоль (за исключением редких наблюдений с феноменом T2/FLAIR mismatch, см выше) невозможно. В связи с этим хирургическое вмешательство представляется достаточно обоснованным для определения дальнейшей тактики лечения.
При этом диффузные глиомы обладают низкой скоростью роста и в случае бессимптомного течения (при отсутствии эпиприступов) решиться пациенту на операцию бывает достаточно сложно.
NB! В настоящее время не существует международного протокола относительно выбора времени хирургического вмешательства для пациентов с диффузными глиомами, иными словами, нет статистически достоверного доказательства того, что прогноз лечения пациентов, оперированных непосредственно после установления диагноза диффузной глиомы лучше, чем у тех, у кого вмешательство было отложено до появления признаков прогрессии (увеличения размеров) опухоли.
Зачастую на консультации нейрохирурга вы можете услышать рекомендацию удалять опухоль не откладывая, «поскольку это опухоль, и она будет расти». Безусловно, этот подход обоснован и имеет право на существование. Но, принимая такое решение, нужно обязательно оценить локализацию опухоли, ее взаимоотношение с функционально значимыми зонами мозга, риск развития неврологического дефицита после операции и только после этого определиться со сроками вмешательства.
Противники раннего хирургического лечения основывали свои рекомендации пациентам на гипотезе о том, что хирургическое вмешательство, особенно при неполном удалении опухоли, стимулирует остаточную ее часть к укоренному процессу малигнизации (озлокачествления). Однако проведенные позднее исследования с измерением объемов опухоли в динамике в 2 группах пациентов (не оперированных и оперированных с частичным удалением), показали, что скорость роста опухолей в 2 группах была идентичной.
Мое глубокое убеждение заключается в том, что задача врача – предоставить максимально полную информацию о данном заболевании пациенту, не «подталкивая» его к тому или иному варианту лечения.
При отсутствии клинических проявлений опухоли и особенно в случае локализации ее в функционально значимой зоне (а диффузные глиомы достаточно часто обнаруживаются именно в них) я предлагаю пациенту выполнить как минимум 1 контрольное МРТ и оценить динамику размеров опухоли, а затем, на основании полученных данных, принять решение о тактике лечения. Безусловно, такой подход правомочен в группе молодых пациентов с глиомами, не накапливающими контрастный препарат.
Многие мои коллеги придерживаются схожей тактики, однако не следует забывать, что в этом случае оценка динамики размеров опухоли должна выполняться строго по протоколу:
— исследование должно проводиться на одном и том же аппарате МРТ с одинаковой толщиной срезов
— обязательно введение контрастного препарата
— оценка динамики должна производиться между первым и последним исследованиями, а не между предпоследним и последним!
— следует оценивать не 3 максимальных измерения опухоли, а весь ее объем. К сожалению, эта методика достаточно трудоемка, требует специальных навыков и программного обеспечения, поэтому подавляющее большинство нейрохирургов на консультации оценивает динамику размеров опухоли «на глаз», сравнивая нерелевантные (по срокам) исследования и рискуя получить противоположные результаты.
Источник