- Мутации гена PIK3CA
- PI3K-зависимый молекулярный каскад в патогенезе ГР+ HER2- РМЖ
- Частота встречаемости мутации гена PIK3CA в ГР+ HER2- распространенном РМЖ
- Определение мутации гена PIK3CA
- Прогностическая и предиктивная роль мутации гена PIK3CA
- Ген pik3ca что это значит
- Ген pik3ca что это значит
- Универсальная роль фосфатидил-инозитол-3-киназы
- Строение и тканевая специфичность PI3K
- Онкогенная активация PI3K-Akt-mTOR молекулярного каскада
- Мутация гена PIK3CA и потеря функции белка PTEN – одни из самых частых молекулярно-генетических изменений при различных биологических подтипах РМЖ
- Применение ингибиторов mTOR и CDK4/6 пациентами с PIK3CA+ РМЖ. Прогностическое и/или предиктивное значение мутации гена PIK3CA
Мутации гена PIK3CA
Тестирование на наличие мутации гена PIK3CA в рамках программы «Совершенствование молекулярно-генетической диагностики в Российской Федерации» выполняется в целях определения прогноза у пациентов c диагнозом распространенный или метастатический ГР+ HER2- рак молочной железы (IIIB-IV стадии).
PI3K-зависимый молекулярный каскад в патогенезе ГР+ HER2- РМЖ
Эндокринная терапия (ЭТ) является основной опцией для лечения пациентов с гормонозависимыми подтипами РМЖ. Клиническую пользу от применения препаратов, контролирующих продукцию эстрогена и/или прогестерона, получают ≈50% больных с ГР+ HER2- рРМЖ [1].
Развитие резистентности к ЭТ обусловлено взаимодействием множества молекулярных каскадов, вовлеченных в процессы роста и развития опухоли [1]. Так, нарушение регуляции сигнального каскада PI3K-Akt-mTOR наблюдается в более 70% случаев РМЖ. Одной из причин патологической активации сигнального пути PI3K-Akt-mTOR является мутация гена PIK3CA (PIK3CA+), кодирующего фосфатидил-инозитол-3-киназу (PI3K).
Частота встречаемости мутации гена PIK3CA в ГР+ HER2- распространенном РМЖ
Мутации гена PIK3CA (PIK3CA+) распространена в 40% случаев ГР+ HER2- рРМЖ и определяет резистентность опухоли к ЭТ [2].
Адаптировано на основании: 1. Miller TW, et al. J Clin Oncol. 2011; 29(33):4452-4461. 2. Bosch A, et al. Sci Transl Med. 2015; 7(283):283ra51. 3. Mayer IA, et al. Clin Cancer Res. 2017; 23(1):26-34. 4. Loi S, et al. Proc Natl Acad Sci U S A. 2010; 107(22):10208-10213. 5. Stemke-Hale K, et al. Cancer Res. 2008; 68(15):6084-6091. 6. Miller TW, et al. J Clin Invest. 2010; 120(7):2406-2413. 7. Crowder RJ, et al. Cancer Res. 2009; 69(9):3955-3962. 8. Miller TW, et al. Cancer Discovery. 2011; 1(4):338-351; 9. Vogt PK, et al., Cancer Discov. 2011 Nov; 1(6):481-486. 10. Saran U, et al. Clin Sci (Lond). 2015 Nov; 129(10):895-914. doi: 10.1042/CS20150149.
Определение мутации гена PIK3CA
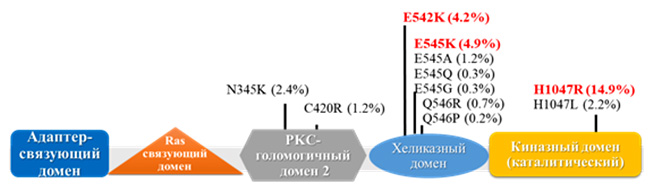
Большинство мутаций гена PIK3CA локализованы в определенных областях экзонов 9 и 20 [3].
Соматические мутации гена PIK3CA в раке молочной железы
Экзон 20 кодирует каталитический домен р110α, и мутации в этом домене гена PIK3CA могут прямо стимулировать конститутивную ферментативную активность PI3K. Экзон 9 кодирует хеликазный домен р110α, и мутация в этом домене подавляют ингибирующее взаимодействие N-концевого участка р85 с р110α. Часть более редких мутаций обнаружена в домене, кодирующем N-концевой участок р110α, взаимодействующий с р85. И такой тип мутаций усиливает липидную активность PI3K, но не влияет на образование комплекса р85α – р110α [3].
В опухолевых клетках РМЖ определен спектр наиболее характерных изменений в гене PIK3CA, определяющий патологическую активацию каскада PI3K-Akt-mTOR. Высокая частота миссенс-мутаций в 9 и 20 экзонах соответствует аминокислотам E542K и E545K в экзоне 9 хеликазного домена; в экзоне 20 киназного домена – H1047R и H1047L; наиболее частая мутация для люминального А подтипа РМЖ – E545K [4,5].
Прогностическая и предиктивная роль мутации гена PIK3CA
Появление мутаций гена PIK3CA в канцерогенезе ассоциировано с повышением степени злокачественности опухоли (отсутствие мутаций при G1 в сравнении с 20% при G3) и достоверно снижает безрецидивную выживаемость в общей группе пациентов с диагнозом РМЖ III стадии в сравнении с пациентами без мутации и (p
Список цитируемой литературы:
- AlFakeeh A & Brezden-Masley C. Overcoming endocrine resistance in hormone receptor-positive breast cancer. Curr Oncol. 2018 Jun; 25(Suppl 1): S18-S27.
- Juric D, Ciruelos EM, Rubovszky G, et al. Alpelisib (ALP) + fulvestrant (FUL) for advanced breast cancer (ABC): Phase 3 SOLAR-1 trial results. Presented at: 2018 San Antonio Breast Cancer Symposium; December 4-8, 2018; San Antonio, Texas. Abstract GS3-08.
- Liu W, et al. PIK3CA Mutations May Be Discordant between Primary and Corresponding Metastatic Disease in Breast Cancer. Clin. Cancer Res. 2010. Vol.17, no.4, P.667-677.
- Dogruluk T, et al. Identification of Variant-Specific Functions of PIK3CA by Rapid Phenotyping of Rare Mutations. Cancer Res. Dec. 2015. Vol.75, no.24, P.5341-5354.
- Kalinsky K, et al. PIK3CA Mutation Associates with Improved Outcome in Breast Cancer. Clin. Cancer Res. Aug. 2009. Vol.15, no.16, P.5049-5059.
- Filipenko ML, et al. Association between the Prevalence of Somatic Mutations in PIK3CA Gene in Tumors and Clinical and Morphological Characteristics of Breast Cancer Patients. Bull. Exp. Biol. Med. 2017. Vol.163, no.2, P.250-254.
- Anderson EJ, et al. A systematic literature review of the clinical prognosis of HR+/HER2- advanced or metastatic breast cancer with and without PIK3CA mutation. J. Clin. Oncol. May 2018. Vol.36, no.15_suppl, e13037-e13037.
- Hortobagyi GN, et al. Correlation of molecular alterations with efficacy of everolimus in hormone receptor-positive, HER2-negative advanced breast cancer: Results from BOLERO-2. J. Clin. Oncol. Jun. 2013. Vol.31, no.18_suppl, LBA509-LBA509.
- Neven P, et al. 346PRibociclib (RIB) + fulvestrant (FUL) in hormone receptor-positive (HR+), human epidermal growth factor receptor 2-negative (HER2-) advanced breast cancer (ABC): MONALEESA-3 biomarker analyses. Ann. Oncol. Oct. 2018. Vol.29, suppl_8.
- Huang X, et al. Early circulating tumor DNA dynamics and clonal selection with palbociclib and fulvestrant for breast cancer. Nat. Commun. 2018. Vol.9, no.1, P.1-10.
Войти
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Источник
Ген pik3ca что это значит
Наличие мутации гена PIK3CA — предиктор ответа на таргетную терапию ингибитором PI3K у пациентов с распространенным или метастатическим раком молочной железы, имеющих положительный статус гормональных рецепторов и отрицательный статус HER2, с прогрессированием заболевания во время/после проведения режимов эндокринной терапии.
PIK3CA, мутация PIK3CA, рак молочной железы, алпелисиб.
Синонимы английские
PIK3CA, PIK3CA mutation, breast cancer, alpelisib.
Какой биоматериал можно использовать для исследования?
Образец ткани, образец ткани в парафиновом блоке.
Общая информация об исследовании
Ген PIK3CA (каталитическая субъединица фосфатидилинозит-4,5-бисфосфат-3-киназы альфа) кодирует субъединицу p110a фосфатидил-3-киназы. Играет ключевую роль в пути PI3K-AKT-mTOR. Соматические мутации в гене PIK3CA участвуют в патогенезе нескольких видов рака, включая колоректальный рак, глиальные опухоли, рак желудка, рак молочной железы, рак тела матки и рак легкого. Мутации PIK3CA обычно возникают в экзоне 9, который кодирует спиральный домен, и экзоне 20, который кодирует домен киназы.
Мутации в компонентах пути PI3K часто наблюдаются при ER (рецептор эстрогена) — положительном раке молочной железы. В частности, мутации в PIK3CA выявляются более чем в 40 % ER-положительных опухолей молочной железы. Мутации PIK3CA — негативный прогностический маркер при HR+ (гормональный рецептор) — распространенном раке молочной железы. Селективные к альфа-изоформам ингибиторы PI3K продемонстрировали многообещающую активность при эндокринно-резистентном, PIK3CA-мутантном HR-положительном распространенном раке молочной железы. В частности, специфический для альфа-изоформы ингибитор PI3K альпелисиб одобрен FDA для лечения таких видов опухолей в сочетании с фулвестрантом.
Для чего используется исследование?
- Для определения показаний к применению таргетной терапии ингибитором PI3K.
Когда назначается исследование?
- Рекомендовано всем пациентам с распространенным или метастатическим раком молочной железы, имеющим положительный статус гормональных рецепторов и отрицательный статус HER2, с прогрессированием заболевания во время/после проведения эндокринной терапии для определения возможности применения таргетной терапии.
Что означают результаты?
Мутаций в 9-м и 20-м экзонах гена PIK3CA не обнаружено.
Обнаружена патогенная мутация E542K/E545K/E545Q в 9-м экзоне гена PIK3CA, ассоциированная с эффективностью применения ингибитора PI3K.
Обнаружена патогенная мутация H1047L/H1047R в 20-м экзоне гена PIK3CA, ассоциированная с эффективностью применения ингибитора PI3K.
Для получения заключения по результату обследования необходимо проконсультироваться у врача-онколога.
Кто назначает исследование?
- André F, Ciruelos E, Rubovszky G, et al. Alpelisib for PIK3CA-Mutated, Hormone Receptor-Positive Advanced Breast Cancer. N Engl J Med 2019; 380:1929.
- Rugo HS, Lerebours F, Ciruelos E, et al. Alpelisib (ALP) + fulvestrant (FUL) in patients (pts) with PIK3CA-mutated (mut) hormone receptor-positive (HR+), human epidermal growth factor receptor 2-negative (HER2–) advanced breast cancer (ABC) previously treated with cyclin-dependent kinase 4/6 inhibitor (CDKi) + aromatase inhibitor (AI): BYLieve study results. J Clin Oncol 2020; 38S: ASCO #1006.
- Baselga J, Dent SF, Cortes J, et al. Phase III study of taselisib (GDC-0032) + fulvestrant (FULV) v FULV in patients (pts) with estrogen receptor (ER)-positive, PIK3CA-mutant (MUT), locally advanced or metastatic breast cancer (MBC): Primary analysis from SANDPIPER. J Clin Oncol 2018; 36S: ASCO #1006.
Источник
Ген pik3ca что это значит
1) Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия; 2) Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия; 3) ООО «Новартис Фарма», Москва, Россия
Принципы лечения HR+-HER2-метастатического рака молочной железы (мРМЖ) в течение длительного периода времени оставались неизменными. Последовательное применение различных вариантов эндокринотерапии обеспечивало значимое увеличение показателей общей и безрецидивной выживаемости при сохранении высокого качества жизни. Однако с течением времени пациенты прогрессируют в связи с развитием резистентности к проводимому лечению. Изучение причин и способов преодоления резистентности к гормонотерапии привело к раскрытию новых мощных возможностей лечения пациентов с HR+-HER2-мРМЖ. В развитии невосприимчивости к эндокринной терапии фундаментальная роль отведена перекрестным взаимодействиям различных сигнальных каскадов в клетке в результате приобретенных мутаций рецепторов эстрогенов. Нарушение функционирования PI3K-опосредованного каскада представляет собой самое частое нарушение при РМЖ и ассоциировано с резистентностью к эндокринной терапии. Фосфатидил-инозитол-3 киназа (PI3K) уже много лет привлекает пристальное внимание ученых как ключевой координатор процессов роста и жизнедеятельности клетки. В текущем обзоре приведены основные положения, характеризующие клиническую значимость мутации гена PIK3CA, кодирующего киназу PI3K: прогностическая и предиктивная роль мутации гена PIK3CA (PIK3CA+) во всех подтипах РМЖ; а также обосновывается выделение особой группы пациентов, нуждающихся в терапии, подавляющей активность PI3K.
Для цитирования: Семиглазова Т.Ю., Сорокина И.В. Прогностическое и предиктивное значения мутации гена PIK3CA у больных раком молочной железы. Фарматека. 2019;26(7):10–20. DOI: https://dx.doi.org/10.18565/pharmateca.2019.7.10-20
Универсальная роль фосфатидил-инозитол-3-киназы
За последние 20 лет было предпринято множество попыток создания эффективного и безопасного ингибитора фосфатидил-инозитол-3-киназы (PI3K). Однако комплексная и мультифункциональная роль PI3K в процессах жизнедеятельности клетки я стали причиной многих таких попыток и неудач.
Молекулярный каскад PI3K/Akt/mTOR представляет собой ключевую и универсальную систему, характерную для большинства клеток человека. PI3K/Akt/mTOR вовлечен в регуляцию основных процессов жизнедеятельности клетки, включая рост, пролиферацию и выживание [1]. На сегодняшний день результаты множества исследований данного сигнального пути являются PI3K, протеинкиназа B (Akt, англ. RAC-alpha serine/threonine-protein kinase, Protein kinase B alpha) и молекулярная мишень рапамицина млекопитающих (mTOR, англ. mammalian target of rapamycin).
Семейство фосфатидил-инозитол-3-киназ – один из важнейших регуляторных белков, находящихся на пересечении различных сигнальных путей и контролирующих ключевые функции клетки [3]. Обнаруженная у PI3K двойная ферментативная активность (липид- и протеинкиназная), а также способность активировать ряд сигнальных белков определяют принципиальное значение PI3K в регуляции таких функций клетки, как метаболизм, дифференцировка, миграция, рост, выживаемость, старение и онкогенная трансформация [4].
Строение и тканевая специфичность PI3K
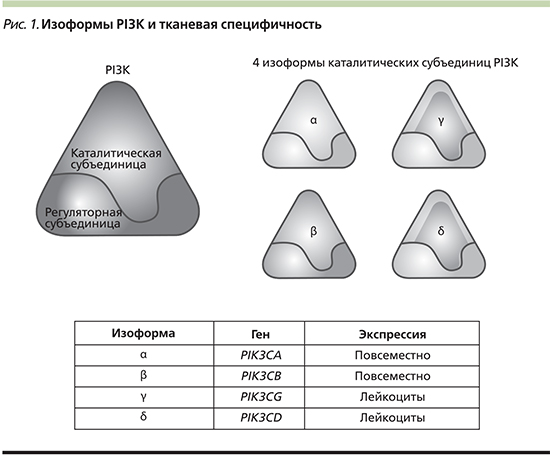
Семейство PI3K представлено 3 классами (I, II и III), которые отличаются по структурной организации, субстратной специфичности и функциям в клетке. Причем среди всех классов класс I семейства PI3K играет важную роль в процессе онкогенной трансформации [4].
Молекула PI3K представляет собой гетеродимер и состоит из двух субъединиц: каталитической и регуляторной, каждая из которых кодируется разными генами (рис. 1). Молекула PI3K класса IA представлена комплексом из каталитической субъединицы р110 (изоформы р110α, р110β, р110γ, р110δ) и регуляторной субъединицы р85 (изоформы р85α, р55α, р50α), р85β и р55γ) и вовлечена непосредственно в канцерогенез [5]. Гомологичные субъединицы p110α, p110β и p110δ кодируются генами PIK3CA, PIK3CB и PI3KCD соответственно. Класс IB представлен геном PIK3CG, который кодирует каталитическую субъединицу p110γ [6]. Изоформы p110α и p110β экспрессируются во всех тканях организма, в то время как экспрессия p110δ и p110γ ограничена только гематопоэтическими и иммунными клетками [4].
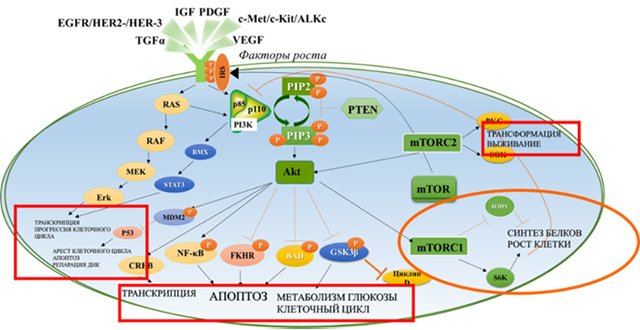
Онкогенная активация PI3K-Akt-mTOR молекулярного каскада
Онкогенная активация сигнального каскада PI3K-Akt-mTOR наряду с патологическим функционированием MAPK-опосредованного пути считаются одними из самых частых нарушений, наблюдающихся на различных этапах канцерогенеза (рис. 2). Аномальная активация PI3K-Akt-mTOR может быть реализована минимум тремя независимыми путями. Во-первых, молекула PI3K воспринимает и опосредует множество внеклеточных сигналов, поступающих от активированных факторами ростами рецепторов на поверхности клетки (таких, как IGF-1, EGFR, HER2, VEGF, ALK, c-Met, c-Kit, PDGF, TGFα; рис. 2) [2, 7, 8–10]. При взаимодействии фактора роста с рецептором тирозинкиназы происходит димеризация последнего. Далее образуется комплекс димера с регуляторной субъединицей PI3K–р85, что служит триггером для активации каталитической субъединицы р110α, в дальнейшем – и всего сигнального каскада. При избыточном поступлении ростовых факторов или наличия активирующей мутации в генах, кодирующих рецепторы тирозинкиназ, происходит постоянная активация PI3K, а следовательно, и сигнального пути PI3K-Akt-mTOR (рис. 2).
Другой причиной патологического функционирования PI3K-Akt-mTOR является потеря активности или подавление экспрессии генов, кодирующих негативный регулятор молекулярного каскада, онкосупрессор, белок PTEN. Потеря функции PTEN часто коррелирует с конститутивной активацией молекулы mTOR, привнося свой вклад в развитие неоплазии [11].
Амплификация или мутация в гене PIK3CA, кодирующем α-изоформу каталитической субъединицы р110-PI3K, относится к одной из наиболее распространенных причин гиперактивации PI3K-опосредованного сигнального каскада [11]. Мутации гена PIK3CA (PIK3CA+) являются соматическими и встречаются с различной частотой во многих опухолях человека, включая РМЖ, рак простаты, колоректальный рак, рак матки, рак яичников, рак легкого, опухоли головы и шеи, лимфомы, рак поджелудочной железы, рак желудка, рак пищевода, рак щитовидной железы, рак печени и глиобластому [12, 13].
PIK3CA+ приводит к развитию процессов онкогенной трансформации, являясь причиной конститутивной стимуляции сигнального каскада PI3K–Akt–mTOR независимо от наличия факторов роста и активации рецепторов тирозинкиназ [6]. В ряде исследований доказано, что наличие PIK3CA+ ассоциировано с резистентностью к таргетной терапии, направленной на подавление функции рецепторов факторов роста (к терапии трастузумабом для HER2+-РМЖ и к анти-EGFR-терапии в лечении немелкоклеточного рака легкого с драйверными мутациями гена, кодирующего EGFR) [14–16]. По данным доклинических исследований установлено, что экспрессия PIK3CA+ в фибробластах и эпителиальных клетках молочной железы приводит к трансформации, неконтролируемой факторами роста пролиферации и резистентности к апоптозу [17, 18]. У трансгенных мышей, экспрессирующих PIK3CA+ с мутацией киназного домена р110α типа H1047R, развивалась аденокарцинома легкого [16]. Амплификация гена PIK3CA в большинстве случаев характерна для опухолей яичников. Однако ее роль в активации PI3K пока не установлена [6].
Мутация гена PIK3CA и потеря функции белка PTEN – одни из самых частых молекулярно-генетических изменений при различных биологических подтипах РМЖ
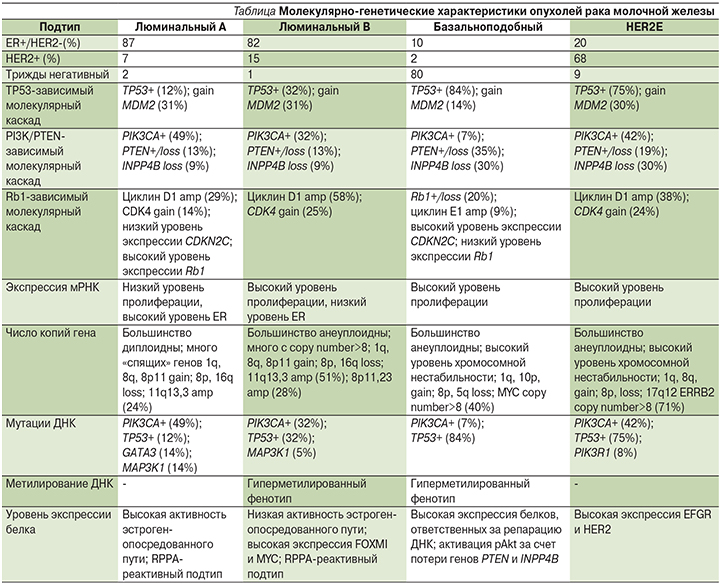
Мутация гена PIK3CA и потеря функции белка PTEN (PTEN-) – одни из самых частых молекулярно-генетических изменений при РМЖ, встречающихся во всех его подтипах с различной частотой (см. таблицу) [19].
Частота встречаемости PIK3CA+ и PTEN- составляет:
- для люминального А подтипа 49 и 13% соответственно;
- для люминального B 32 и 13% соответственно;
- для HER2-обогащенного (HER2E) 42 и 19% соответственно;
- и для базальноподобного 7 и 35% соответственно.
Высокая частота встречаемости мутаций гена PIK3CA при гормонозависимом РМЖ предполагает их доминирующую роль в процессе опухолевой дифференцировки люминальных подтипов [11].
Создание препаратов, направленных на ингибирование PI3K, строго обосновано знаниями молекулярно-генетических характеристик опухолей и является рациональным подходом к лечению онкологических пациентов в целом и особенно больных РМЖ.
В пользу экспансии мутированных клонов PIK3CA в процессах развития и малигнизации РМЖ свидетельствуют следующие факты:
- высокая частота встречаемости PIK3CA+ при распространенном РМЖ [11, 20];
- факт стимуляции патологической экспрессии PI3K в ответ на длительное применение ингибиторов CDK4/6 [21, 22];
- доказанная эффективность комбинации ингибитора PI3K и эндокринотерапии для преодоления резистентности к ингибиторам CDK4/6 по результатам преклинических исследований [22, 23].
Применение ингибиторов mTOR и CDK4/6 пациентами с PIK3CA+ РМЖ. Прогностическое и/или предиктивное значение мутации гена PIK3CA
Применение ингибиторов mTOR пациентами с PIK3CA+ РМЖ
Биологически направленная терапия, подавляющая действие центральных участников PI3K–Akt–mTOR-каскада привлекает внимание ученых уже много лет. Первым успешным препаратом стал ингибитор комплекса mTORC1 эверолимус.
Эверолимус одобрен FDA на основании регистрационного исследования BOLERO-2. В нем показана эффективность эверолимуса в комбинации с экземестаном для больных HR+- HER2-РМЖ в постменопаузе, получавших в адъювантном режиме нестероидные ингибиторы ароматазы [24].
В исследовании показано, что совместное ингибирование компенсаторного сигнального каскада при помощи эверолимуса удваивало медиану выживаемости без прогрессирования (ВБП) с 3,2 до 7,8 месяца (ОР=0,45; 95% ДИ – 0,38–0,54; p
1. Ciruelos Gil E.M. Targeting the PI3K/AKT/mTOR pathway in estrogen receptor-positive breast cancer. Cancer Treat Rev. 2014;40(7):862–71. Doi: 10.1016/j.ctrv.2014.03.004.
2. Mayer I.A., Abramson V.G., Formisano L., et al. A Phase Ib Study of Alpelisib (BYL719), a PI3Ka-Specific Inhibitor, with Letrozole in ERþ/HER2 Metastatic Breast Cancer. Clin Cancer Res. 2017;23(1):26–34. Doi: 10.1158/1078-0432.CCR-16-0134.
3. Dupont Jensen J., Laenkholm A.V., Knoop A., et al. PIK3CA Mutations May Be Discordant between Primary and Corresponding Metastatic Disease in Breast Cancer. Clin Cancer Res. 2011;17(4):667–77. Doi: 10.1158/1078-0432.CCR-10-1133.
4. Dey N., De P., Leyland-Jones B. PI3K-AKT-mTOR inhibitors in breast cancers: From tumor cell signaling to clinical trials. Pharmacol Ther. 2017;175:91–106. Doi: 10.1016/j.pharmthera.2017.02.037.
5. Janku F. Phosphoinositide 3-kinase (PI3K) pathway inhibitors in solid tumors: From laboratory to patients. Cancer Treat Rev. 2017;59:93–101. Doi: 10.1016/j.ctrv.2017.07.005.
6. Courtney K.D., Corcoran R.B., Engelman J.A. The PI3K pathway as drug target in human cancer. J Clin Oncol. 2010;28(6):1075–83. Doi: 10.1200/JCO.2009.25.3641.
7. Miller T.W., Rexer B.N., Garrett J.T., Arteaga C.L. Mutations in the phosphatidylinositol 3-kinase pathway: role in tumor progression and therapeutic implications in breast cancer. Breast Cancer Res. 2011;13(6):224. Doi: 10.1186/bcr3039.
8. Bosch A., Li Z., Bergamaschi A., et al. PI3K inhibition results in enhanced estrogen receptor function and dependence in hormone receptor–positive breast cancer. Sci Transl Med. 2015;7(283):283ra51. Doi: 10.1126/scitranslmed.aaa4442.
9. Miller T.W., Balko J.M., Fox E.M., et al. ER -Dependent E2F Transcription Can Mediate Resistance to Estrogen Deprivation in Human Breast Cancer. Cancer Discov. 2011;1(4):338–51. Doi: 10.1158/2159-8290.CD-11-0101.
10. Vogt P.K., Hart J.R., Gymnopoulos M., et al. Phosphatidylinositol 3-Kinase: The Oncoprotein. Curr Top Microbiol Immunol. 2010;347:79–104. Doi: 10.1007/82_2010_80.
11. Kaklamani V.G., Richardson A.L., Arteaga C.L. Exploring Biomarkers of Phosphoinositide 3‐Kinase Pathway Activation in the Treatment of Hormone Receptor Positive, Human Epidermal Growth Receptor 2 Negative Advanced Breast Cancer. Oncologist. 2019;24(3):305–12. Doi: 10.1634/theoncologist.2018-0314..
12. Samuels Y., Wang Z., Bardelli A., et al. High Frequency of Mutations of the PIK3CA Gene in Human Cancers. Science. 2004;304(5670):554.
13. Samuels Y., Velculescu V.E. Oncogenic Mutations of PIK3CA in Human Cancers. Cell Cycle. 2004;3(10):1221–24.
14. Park B.H., Davidson N.E. PI3 Kinase Activation and Response to Trastuzumab Therapy: What’s neu with Herceptin Resistance? Cancer Cell. 2007;12(4):297–99.
15. Berns K., Horlings H.M., Hennessy B.T., et al. A Functional Genetic Approach Identifies the PI3K Pathway as a Major Determinant of Trastuzumab Resistance in Breast Cancer. Cancer Cell. 2007;12(4):395–402.
16. Engelman J.A., Mukohara T., Zejnullahu K., et al. Allelic dilution obscures detection of a biologically significant resistance mutation in EGFR-amplified lung cancer. J Clin Invest. 2006;116(10):2695–706.
17. Isakoff S.J., Engelman J.A., Irie H.Y., et al. Breast Cancer–Associated PIK3CA Mutations Are Oncogenic in Mammary Epithelial Cells. Cancer Res. 2005;65(23):10992–1000.
18. Zhao J.J., Liu Z., Wang L., et al. The oncogenic properties of mutant p110 and p110 phosphatidylinositol 3-kinases in human mammary epithelial cells. Proc Natl Acad Sci USA. 2005;102(51):18443–448.
19. Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast tumours. Nature. 2012;490(7418):61–70. Doi: 10.1038/nature11412.
20. Herrera-Abreu M.T., Palafox M., Asghar U., et al. Early Adaptation and Acquired Resistance to CDK4/6 Inhibition in Estrogen Receptor–Positive Breast Cancer. Cancer Res. 2016;76(8):2301–13. Doi: 10.1158/0008-5472.CAN-15-0728.
21. Cortés J., Im S.A., Holgado E., et al. The next era of treatment for hormone receptor-positive, HER2-negative advanced breast cancer: Triplet combination-based endocrine therapies, Cancer Treat Rev. 2017;61:53–60. Doi: 10.1016/j.ctrv.2017.09.011.
22. O’Brien N.A., et al. Abstract 4150: Anti-tumor activity of the PI3K/mTOR pathway inhibitors alpelisib (BYL719) and everolimus (RAD001) in xenograft models of acquired resistance to CDK-4/6 targeted therapy. Cancer Res. 2017;13(77):4150–50.
23. Lenihan C., et al. Abstract P3-06-02: Characterization of resistance to the selective CDK4/6 inhibitor palbociclib in ER positive breast cancer. Cancer Res. 2016;4(76):P3-06-02-P3-06–02.
24. Baselga J., Campone M., Piccart M., et al. Everolimus in Postmenopausal Hormone-Receptor–Positive Advanced Breast Cancer. N Engl J Med. 2012;6(366):520–29. Doi: 10.1056/NEJMoa1109653
25. Beck J.T., Hortobagyi G.N., Campone M., et al. Everolimus plus exemestane as first-line therapy in HR+, HER2- advanced breast cancer in BOLERO-2. Breast Cancer Res Treat. 2014;143(3):459–67. Doi: 10.1007/s10549-013-2814-5.
26. Piccart M., Hortobagyi G.N., Campone M., et al. Everolimus plus exemestane for hormone-receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer: overall survival results from BOLERO-2. Ann Oncol. 2014;25(12):2357–62. Doi: 10.1093/annonc/mdu456.
27. Hortobagyi G.N., et al. Correlation of molecular alterations with efficacy of everolimus in hormone receptor–positive, HER2-negative advanced breast cancer: Results from BOLERO-2. J. Clin. Oncol. 2013;18(31):LBA509-LBA509.
28. Chen Z., et al. 345P Everolimus-based therapy versus conventional therapy for refractory breast cancer patients with PI3K/AKT/mTOR mutations. Ann Oncol. 2018;8:29.
29. Juric D., Janku F., Rodón J., et al. Alpelisib Plus Fulvestrant in PIK3CA -Altered and PIK3CA -Wild-Type Estrogen Receptor–Positive Advanced Breast Cancer. JAMA Oncol. 2018:e184475. Doi: 10.1001/jamaoncol.2018.4475.
30. Neven P., et al. 346P Ribociclib (RIB)+fulvestrant (FUL) in hormone receptor-positive (HR+), human epidermal growth factor receptor 2-negative (HER2-) advanced breast cancer (ABC): MONALEESA-3 biomarker analyses. Ann Oncol. 2018;29:8
31. O’Leary B., Hrebien S., Morden J.P., et al. Early circulating tumor DNA dynamics and clonal selection with palbociclib and fulvestrant for breast cancer. Nat Commun. 2018;9(1):896. Doi: 10.1038/s41467-018-03215-x.
32. Dogruluk T., Tsang Y.H., Espitia M., et al. Identification of Variant-Specific Functions of PIK3CA by Rapid Phenotyping of Rare Mutations. Cancer Res. 2015;75(24):5341–54. Doi: 10.1158/0008-5472.CAN-15-1654.
33. Kalinsky K., Jacks L.M., Heguy A., et al. PIK3CA Mutation Associates with Improved Outcome in Breast Cancer. Clin Cancer Res. 2009;15(16):5049–59. Doi: 10.1158/1078-0432.CCR-09-0632.
34. Moynahan M.E., Chen D., He W., et al. Correlation between PIK3CA mutations in cell-free DNA and everolimus efficacy in HR+, HER2− advanced breast cancer: results from BOLERO-2. Br J Cancer. 2017;116(6):726–30. Doi: 10.1038/bjc.2017.25.
35. Baselga J., Im S.A., Iwata H., et al. Buparlisib plus fulvestrant versus placebo plus fulvestrant in postmenopausal, hormone receptor-positive, HER2-negative, advanced breast cancer (BELLE-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2017;18(7):904–16. Doi: 10.1016/S1470-2045(17)30376-5.
36. Di Leo A., Johnston S., Lee K.S., et al. Buparlisib plus fulvestrant in postmenopausal women with hormone-receptor-positive, HER2-negative, advanced breast cancer progressing on or after mTOR inhibition (BELLE-3): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2018;19(1):87–100. Doi: 10.1016/S1470-2045(17)30688-5.
37. Juric D., Ciruelos E.M., et al. Alpelisib (ALP)+fulvestrant (FUL) for advanced breast cancer (ABC): Phase 3 SOLAR-1 trial results. Present. San Antonio Breast Cancer Symp. (Abstract GS3–08).
38. Aleskandarany M.A., Soria D., Green A.R., et al. Markers of progression in early-stage invasive breast cancer: a predictive immunohistochemical panel algorithm for distant recurrence risk stratification. Breast Cancer Res Treat. 2015;151(2):325–33. Doi: 10.1007/s10549-015-3406-3.
39. Talmadge J.E., Fidler I.J. AACR centennial series: The biology of cancer metastasis: Historical perspective. Cancer Res. 2010;70(14):5649–69. Doi: 10.1158/0008-5472.CAN-10-1040.
40. Aleskandarany M.A., Negm O.H., Green A.R., et al. Epithelial mesenchymal transition in early invasive breast cancer: an immunohistochemical and reverse phase protein array study. Breast Cancer Res Treat. 2014;145(2):339–48. Doi: 10.1007/s10549-014-2927-5.
41. Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell. 2011;144(5):646–74. Doi: 10.1016/j.cell.2011.02.013.
42. Fang X., Cai Y., Liu J., et al. Twist2 contributes to breast cancer progression by promoting an epithelial–mesenchymal transition and cancer stem-like cell self-renewal. Oncogene. 2011;30(47):4707–20. Doi: 10.1038/onc.2011.181.
43. Qiu J., Xue X., Hu C., et al. Comparison of Clinicopathological Features and Prognosis in Triple-Negative and Non-Triple Negative Breast Cancer. J Cancer. 2016;7(2):167–73. Doi: 10.7150/jca.10944.
44. Ramis-Conde I., Chaplain M.A., Anderson A.R., Drasdo D. Multi-scale modelling of cancer cell intravasation: the role of cadherins in metastasis. Phys Biol. 2009;6(1):016008. Doi: 10.1088/1478-3975/6/1/016008.
45. Filipenko M.L., Os’kina N.A., Oskorbin I.A., et al. Association between the Prevalence of Somatic Mutations in PIK3CA Gene in Tumors and Clinical and Morphological Characteristics of Breast Cancer Patients. Bull Exp Biol Med. 2017;163(2):250–54. Doi: 10.1007/s10517-017-3777-z.
46. Anderson E.J. et al. A systematic literature review of the clinical prognosis of HR+/HER2- advanced or metastatic breast cancer with and without PIK3CA mutation. J Clin Oncol. 2018;15(36):e13037–e13037.
47. Fan H., Li C., Xiang Q., et al. PIK3CA mutations and their response to neoadjuvant treatment in early breast cancer: A systematic review and meta-analysis, Thorac Cancer. 2018;9(5):571–79. Doi: 10.1111/1759-7714.12618.
Источник