- Дигидротестостерон (ДГТ)
- Где сдать анализ Дигидротестостерон (ДГТ)
- Дигидротестостерон у женщин повышен что это значит у женщин
- Гиперандрогения — симптомы и лечение
- Определение болезни. Причины заболевания
- Распространённость
- Причины
- Симптомы гиперандрогении
- Патогенез гиперандрогении
- Роль андрогенов
- Избыток андрогенов
- Классификация и стадии развития гиперандрогении
- Истинная гиперандрогения
- Другие формы гиперадрогении
- Осложнения гиперандрогении
- Диагностика гиперандрогении
- Лечение гиперандрогении
- Способы удаления волос при гирсутизме
- Прогноз. Профилактика
Дигидротестостерон (ДГТ)
Другие названия: Dihydrotestosterone.
92093 Дигидротестостерон (ДГТ)
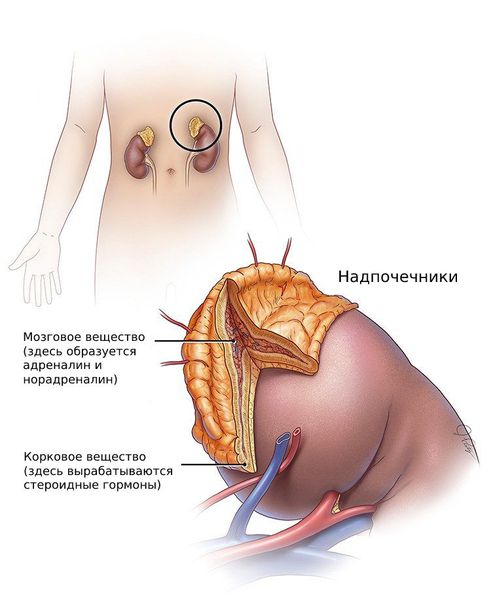
Дигидротестостерон — метаболит тестостерона, обладающий наиболее выраженным андрогенным эффектом. Дигидротестостерон (ДГТ) присутствует в организме и мужчин, и женщин. Образуется из тестостерона при участии 5α-редуктазы, подавляет секрецию лютеинизирующего гормона (ЛГ). У мужчин ДГТ синтезируется в яичках, и в меньшей степени в надпочечниках, до 70% образуется в периферических тканях из свободного тестостерона. У женщин главным местом синтеза являются надпочечники, и в меньшей степени яичники. Образуется ДГТ у женщин в основном из андростендиона. Концентрация дигидротестостерона наиболее высокая в коже гениталий и в волосяных фолликулах.
У мужчин ДГТ отвечает за развитие вторичных половых признаков, регулирует сексуальное поведение, стимулирует сперматогенез, играет ключевую роль в пролиферации клеток предстательной железы, что является одной из главных причин развития гиперплазии предстательной железы (ГППЖ)- это определяет использование препаратов, ингибирующих 5α-редуктазу для лечения ГППЖ. Поэтому, чрезмерное повышение уровня ДГТ, в том числе связанное с применением препаратов тестостерона, приводит к прогрессирующему росту предстательной железы. Во время курса лечения ингибиторами 5-альфа-редуктазы необходимо контролировать содержание ДГТ, которое взаимосвязано с размерами предстательной железы и используются для оценки эффективности данной терапии.
Снижение уровня дигидротестостерона может быть обусловлено как недостаточным синтезом тестостерона (при первичном или вторичном гипогонадизме), так и недостаточной активностью 5α-редуктазы. Сниженная секреция ДГТ в подростковом периоде у мальчиков будет проявляться нарушением полового созревания (анорхизм, крипторхизм, малые размеры гениталий либо аномалии строения полового члена, отсутствие оволосения, недостаточная мышечная масса). С возрастом низкий уровень ДГТ вызывает нарушение эректильной функции и снижение либидо.
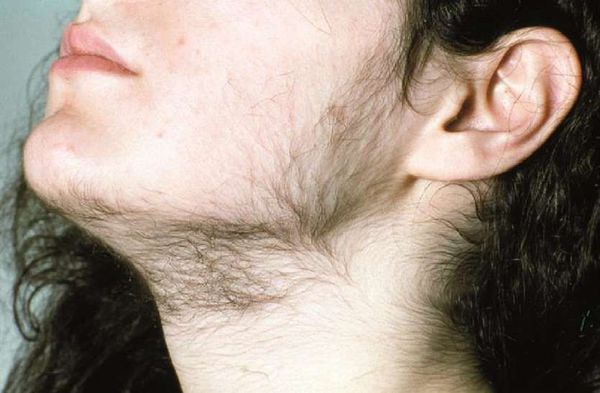
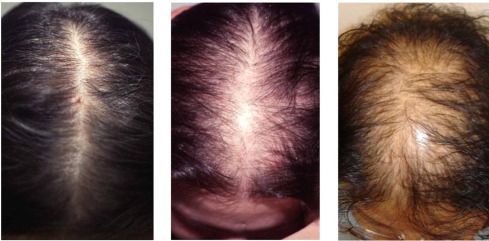
Избыток дигидротестостерона у обоих полов угнетает рост волос на голове и вызывает их усиленное выпадение — алопецию. У женщин повышенная секреция ДГТ ведет к серьезному нарушению гормонального фона, приводящему к гирсутизму, акне, отклонениям менструального цикла и даже бесплодию.
Показания к назначению:
- Оценка андрогенного статуса (совместно с тестостероном общим);
- выявление нарушений активности 5-альфа редуктазы;
- нарушение полового созревания у мальчиков;
- синдром Морриса;
- клиника гиперандрогении у женщин (гирсутизм, акне, нарушение ментструального цикла);
- алопеция у мужчин и женщин;
- клиника гипогонадизма у мужчин (эректильная дисфункция, снижение либидо, импотенция);
- доброкачественная гиперплазия предстательной железы;
- контроль эффективности лечения ГППЖ ингибиторами 5α-редуктазы
Метод: иммуноферментный анализ (ИФА)
Анализатор: ELISA, Demeditec (Германия) Analyzer (Германия)
Единицы измерения: пг/мл:
Материал для исследования: сыворотка венозной крови
Подготовка:
- Важным условием обеспечения качества лабораторного исследования крови является взятие материала натощак, в утреннее время (до 12:00).
- За 12 часов до исследования следует исключить прием алкоголя, курение, прием пищи, ограничить физическую активность.
- Утром в день взятия крови на исследование можно выпить воду.
- Исключить прием лекарств; если отменить прием лекарств невозможно, необходимо проинформировать об этом лабораторию.
- Взятие материала желательно проводить до проведения любых медицинских диагностических манипуляций.
- У мужчин необходимо отмечать лечение препаратами дигидротестостерона (лечение гипогонадизма) и ингибиторами 5альфа-редуктазы (при ГППЖ)
Интерпретация результатов:
Результат лабораторных исследований не является достаточным основанием для постановки диагноза. Интерпретация результатов и постановка диагноза осуществляется только лечащим врачом.
Референтные значения:
Женщины: 24,0-368,0 Женщины: (постменопауза): 10,0-181,0.
Мужчины: 250,0-990,0
Повышение уровня:
- аденома предстательной железы;
- андрогенная алопеция;
- андрогенпродуцирующие опухоли надпочечников и гонад;
- идиопатический гирсутизм;
- гипергонадизм;
- прием препаратов тестостерона;
- физиологическая беременность
- синдром гиперандрогении у женщин,
Понижение уровня:
- синдром Морриса;
- применение ингибиторов 5α-редуктазы;
- менопауза и постменопауза;
- первичный и вторичный гипогонадизм у мужчин;
- возрастной андрогенодефицит у мужчин;
- врождённый дефицит 5-альфа-редуктазы
Факторы, влияющие на результат:
Повышение:
Применение препаратов тестостерона (гормональная заместительная терапия).
Понижение:
Применение ингибиторов 5-альфа-редуктазы.
Где сдать анализ Дигидротестостерон (ДГТ)
Сдать анализ Дигидротестостерон (ДГТ) можно в любом пункте Синэво в Минске, Барановичах, Бобруйске, Борисове, Бресте, Витебске, Ганцевичах, Гомеле, Гродно, Жлобине, Лиде, Могилеве, Мозыре, Молодечно, Новогрудке, Новополоцке, Орше, Пинске, Полоцке, Речице, Светлогорске, Слуцке, Сморгони, Солигорске.
Источник
Дигидротестостерон у женщин повышен что это значит у женщин
Дигидротестостерон – это один из наиболее активных андрогенов (как у мужчин, так и у женщин), образующийся из тестостерона непосредственно в «органах-мишенях» с участием специального фермента (5-альфа-редуктазы).
Иммуноферментный анализ (ИФА).
Пг/мл (пикограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение за 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Дигидротестостерон (ДГТ) присутствует в организме и мужчин, и женщин. Он образуется из тестостерона только с помощью специального фермента – 5-альфа-редуктазы. У мужчин его продуцируют яички и в меньшей степени надпочечники, у женщин же, наоборот, в большей степени надпочечники и незначительно яичники.
До 70 % ДГТ у мужчин образуется в периферических тканях из свободного тестостерона под действием 5-альфа-редуктазы, остальная часть – непосредственно в яичках. У женщин он в основном синтезируется из андростендиона.
ДГТ гораздо сильнее связывается с андрогенными рецепторами тканей, чем его предшественник тестостерон, так что, несмотря на меньшую концентрацию, обладает более выраженным андрогенным эффектом. Например, ДГТ стимулирует пролиферацию клеток предстательной железы гораздо сильнее, чем тестостерон, что является одной из главных причин развития гиперплазии предстательной железы (именно поэтому в настоящее время для ее лечения успешно используют ингибиторы 5-альфа-редуктазы). Таким образом, чрезмерное повышение уровня ДГТ, в том числе связанное с применением препаратов тестостерона, приводит к прогрессирующему росту предстательной железы. Во время курса лечения ингибиторами 5-альфа-редуктазы необходимо контролировать содержание ДГТ, которое взаимозависимо с размерами железы.
У мужчин ДГТ влияет и на другие «органы-мишени»: волосяные фолликулы, наружные половые органы, скелетную мускулатуру. Снижение секреции ДГТ, связанное с недостаточным синтезом как тестостерона (например, при гипогонадизме), так и 5-альфа-редуктазы, приводит к нарушениям полового развития у мальчиков: к отсутствию волос на лице, лобке, под мышками, к уменьшенным размерам полового члена и яичек, аномалии строения полового члена, недостаточной мышечной массе. С возрастом низкий уровень ДГТ вызывает нарушения эректильной функции и снижение либидо.
Избыток дигидротестостерона у обоих полов угнетает рост волос на голове и вызывает их усиленное выпадение. У женщин такое облысение относится к синдрому гиперандрогенной дермопатии (СГА) – серьезному нарушению гормонального фона, приводящему к отклонениям менструального цикла и даже бесплодию. Поскольку облысение, акне могут быть одними из первых признаков СГА, определение уровня ДГТ целесообразно для комплексной оценки гормонального статуса и ранней диагностики гиперандрогении у женщин.
В геноме человека содержится два гена, кодирующих разные изоформы 5-альфа-редуктазы: SRD5A1 и SRD5A2. Они расположены на пятой и второй хромосомах соответственно. Мутации гена SRD5A2 вызывают псевдовагинальную перинеоскротальную гипоспадию (гениталии мальчика при рождении развиваются по типу женских), так как дигидротестостерон влияет на формирование гениталий эмбриона.
Для чего используется исследование?
- Для диагностики:
-
- доброкачественной гиперплазии предстательной железы (ДГПЖ),
- андрогенной алопеции у обоих полов,
- первичного и вторичного гипогонадизма у мужчин,
- возрастного андрогенодефицита, характеризующимся снижением либидо и прогрессирующей эректильной дисфункцией, у мужчин,
- синдрома Морриса (одной из форм тестикулярной феминизации), развивающегося в связи с нечувствительностью к андрогенам,
- врождённого нарушения синтеза 5- альфа-редуктазы.
- Для контроля за успешностью применения ингибиторов 5-альфа-редуктазы при ДГПЖ либо при андрогенной алопеции.
- Для выяснения причин гиперандрогении, в особенности гиперандрогенной дермопатии у женщин.
Когда назначается исследование?
- При симптомах ДГПЖ (увеличение предстательной железы, нарушения мочеиспускания).
- При облысении (как у мужчин, так и у женщин).
- При применении препаратов, тормозящих действие 5-альфа-редуктазы, в целях контроля за успешностью лечения.
- При снижении либидо, эректильной дисфункции у мужчин.
- При отсутствии яичек или уменьшении их размеров, крипторхизме, ненормально маленьких размерах полового члена, отсутствии волос на лобке и подмышками.
- В пубертатный период у мальчиков.
- При гирсутизме, акне, себорее, нарушении менструального цикла у женщин.
Источник
Гиперандрогения — симптомы и лечение
Что такое гиперандрогения? Причины возникновения, диагностику и методы лечения разберем в статье доктора Скатова Бориса Васильевича, уролога со стажем в 27 лет.
Определение болезни. Причины заболевания
Гиперандрогения — это состояние, при котором у женщины в крови значительно повышен уровень мужских половых гормонов (андрогенов): тестостерона, дигидротестостерона, андростендиона и других.
Распространённость
Гиперандрогения встречается у 17–18 % женщин детородного возраста. Заболеванием страдают 16–22 % пациенток с бесплодием и 55–62 % — с эндокринным нарушением репродуктивных функций [1] .
Причины
- снижение уровня глобулина, связывающего половые гормоны (ГСПГ), и увеличение концентрации свободного тестостерона;
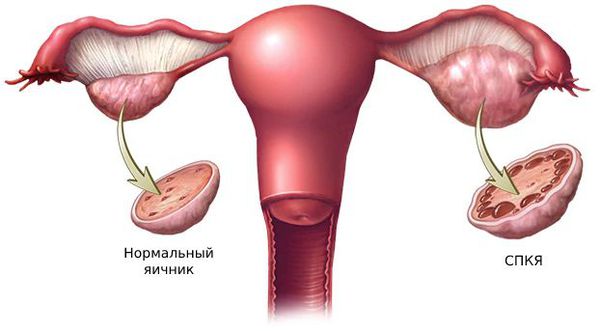
- синдром поликистозных яичников (СПКЯ);
- опухоли яичников и коры надпочечников, выделяющие андрогены;
- гиперплазия коры надпочечников, в том числе врождённые формы, вызванные мутациями генов CYP21, CYP11B1, HSD3B;
- аденома гипофиза (синдром Иценко — Кушинга);
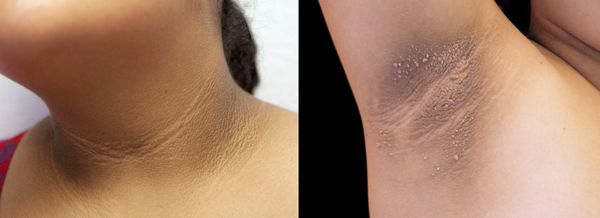
- синдром HAIR-AN — наследственное заболевание, при котором высокий уровень андрогенов сочетается с инсулинорезистентностью и чёрным акантозом (гиперпигментацией кожи);
- профессиональные занятия единоборствами, хоккеем, футболом и тяжёлой атлетикой [14][15] ;
- приём андрогенов и анаболических стероидов;
- хронический стресс;
- табакокурение и злоупотребление алкоголем[2] .
Симптомы гиперандрогении
- гирсутизм (избыточное оволосение по мужскому типу) — значительный рост жёстких чёрных волос в зонах, наиболее чувствительных к мужским гормонам: вокруг сосков, на лице, груди, животе, спине и бёдрах;
- андрогенная алопеция;
- бесплодие;
- маскулинизация — проявление и усиление у женщин мужских черт, при котором расширяется плечевой пояс, сужаются бёдра и снижается тембр;
- ожирение по мужскому типу, при котором жир откладывается в брюшной полости;
- нарушения менструального цикла: олигоменорея (редкие и скудные менструации) или аменорея (длительное отсутствие менструаций);
- угревая сыпь, жирная кожа и себорея;
- повышенное половое влечение;
- увеличение клитора и уменьшение молочных желёз;
- чёрный акантоз — кожа утолщается и меняет цвет из-за избыточного ороговения клеток эпителия и эпидермиса, а также увеличения уровня пигмента меланина [3] ;
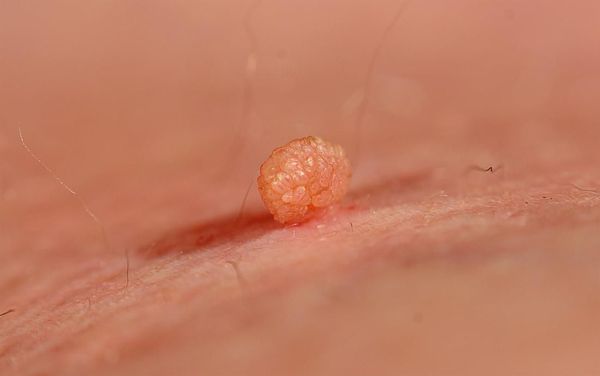
- мягкие фибромы на коже в области шеи, подмышек и паховых складок — доброкачественные новообразования округлой формы и мягкой консистенции.
Патогенез гиперандрогении
Андрогены — стероидные половые гормоны, которые вырабатываются из холестерина в коре надпочечников, а также в клетках фолликулов и соединительной ткани яичников.
К андрогенам относятся:
- тестостерон;
- андростендион;
- дегидроэпиандростерон и др.
В печени, жировой ткани и волосяных фолликулах андрогены способны превращаться в более активную форму — дегидротестостерон. Кроме того, в жировой ткани андрогены преобразуются в женский половой гормон эстрадиол [3] .
Роль андрогенов
В женском организме андрогены поддерживают гормональный баланс и после начала полового созревания инициируют рост волос на лобке и в подмышечных впадинах. Также они необходимы для выработки эстрогена и возникновения полового влечения.
Андрогены замедляют потерю кальция в костях и регулируют работу внутренних органов и систем: репродуктивной, почечной, мышечной и сердечной.
Гормональная регуляция происходит почти мгновенно с малым количеством активного вещества — гормона. Другая её особенность заключается в дистанцировании: гормон может вырабатываться в одной железе, а попадать в орган-мишень, находящийся в другой части организма.
Кроме этого механизма, андрогены могут действовать опосредованно, например через эстрогены — женские половые гормоны [4] .
В плазме крови андрогены взаимодействуют с глобулином, связывающим половые гормоны (ГСПГ). Он выполняет транспортную роль: вместе с ним андрогены доставляются с кровью в клетки органов-мишеней.
Выработка андрогенов зависит от возраста и объёма жировой массы. При старении, ещё до менопаузы, их уровень постепенно уменьшается, особенно снижается концентрация дегидроэпиандростерона и андростендиона. На уровень тестостерона возраст влияет меньше: яичники вырабатывают его почти в прежнем объёме и в постменопаузе [13] .
Избыток андрогенов
К избытку андрогенов могут приводить различные патологические механизмы:
- Развитие опухолей и множественных кист яичников. Изменённые клетки яичников влияют на ферменты, участвующие в обмене стероидных гормонов. К таким ферментам относится 17-альфа-гидроксилаза, играющий ключевую роль в синтезе андрогенов в яичниках.
- Образование опухолей в надпочечниках и гиперплазия коры надпочечников также приводят к избыточной выработке андрогенов.
- На дисбаланс андрогенов влияют другие гормоны: пролактин, эстрадиол и тиреотропные гормоны. Они взаимодействуют друг с другом, например при снижении уровня эстрадиола может расти уровень тестостерона. Это происходит из-за нарушения ферментных систем яичников, которые позволяют андрогенам яичникового происхождения превращаться в эстрогены.
- Гипотиреоз (снижение функции щитовидной железы и, соответственно, гормонов Т3, Т4) сопряжён с ростом уровня пролактина, который воздействует на кору надпочечников и стимулирует выработку андрогенов.
- При недостатке трийодитрина (Т3, самый активный гормон щитовидной железы) снижается концентрация глобулина, связывающего половые гормоны, и растёт уровень свободного тестостерона.
Повышать уровень андрогенов могут и другие внешние факторы, например приём стероидов и гормональных препаратов. Интересно, что при всех гиперандрогенных состояниях, андрогены происходят более чем из одного источника. Так, при поликистозе яичников увеличен синтез тестостерона, но большая часть этого гормона образуется вне яичников — в надпочечниках.
Большую роль в развитии первичной гиперандрогении играют генетические факторы. Одной из причин синдрома поликистозных яичников (СПКЯ) является генетически предопределённый избыток лютеинизирующего гормона (ЛГ). ЛГ стимулирует образование мужских половых гормонов: тестостерона и андростендиона. Их чрезмерная выработка нарушает процесс развития фолликулов: они преждевременно перерождаются в жёлтое тело и в этой области образуются фолликулярные кисты.
Другая причина развития СПКЯ — генетически обусловленное нарушение выработки инсулина и развитие инсулинорезистентности, то есть недостаточный ответ тканей на его действие.
К гиперандрогении, как было сказано выше, может приводить врождённая гиперплазия коры надпочечников. Причина её развития — мутации генов, которые отвечают за синтез ферментов или транспортных белков, участвующих в выработке кортизола.
Классификация и стадии развития гиперандрогении
Согласно Международной классификации болезней (МКБ-10), гиперандрогения кодируется как Е.28.1 Избыток андрогенов. Выделяют истинную гиперандрогению и другие её формы.
Истинная гиперандрогения
Истинная гиперандрогения бывает яичниковой и надпочечниковой
Яичниковая гиперандрогения:
1. Синдром поликистозных яичников. Первичный СПКЯ (синдром Штейна — Левенталя) возникает при нарушении в системе гипоталамус-гипофиз-яичники. Вторичный СПКЯ развивается при эндокринной патологии, например на фоне сахарного диабета, заболеваний щитовидной железы или под воздействием внешних факторов: интоксикации, стресса, травмы и инфекции.
2. Стромальный текоматоз яичников (синдром Френкеля) — тяжёлая форма овариальной неопухолевой гиперандрогении. При заболевании разрастается соединительная ткань и возникает синдром HAIR-AN (высокий уровень андрогенов, инсулинорезистентности, ожирение и чёрный акантоз). Это редкая патология выявляется преимущественно в постменопаузе.
3. Андроген-продуцирующая опухоль яичников:
- гранулезоклеточная опухоль;
- текома;
- андробластома;
- липидоклеточные опухоли.
Надпочечниковая гиперандрогения:
- врождённая гиперплазия коры надпочечников;
- андрогенома — опухоль коры надпочечников, продуцирующая андрогены (тестостерон и дегидроэпиандростерон-сульфат).
Другие формы гиперадрогении
- Транспортная (снижение уровня глобулина, связывающего половые гормоны).
- Периферическая:
- рецепторная;
- метаболическая (повышение уровня фермента 5-альфа-редуктазы).
- Ятрогенная — при приёме андрогенов, анаболических стероидов и глюкокортикоидов. Анаболические гормоны принимаются при выраженном истощении, восстановлении массы тела после тяжёлых заболеваний и травм. Глюкокортикоиды назначают для лечения аутоиммунных заболеваний, например ревматоидных болезней, системной красной волчанки и др.
- Вторичная — андрогензависимые дерматопатии: вульгарные угри, гирсутизм, алопеция и себорея[1] .
Осложнения гиперандрогении
- Ожирение верхней части тела и инсулинорезистентность. Избыток андрогенов влияет на рецепторы инсулина, которыми насыщена жировая ткань верхней части тела. Инсулин переводит углеводы в жировые запасы, и развивается ожирение.
- Сахарный диабет второго типа и гестационный диабет.
- Дислипидемия (повышение уровня холестерина и липопротеидов низкой плотности) и развитие атеросклероза.
- Сердечно-сосудистые заболевания.
- Невынашивание беременности, синдром потери плода, фетоплацентарная недостаточность, гестоз.
- Бесплодие.
- Онкологические процессы матки, молочных желёз и яичников.
- Обильные маточные кровотечения, геморрагический шок и анемия[1][5] .
Наиболее частые осложнения гиперандрогении: бесплодие, инсулинорезистентность и ожирение. Нарушение обмена липидов, сахарный диабет, сердечно-сосудистая патология возникают как следствие этих процессов.
Механизмы развития гиперандрогении и гиперинсулинемии до конца не изучены. Теоретически возможны три варианта взаимодействия: гиперандрогения вызывает гиперинсулинемию, гиперинсулинемия приводит к гиперандрогении и есть третий фактор, ответственный за оба феномена.
Предположение о том, что гиперандрогения вызывает гиперинсулинемию, основано на следующих фактах:
- у женщин, которые принимают оральные контрацептивы, содержащие прогестины с андрогенными свойствами, нарушается толерантность к глюкозе;
- длительный приём тестостерона приводит к развитию инсулинорезистентности.
О том, что гиперинсулинемия вызывает гиперандрогению, свидетельствует следующее: инсулинорезистентность сохраняется у пациенток с удалёнными яичниками и при длительном приёме препаратов, подавляющих выработку андрогенов.
Диагностика гиперандрогении
Диагностика проводится эндокринологом или гинекологом-эндокринологом.
Этапы:
1. Опрос (сбор анамнеза). Врач беседует с пациенткой и выясняет следующие факты:
- приём лекарств, особенно содержащих мужские половые гормоны, например препараты тестостерона — «Андриол», «Омнадрен», «Андрогель» и др.;
- регулярность менструального цикла;
- сведения о беременности и родах;
- время появления и скорость развития избыточного оволосения;
- изменение формы лица и прибавка в весе;
- наличие залысин и характер выпадения волос;
- присутствие угрей и степень жирности кожи;
- наличие диабета у близких родственников;
- образ жизни: употребление алкоголя, курение, уровень физической активности и особенности диеты.
2. Осмотр. Доктор обращает внимание на следующие симптомы:
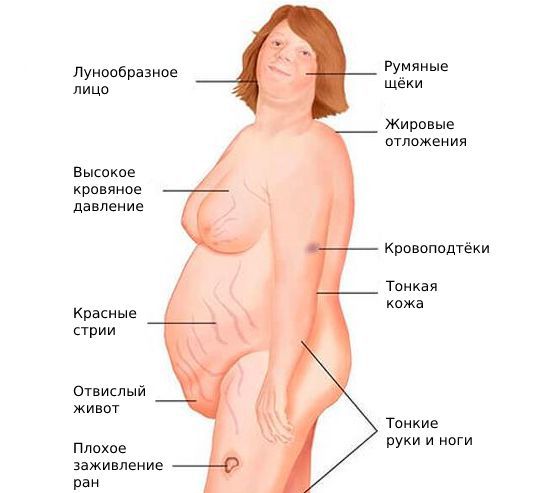
- признаки синдрома Иценко — Кушинга: лунообразное лицо, жировые отложения на шее, ожирение при тонких конечностях и длинных пальцах, сухая кожа, стрии (растяжки) и язвы на теле;
- чёрный акантоз, мягкие фибромы и угревая сыпь;
- признаки мужественности и ожирения по мужскому типу;
- увеличенный клитор;
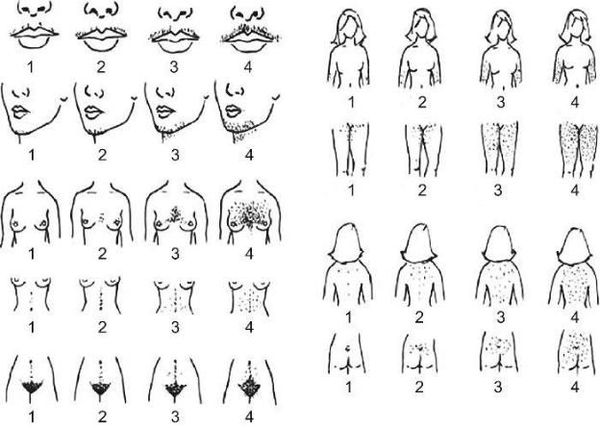
- распределение волос на теле, которое оценивается по визуальной шкале гирсутизма Ферримана — Голлвея.
3. Лабораторные исследования:
- Оценка работы половой системы — анализ крови на общий тестостерон, ГСПГ (глобулин, связывающий половые гормоны), ФСГ (фолликулостимулирующий гормон), ЛГ (лютеинизирующий гормон), пролактин, эстрадиол, альбумин, дигидротестостерон, прогестерон, андростендион, дегидроэпиандростерон-сульфат.
- Оценка гормонов надпочечников — анализ крови на кортизол и на 17-гидроксипрогестерон.
- Оценка работы щитовидной железы и углеводного обмена — анализ крови на ТТГ (тиреотропный гормон), Т3 свободный, Т4 свободный, Т3 реверсивный, АТ к ТПО (антитела к тиреопероксидазе), АТ к ТГ (тиреоглобулину), АТ к рецепторам ТТГ (тиреотропному гормону), анализ на содержание йода в моче, уровень глюкозы и инсулина натощак (индекс Хома), гликированный гемоглобин.
Направление на анализы выписывает врач, так как часть из них нужно проводить в определённые дни менструального цикла.
4. Инструментальная диагностика:
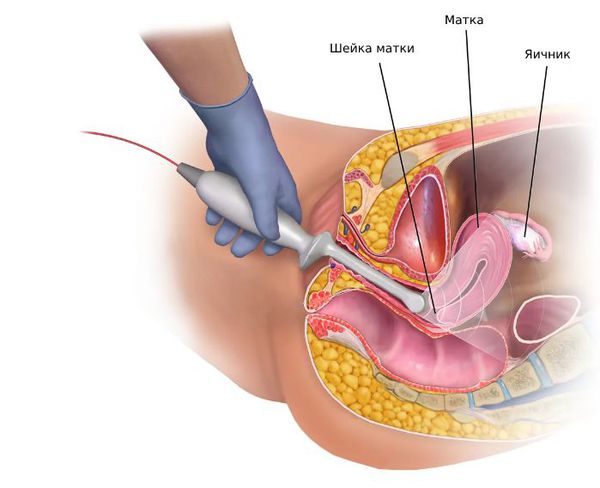
- Трансвагинальное УЗИ яичников позволяет обнаружить признаки синдрома поликистозных яичников, кист и других новообразований.
- УЗИ щитовидной железы выявляет новообразования, кисты, признаки воспаления щитовидной железы и позволяет оценить её размер и структуру.
- УЗИ, МСКТ (мультиспиральная компьютерная томография) и МРT (магнитно-резонансная томография) надпочечников. Исследования выявляют дисплазию и новообразования надпочечников.
- Сцинтиграфия надпочечников после внутривенного введения радиоактивного меченого холестерина. Позволяет выявить скрытую дисплазию и небольшие опухоли надпочечников. Несмотря на применение радиоактивных элементов, процедура безопасна для организма. Вводимые вещества обладают высокой скоростью полураспада: обычно процесс длится не более шести часов. Этого времени достаточно, чтобы провести процедуру, но не навредить организму [1][2][3][6][7] .
Лечение гиперандрогении
Заболевание лечит врач-эндокринолог или гинеколог-эндокринолог.
Лечение поможет устранить симптомы и достичь основных целей:
- нормализовать менструальный цикл;
- устранить бесплодие, вызванное нарушением созревания яйцеклетки и выхода её из яичника;
- устранить кожные проявления;
- вылечить обменные нарушения.
Нормализация менструального цикла уменьшает риск гиперплазии эндометрия и рака тела матки, маточных кровотечений и постгеморрагической анемии.
- комбинированные оральные контрацептивы (КОК);
- циклический или постоянный приём прогестогенов и средств, повышающих чувствительность периферических тканей к инсулину (метформин).
В редких случаях выполняют операции на яичниках.
Комбинированные оральные контрацептивы (КОК) снижают уровень гонадотропинов, а значит и концентрацию андрогенов, которые производятся в яичниках. Содержащиеся в КОК эстрогены увеличивают синтез глобулина, связывающего половые гормоны и, следовательно, снижают уровень свободного тестостерона. Кроме того, прогестагены в составе КОК уменьшают синтез андрогенов в надпочечниках, подавляют фермент 5-альфа-редуктазу и блокируют связывание андрогенов с рецепторами.
Оптимальными будут КОК, содержащие прогестаген с антиандрогенным действием: ципротерон, хлормадинон, диеногест и дроспиренон. Также предпочтительны оральные контрацептивы с этинилэстрадиолом.
Наиболее известные КОК, применяемые для лечения гиперандрогении:
- «Джес», «Димиа», «Ярина» — результат достигается быстро, уже через две недели, но у препаратов много побочных эффектов. Среди них: головная боль, боли в животе, тошнота, рвота; болезненность и нагрубание молочных желёз; увеличение веса, нарушение толерантности к глюкозе, задержка жидкости в организме; изменение либидо и снижение настроения; отёки век, кожная сыпь, узловая эритема, конъюнктивит, неприятные ощущения при ношении контактных линз; тромбофлебит, периферическая и центральная тромбоэмболия (может проявляться ухудшением зрения и слуха); генерализованный зуд, холестатическая желтуха, холелитиаз, повышение артериального давления; межменструальное кровотечение, изменение влагалищной секреции, кандидоз влагалища. Побочные эффекты могут возникать в первые несколько месяцев приёма препарата и обычно уменьшаются со временем.
- «Жанин», «Хлое» — могут назначаться молодым нерожавшим женщинам при избыточном оволосении, совместимы со многими препаратами.
- «Логест» — предпочтителен при выпадении волос.
- «Белара» — при СПКЯ и ожирении.
- «Линдинет-30», «Регулон», «Ярина», «Диане-35» и другие препараты [7][8] .
Прогестагены нормализуют менструальный цикл при циклическом или постоянном приёме. Однако есть гипотезы, что прогестерон сам обладает андрогеноподобным действием. Его, как правило, не назначают для лечения гиперандрогении, но применяют для нормализации второй фазы менструального цикла.
Блокаторы андрогенных рецепторов из–за выраженной тератогенности (влияния на внутриутробную закладку органов будущего ребёнка) беременным принимать запрещено.
Основные препараты из группы блокаторов андрогенных рецепторов:
- «Спиронолактон» — широко применяется в США как диуретик и нестероидный антиандроген. Эффективен при избыточном оволосении по мужскому типу.
- «Ципротерон» — снижает уровни тестостерона и андростендиона, подавляя секрецию лютеинизирующего гормона, блокирует действие андрогенов в периферических тканях. Среди побочных эффектов выделяют надпочечниковую недостаточность и снижение полового влечения [8][9] .
- «Финастерид» — уменьшает гирсутизм, но оказывает сильное тератогенное действие на эмбрионы мужского пола, поэтому при его приёме необходима надёжная контрацепция [11] .
Дозировку и режим приёма препаратов врач назначает индивидуально.
Фитотерапия играет вспомогательную роль. Применяют экстракт зелёного чая, сереноа (экстракт южно-американской пальмы), семя льна, пион, сою, стевию и дягель [10] [16] .
Способы удаления волос при гирсутизме
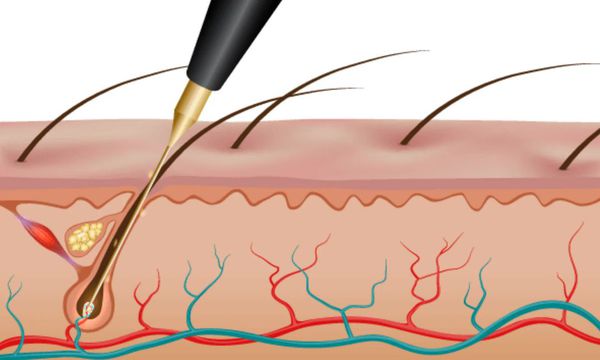
Электроэпиляция позволяет избавиться от волос на долгий срок, но потребуется несколько процедур, количество которых подбирают индивидуально [3] .
Существуют три вида электроэпиляции:
- электролиз — в волосяной фолликул вводят один или несколько стерильных электродов, по ним поступает постоянный ток и специальное химическое вещество;
- термолиз — через стерильный электрод в волосяной фолликул подают высокочастотный переменный ток, создающий тепло и разрушающий фолликул;
- смешанный тип — применяют два вида тока.
Побочные эффекты электроэпиляции: ожоги, раздражение кожи, редко — образование рубцов.
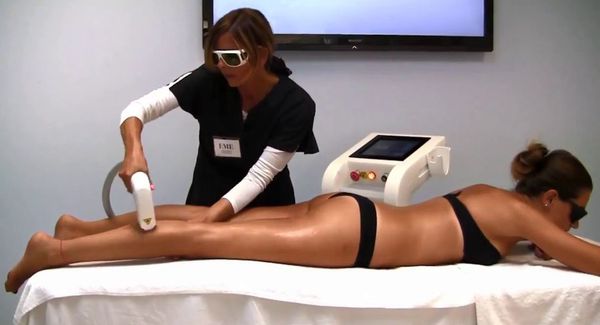
Лазерная эпиляция позволяет повредить волосяной фолликул, не разрушив окружающие его ткани. Процедуры нужно проводить многократно, но полностью избавиться от волос удаётся редко. В зависимости от источника светового излечения лазеры для удаления волос делятся на три группы:
- красные — рубиновый лазер с длиной волны 694 нм;
- инфракрасные — александритовый лазер (с длиной волны 755 нм), диодный (800 нм) и неодимовый (1064 нм);
- импульсные источники лазерного излучения высокой интенсивности (590–1200 нм) [12] .
Прогноз. Профилактика
Если своевременно обратиться к врачу и правильно подобрать лечение, то можно уменьшить неприятные симптомы и избежать серьёзных осложнений.
Результаты терапии следует оценивать через 3–6 месяцев, потому что антиандрогенные препараты действуют медленно: они постепенно накапливаются в организме и встраиваются в обмен веществ. Их приём требует адекватного дозирования, а также регулярной оценки результатов и возможных побочных действий.
Лечение позволяет избавиться от симптомов, поэтому для грамотной коррекции терапии пациентке необходимо регулярно посещать врача-эндокринолога
Профилактика:
- обратиться к доктору при появлении первых признаков гиперандрогении;
- вести здоровый образ жизни;
- избегать хронических стрессов;
- сбалансировать питание;
- не злоупотреблять алкоголем;
- с осторожностью заниматься борьбой, бодибилдингом и тяжёлой атлетикой;
- исключить приём препаратов с мужскими половыми гормонами, анаболических стероидов и глюкокортикоидов [7] .
Источник