Корреляция результатов эхографии, магнитно-резонансной томографии и морфологии при саркомоподобной лейомиоме матки
Трофименко И.А. 1,2 , Берген Т.А. 3 , Исакова Н.Б. 4 , Бакланова Н.С. 5 , Красильников С.Э. 6
1) Кафедра рентгенологии и радиологии Военно-медицинской академии им. С.М. Кирова, кафедра радиологии и рентгенологии с курсом УЗ-диагностики, Санкт-Петербург, Россия;
2) Городская больница № 40, отделение лучевой диагностики, Сестрорецк, Россия;
3) Дорожная клиническая больница на ст. Новосибирск-главный ОАО «РЖД», рентгеновское отделение №1,
4) Новосибирский областной онкологический диспансер, патоморфологическое отделение,
5) Новосибирский областной онкологический диспансер, отделение лучевой диагностики,
6) Новосибирский областной онкологический диспансер, отделение гинекологии, Новосибирск, Россия
Приводится клиническое наблюдение пациентки Х., на примере которого рассматривается дифференциальная диагностика саркомы и миомы матки со сложными формами дегенерации методами ультразвуковой диагностики и магнитно-резонансной томографии.
Обсуждение. При затруднении интерпретации сонографической картины в дифференциальной диагностике саркомы и миомы матки рекомендуется проведение МРТ малого таза. При магнитно-резонансной томографии с применением только лишь морфологических последовательностей дифференцировать доброкачественные и злокачественные опухоли миометрия возможно, только опираясь на вторичные признаки (инвазия в прилежащие структуры, регионарная лимфаденопатия, наличие метастазов). Контрастное усиление также не позволяет убедительно различить эти образования, так как и саркомы, и лейомиомы неоднородно накапливают контрастный препарат. Наибольшие затруднения вызывает дифференциальная диагностика крупных узлов, а также сарком и лейомиом клеточного типа или с миксоматозной дегенерацией.
Заключение. При дифференциальной диагностике саркомы и миомы матки целесообразно проведение МРТ малого таза с методикой ДВИ в протоколе, поскольку, по данным литературы, измеряемый коэффициент диффузии в лейомиомах в среднем составляет 1,3-1,7×10 -3 мм 2 /с, а в злокачественных новообразованиях этот показатель редко превышает 1,1×10 -3 мм 2 /с.
Ключевые слова: саркомы матки, миома матки, ультразвуковая диагностика, магнитно-резонансная томография, МРТ, диффузно-взвешенное изображение.
Лейомиома представляет собой наиболее распространенное из объемных образований матки, составляя 12-25% от всех гинекологических заболеваний [1]. Пик встречаемости лейомиом приходится на поздний репродуктивный и пременопаузальный возраст, когда опухоли этого типа присутствуют у 77% женщин [1, 2].
До 65% лейомиом матки со временем претерпевают так называемые вторичные или дегенеративные изменения, что делает эту группу доброкачественных опухолей чрезвычайно разнородной с точки зрения морфологии и, соответственно, ультразвуковой и магнитно-резонансной семиотики. К таким изменениям относится гиалиновая дегенерация, составляющая до 63% вторичных изменений лейомиом, мукоидная или миксоматозная дегенерация (19%), кальциноз (8%), кистозная дегенерация с предшествующей фазой отека стромы опухоли (4%), красная или геморрагическая дегенерация (3%), а также жировое перерождение (3%) [3]. Для гиалиновой дегенерации лейомиом при МРТ характерен типичный сигнал стромы узла на Т2-ВИ, более низкий, чем для миометрия, и изоинтенсивный поперечно-полосатым мышцам [3]. При УЗИ участки гиалиноза обычно эхонегативны и могут напоминать мелкодисперсную несмещаемую взвесь. Контуры таких лейомиом четкие, но часто неровные, фиброзные изменения стромы узла сопровождаются повышением его эхогенности [4].
Кальциноз лейомиом сопровождается появлением в их строме гипоинтенсивных включений во всех типах взвешенности при МРТ; при УЗИ кальцинаты демонстрируют характерную гипоэхогенность с эффектом дистального затенения, часто участки обызвествления создают своеобразную картину гиперэхогенного ободка узла [3, 4].
Кистозная форма дегенерации лейомиом при УЗИ проявляется наличием в строме узла гипо- или анэхогенных полостей, лишенных кровотока; при МРТ кистозные включения характеризуются гиперинтенсивным сигналом на Т2-ВИ и гипоинтенсивным на Т1-ВИ с высокими показателями измеряемого коэффициента диффузии [3, 5]. При геморрагической дегенерации строма лейомиомы на МР-изображениях характеризуется повышенным сигналом в Т1-взвешенности [3].
Наиболее сложными по структуре, МР- и эхо-характеристикам являются лейомиомы с миксоматозной дегенерацией. При сонографии лейомиомы такого типа характеризуются анэхогенными включениями вне клиники нарушения питания узла, появлением зон сниженной эхогенности в узле без признаков акустического усиления, а также участками повышенной эхогенности в узле 3. При МРТ лейомиомы данного типа демонстрируют негомогенную структуру, вариабельную интенсивность сигнала на Т1-ВИ, при этом они гипер- или изоинтенсивны миометрию на Т2-ВИ [3, 6].
Такое разнообразие семиотики определяет сложности дифференциальной диагностики дегенеративно измененных лейомиом с другими узловыми образованиями тела матки, в частности, с саркомами.
Саркоматозные опухоли тела матки встречаются достаточно редко, на долю лейомиосарком приходится лишь 1% злокачественных опухолей данного органа [1]. Саркомы обычно проявляются болевым синдромом и метроррагиями, однако могут протекать бессимптомно. Они склонны к быстрому росту, 5-летняя выживаемость составляет 50-65% [6]. Наиболее распространенными подтипами сарком тела матки являются лейомиосаркомы и эндометриальные стромальные саркомы [1].
Пациентка Х., 66 лет, обратилась к гинекологу по поводу периодических болей внизу живота тянущего характера, появившихся около полугода назад. Из анамнеза: менопауза в течение 18 лет, 4 беременности, 2 родов; помимо аппендэктомии около 30 лет назад оперативных вмешательств не было, из соматической патологии – артериальная гипертензия II ст., степень риска III.
При гинекологическом обследовании отмечается увеличение размеров тела матки до 6-7 недель беременности за счет плотного узлового образования, безболезненного при пальпации, с ограниченной подвижностью; шейка матки и придатки без особенностей. По результатам морфологического исследования материалов раздельного диагностического выскабливания полости матки и цервикального канала атипических клеток выявлено не было.
УЗИ на аппарате HITACHI Preirus из транасабдоминального и трансвагинального доступов с использованием датчиков различной частоты: конвексного датчика с постоянной частотой 5 МГц, объемного 3D датчика с частотой 2-7 МГц, внутриполостного датчика с постоянной частотой 3-10 МГц (для визуализации образований малого таза размерами до 50 мм) и линейного датчика с постоянной частотой 3-9 МГц для исследования поверхностных структур. Исследование проводили в режиме серошкального сканирования (В-режим) и цветового допплеровского картирования (ЦДК).
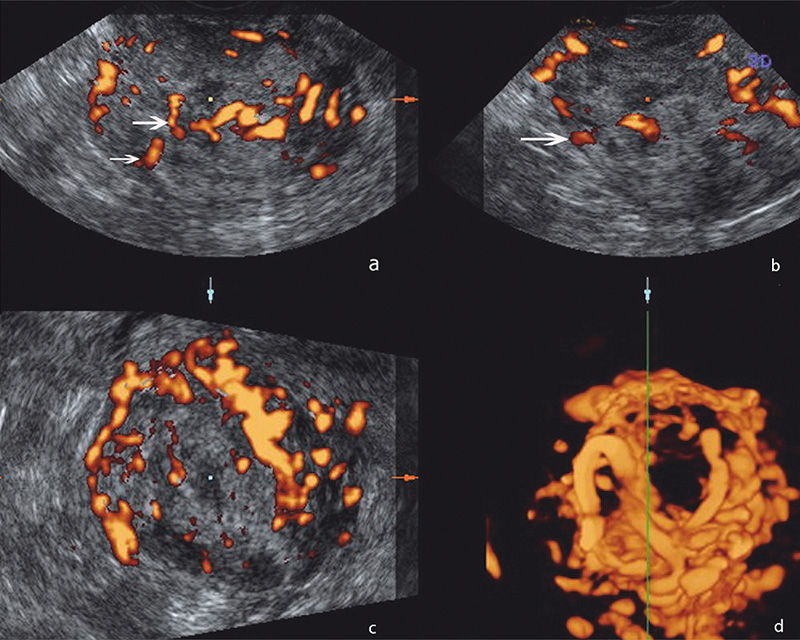
Сонографическая картина образования характеризовалась бугристым контуром, в структуре были анэхогенные аваскулярные участки, кровоток определялся хаотично по всех поверхности, в т.ч. в центральных отделах узла, показатель индекса резистентности (IR) был в пределах 0,5-0,45 мм/сек (рис. 1), на основании чего был предложен диагноз саркома матки.
Рисунок 1. Эхограммы с энергетической допплерографией органов малого таза у больной Х.: а, б, в) образование миометрия с бугристым нечетким контуром, неоднородной структуры за счет гипоэхогенных участков в структуре, хаотичным кровотоком по всей поверхности (стрелки), показатель индекса резистентности (IR) 0,5-0,45 мм/сек; г) 3D-реконструкция, извитой ход сосудов, васкуляризация по типу клубка.
Выполнена МРТ малого таза на системе с напряженностью поля 1,5Т с применением поверхностной 6-канальной катушки. Протокол исследования включал 3 серии Т2-ВИ spin echo в сагиттальной плоскости, по короткой и длинной оси тела матки, Т1-ВИ в аксиальной плоскости с подавлением сигнала от жировой ткани и без такового, ДВИ с b-факторами 50, 500, 800 с/мм 2 в аксиальной плоскости с автоматическим построением карт измеряемого коэффициента диффузии (ИКД). Толщина среза составила 3-4 мм. От контрастного усиления пациентка отказалась.
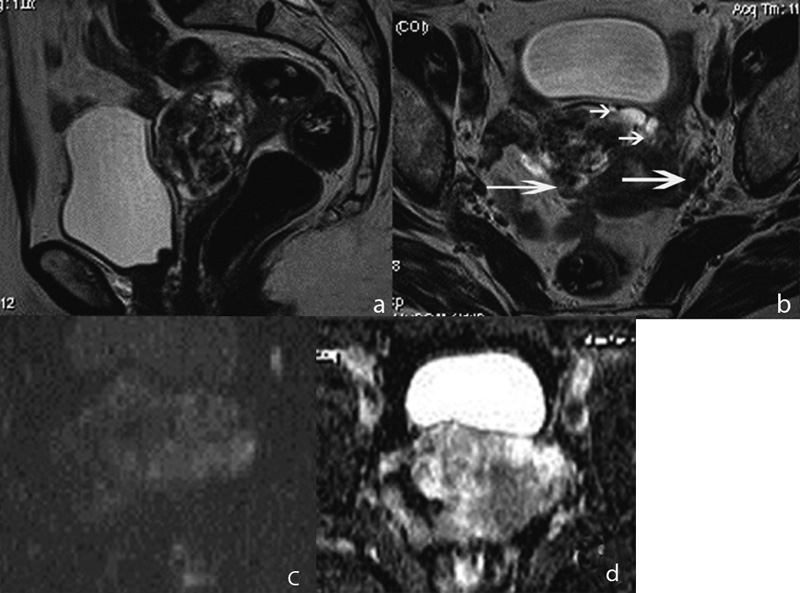
На МР-изображениях справа по передней стенке определялось интрамурально-субсерозное образование размером до 4 см, имеющее четкие дольчатые контуры с предполагаемым наличием псевдокапсулы (рис. 2); опухоль не распространялась на шейку матки и не демонстрировала связи с цервикальным каналом и полостью матки. Структура опухоли представлялась гетерогенной за счет кистозных включений и множественных расширенных сосудов, визуализируемых в виде характерных линейных участков пустоты потока; строма образования демонстрировала преимущественно гипоинтенсивный сигнал на Т2-ВИ, изоинтенсивный на Т1-ВИ с высоким показателем ИКД , на основании чего образование было охарактеризовано как лейомиома со сложной дегенерацией стромы. Обращало на себя внимание диффузное расширение сосудистых сплетений в миометрии передней стенки тела матки вокруг опухоли, а также в параметриях с высоким сигналом на Т2-ВИ spin echo, отражающим относительно низкие скоростные показатели кровотока, что было интерпретировано как возможное наличие сопутствующей сосудистой мальформации. В остальном в зоне исследования изменений выявлено не было.
Рисунок 2. МР-томограммы органов малого таза пациентки Х. Т2-ВИ в сагиттальной (а) и косо-аксиальной (б) плоскости;
ДВИ с b-фактором 800 с/мм 2 (в) и карта ИКД (г) в аксиальной плоскости. Опухоль характеризуется негомогенной структурой
с преимущественно низким сигналом на Т2-ВИ, имеет псевдокапсулу. Отмечается расширение сосудов в миометрии вокруг опухоли
(короткие стрелки), а также в параметриях (длинные стрелки). Показатель ИКД 1,57×10 -3 мм 2 /с.
Через 2 месяца после УЗИ и МРТ пациентке выполнено хирургическое лечение в объеме экстирпации матки с придатками (рис. 3). По результатам морфологического исследования материалов операции опухоль сформирована из клеток веретенообразной формы, собранных в переплетающихся в различных направлениях пучки (рис. 4.). Клетки опухоли вытянуты по полюсам с веретенообразным центрорасположенным ядром, структура хроматина мелкоглыбчатая. Отмечался пикноз отдельных ядер, вакуолизация цитоплазмы, некоторый ядерный клеточный полиморфизм. Митозы в поле зрения. Каждая клетка была погружена в волокнистую строму. Строма опухоли с явлениями отека, отмечается присутствие тучных клеток, а также эозинофильных лейкоцитов, зрелых лимфоцитов, локализующихся преимущественно периваскулярно. Сосуды щелевидные. Таким образом, был выставлен окончательный диагноз: миома с выраженными дегенеративно-дистрофическими изменениями.
Рисунок 3. Макропрепарат: удаленная матка с придатками. Полость матки вскрыта, в просвете −
экзофитная крупнодольчатая опухоль на широком основании с признаками нарушения питания, кровоизлияниями, отеком.
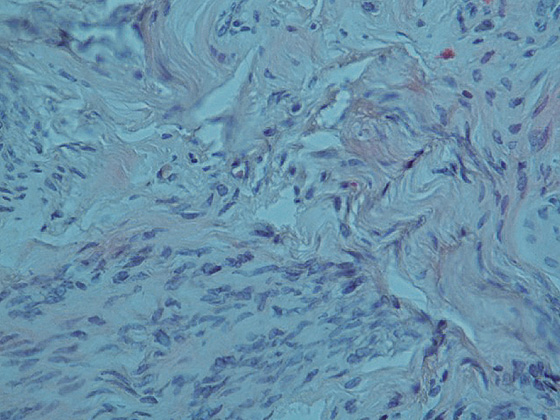
Рисунок 4. Микропрепарат миомы тела матки с дистрофическими изменениями (увеличение 10×40, окраска гематоксилином и эозином).
Опухоль состоит из веретеновидных, с центрально расположенными ядрами клеток, собранных в переплетающиеся пучки,
строма опухоли отечна, сосуды щелевидные, присутствуют эозинофилы и лимфоциты.
При сонографическом исследовании основными признаками, позволяющими дифференцировать саркоматозные опухоли от лейомиом со сложной дегенерацией узла, являются показатели кровотока [5, 7]. В частности, для злокачественных опухолей более характерен центральный тип васкуляризации, тогда как доброкачественные образования миометрия чаще демонстрируют периферический тип кровоснабжения. Большое значение имеют и количественные показатели кровотока: злокачественные опухоли характеризуются более низкими значениями индекса резистентности и более высокими значениями скоростных показателей кровотока [7]. По данным А. Kurjak и соавт., использование порогового значения индекса резистентности (IR) 0,40 позволяет дифференцировать миому и саркому матки с чувствительностью 90,91%, специфичностью 99,82% и прогностической ценностью отрицательного результата 99,96% [8]. Однако не все исследователи разделяют эту точку зрения, считая, что низкие значения IR часто наблюдаются при допплерографии доброкачественных лейомиом [5]. Другим важным дифференциально-диагностическим критерием является максимальная артериальная скорость (МАС). Разные авторы предлагают значения пороговых критериев МАС от 41 до 45 см/с [7]. Но следует отметить, что в пролиферирующих лейомиомах размером более 5 см нередко наблюдаются очень высокие значения МАС, что не позволяет использовать данный критерий как патогномоничный в дифференциации лейомиом и сарком миометрия [4, 9].
При МРТ с применением только морфологических последовательностей (Т1- и Т2-взвешенных изображений) дифференцировать доброкачественные и злокачественные опухоли миометрия возможно, опираясь лишь на вторичные признаки (инвазия в прилежащие структуры, регионарная лимфаденопатия, наличие метастазов). Контрастное усиление также не позволяет убедительно различить эти образования, так как и саркомы, и лейомиомы неоднородно накапливают контрастный препарат [3, 6]. Наибольшие затруднения вызывает дифференциальная диагностика крупных узлов, характеризующихся гиперинтенсивным сигналом на Т2-ВИ (саркома и лейомиома клеточного типа или с миксоматозной дегенерацией). В этих случаях одним из основных опорных пунктов дифференциального диагноза является методика МР-диффузии, т.к. измеряемый коэффициент диффузии в лейомиомах в среднем составляет 1,3-1,7×10 -3 мм 2 /с, тогда как в злокачественных саркомах этот показатель редко превышает 1,1×10 -3 мм 2 /с [6,10].
В данном клиническом наблюдении образование миометрия характеризовалось низким сигналом в Т2 взвешенности от подавляющего объема своего матрикса, что типично для гиалинизированных лейомиом; в саркомах могут встречаться включения низкого сигнала на Т2-ВИ, соответствующие кровоизлияниям, обызвествлениям или гиалиновому некрозу, однако больший объем опухолевого матрикса, как правило, демонстрирует гипер- или изоинтенсивный сигнал. При количественном анализе МР-диффузии в представленном клиническом наблюдении участки стромы опухоли с повышенным сигналом в Т2-взвешенности демонстрировали ИКД 1,57±0,11×10 -3 мм 2 /с, что подтверждало доброкачественную природу образования.
Вероятной причиной затруднений в интерпретации сонографической картины в представленном наблюдении послужило наличие сложной дегенерации миоматозного узла и, как следствие, регистрация кровотока в центральных участках образования. УЗ-интерпретацию затрудняло также расширение интрамуральных сосудов в миометрии, окружающем образование, что, вероятно, оказывало влияние на скоростные показатели кровотока и снижение индекса резистентности.
Представленное клиническое наблюдение иллюстрирует, насколько сложным может быть дифференциальная диагностика лейомиом с вторичными дегенеративными изменениями и сарком тела матки. Опухоли сложной структуры в сочетании с сопутствующими сосудистыми изменениями миометрия могут затруднять УЗ-диагностику, имитируя злокачественный рост. В таких случаях для установления диагноза и, соответственно, адекватного выбора тактики лечения рекомендуется проведение МРТ.
- Бохман Я.В. Руководство по онкогинекологии. М: Медицина, 1989; 464.
- Зайратьянц О.В., Сидорова И.С., Леваков С.А. и др. Особенности морфогенеза и ангиогенеза лейомиомы матки. Архив патологии 2005; 67(3): 29-31.
- Труфанов Г.Е., Панов В.О. Руководство по лучевой диагностике в гинекологии. СПб: ЭЛБИ, 2008; 592.
- Демидов В.Н., Зыкин Б.И. Ультразвуковая диагностика в гинекологии. М.: Медицина, 1990; 221.
- Sladkevicius P, Valentin L, Marsal K. Transvaginal Doppler examination of uteri with myomas. J Clin Ultrasound 1996; 24(3): 135-140.
- Tamai K, Koyama T, Saga T, et al. The utility of diffusion-weighted MR imaging for differentiating uterine sarcomas from benign leiomyomas. Eur Radiol 2008; 18: 723-730.
- Hata K, Hata T, Maruyama R, Hirai M. Uterine sarcoma: can it be differentiated from uterine leiomyoma with Doppler ultrasonography? A preliminary report. Ultrasound Obstet Gynecol 1997; 9(2): 101-104.
- Kurjak A, Kupesic S. An atlas of transvaginal color Doppler. 2nd ed. New Jork-London: The Parthenon publishing group, 2000; 205.
- Зыкин Б.И., Медведев М.В. Допплерография в гинекологии. 1-е издание. М.: РАВУЗДПГ. Реальное время, 2000; 152.
- Namimoto T, Yamashita Ya, Awai K, et al. Combined use of T2-weighted and diffusion-weighted 3-T MR imaging for differentiating uterine sarcomas from benign leiomyomas. Eur Radiol 2009; 19: 2756-2764.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Источник