- Дефекты нервной трубки: обновлен практический бюллетень (Obstetrics & Gynecology, декабрь 2017)
- Обзор
- Посмотреть другие обзоры
- Автор обзора
- Процесс формирования нервной трубки и пороки развития
- Дефект нервной трубки низкий риск что значит
- Дефицит фолиевой кислоты у матери и дефекты нервной трубки
- Дефекты развития нервной трубки
- Что такое Дефекты развития нервной трубки —
- Что провоцирует / Причины Дефектов развития нервной трубки:
- Патогенез (что происходит?) во время Дефектов развития нервной трубки:
- Симптомы Дефектов развития нервной трубки:
- Диагностика Дефектов развития нервной трубки:
- Лечение Дефектов развития нервной трубки:
- Профилактика Дефектов развития нервной трубки:
- К каким докторам следует обращаться если у Вас Дефекты развития нервной трубки:
Дефекты нервной трубки: обновлен практический бюллетень (Obstetrics & Gynecology, декабрь 2017)
Обзор
В журнале Obstetrics & Gynecology в выпуске за декабрь 2017 г. опубликован обновленный практический бюллетень Американской коллегии акушеров-гинекологов по дефектам нервной трубки (№ 187).
— Все женщины, планирующие беременность или способные забеременеть, должны принимать 400 микрограмм фолиевой кислоты ежедневно. Прием фолиевой кислоты должен начинаться как минимум 1 месяц до наступления беременности и продолжаться в течение первых 12 недель беременности.
— Женщины с высоким риском дефектов нервной трубки плода должны принимать по 4 мг ( 4000 микрограмм ) фолиевой кислоты ежедневно. Прием фолиевой кислоты должен начинаться за 3 месяца до наступления беременности и продолжаться до 12 недель гестационного срока.
— Всем беременным рекомендовано УЗИ во 2м триместре. Оптимальным временем проведения однократного УЗИ является 18 — 22 недель беременности, что позволяет подтвердить гестационный возраст и провести скрининг на наличие патологии, включая дефекты нервной трубки.
— Хотя и имеется возможность детекции определенных дефектов нервной трубки в 1м триместре, частота выявления гораздо меньше по сравнению с УЗИ во 2м триместре. Поэтому, нормальный результат УЗИ в 1м триместре не должен заменять проведение скринингового УЗИ во 2м триместре.
— Необходимо предлагать беременной с плодом с дефектами нервной трубки возможность выбора: прерывание беременности, выжидательное ведение с хирургической коррекцией в неонатальном периоде, и внутри-маточную фетальную операцию у подходящих кандидаток.
— Если женщина выбирает сохранение беременности, нужно рекомендовать генетическую оценку путем амниоцентеза на хромосомное микрочипное тестирование, так как выявление генетической патологии у плода с дефектами нервной трубки имеет важное значение по прогнозу, ведению беременности и для определения является ли пациентка кандидаткой на внутри-маточную фетальную операцию по коррекции дефекта нервной трубки.
— Беременные с нелетальным дефектом нервной трубки плода должны направляться в специализированные центры для всестороннего ведения, включая: акушера, специалиста по плоду совместно с неонатологом, детским нейрохирургом и генетиком.
— Роды плода с нелетальным расщеплением позвоночника (спина бифида) должны проходить в стационаре, который имеет специализированную неонатальную помощь и сотрудников, способных вести спинальные дефекты и любые срочные осложнения.
— Учитывая, что нет ясности каким образом и какова значимость неврологических исходов в зависимости от метода родовспоможения данных детей, решения по времени и методу родовспоможения должны приниматься индивидуально при консультации со специалистами с опытом и знаниями о дефектах нервной трубки плода.
— Несмотря на материнский и акушерский риск, внутриматочная коррекция является вариантом лечения для женщин, которые подходят под соответствующие критерии. Консультирование должно быть ненавязчивым и включать все варианты с полным раскрытием потенциальной пользы и рисков для плода и женщины, включая значение для последующих беременностей.
Подробнее смотрите в прикрепленном файле.
Посмотреть другие обзоры
Автор обзора
Автор обзоров мировой медицинской периодики на портале MedElement — врач общей практики, хирург Талант Иманалиевич Кадыров.
Закончил Киргизский Государственный медицинский институт (красный диплом), в совершенстве владеет английским языком. Имеет опыт работы хирургом в Чуйской областной больнице; в настоящий момент ведет частную практику.
Регулярное повышение квалификации: курсы Advanced Cardiac Life Support, International Trauma Life Support, Family Practice Review and Update Course (Англия, США, Канада).
Источник
Процесс формирования нервной трубки и пороки развития
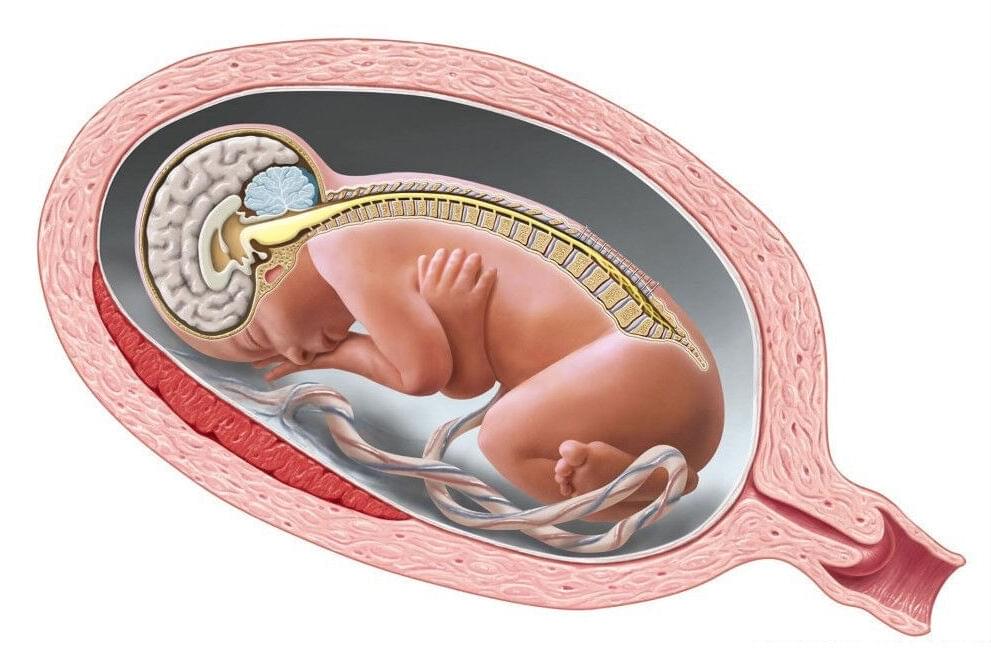
Процесс формирования нервной трубки называется нейруляцией. Нейруляция начинается с появления нервной пластинки, которая инвагинирует внутрь позвоночника, чтобы сформировать нейронную сеть с нервными канавками по обеим сторонам позвоночника. Постепенно, нейронные канавки сближаются друг с другом по средней линии позвоночника и сливаются, таким образом преобразовывая нейронные канавки в нервную трубку.
Формирование нервной трубки начинается в районе будущей шеи на уровне 4-й сомита (4 сегмента шейного отдела позвоночника). Нейруляция начинается через 16 суток после оплодотворения и завершается на 21-22 сутки. Нейруляция у человека происходит в несколько этапов. Сначала смыкается спинной отдел позвоночника, затем смыкание происходит на участке ото лба к теменным буграм, третьим этапом смыкается лицевой отдел черепа, затем — участок от затылочных долей до шейного отдела позвоночника, и последним этапом замыкается крестцовый отдел.
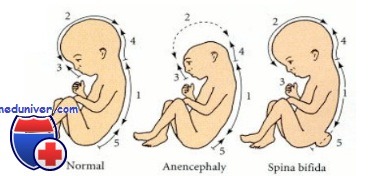
При нарушении нейруляции на этапах смыкания нервной трубки обнаруживаются врожденные пороки развития, такие как:
- анэнцефалия (врожденное отсутствие или недоразвитие головного мозга и мозжечка),
- расщепление позвоночника — Spina Bifida,
- экзэнцефалия (отсутствие костей черепа)
и другие дефекты центральной нервной системы. Дефекты закрытия нервной трубки встречаются довольно редко. При серьёзных дефектах развития невральной трубки, таких как анэнцефалия, расщепление позвоночника плод погибает в утробе матери или рождается нежизнеспособным и погибает в ближайшие дни после рождения. Современное оборудование помогает обнаружить пороки развития нервной трубки на регулярных обследованиях во время беременности. При ранней диагностике пороков развития нервной трубки показано прерывание беременности.
Формирование нервной трубки человека это сложное взаимодействие между генетическими и экологическими факторами. Некоторые гены имеют важное значение для формирования нервной трубки, но пищевые факторы, такие как уровень холестерина и фолиевой кислоты, также важны для правильного формирования нервной трубки. Учеными было подсчитано, что 50% дефектов закрытия нервной трубки у плода, можно предотвратить назначив беременной женщине препараты фолиевой кислоты и витамина B 12.
ВОЗ рекомендует всем женщинам на этапе планирования беременности, а так же беременным, принимать 400 мкг фолиевой кислоты ежедневно, чтобы уменьшить риск пороков развития нервной трубки.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.
Источник
Дефект нервной трубки низкий риск что значит
Несколько частых врожденных пороков развития, наблюдаемых как изолированные дефекты, а не как часть синдрома, по-видимому, повторяются в семьях. Семейное накопление и повышенный риск повторения у родственников больного — признаки комплексного признака. Наиболее важные врожденные пороки развития с комплексным наследованием — дефекты нервной трубки (ДНТ), расщелина губы с расщелиной или без расщелины нёба и врожденные пороки развития сердца.
Анэнцефалия и spina bifida — ДНТ, часто накапливающиеся в семьях и, как считают, имеющие общий патогенез. При анэнцефалии отсутствуют передний мозг, мозговые оболочки, свод черепа и кожа. Большинство младенцев с анэнцефалией рождаются мертвыми, а родившиеся живыми погибают самое большее через несколько часов. Около двух третей больных — девочки. При spina bifida нарушается слияние позвонков, обычно в поясничной области.
Отмечена различная степень тяжести порока, колеблющаяся от spina bifida occulta, при которой дефект ограничен костным сводом, до spina bifida aperta, когда из-за костного дефекта возникает менингоцеле (грыжа оболочек) или менингомиелоцеле (выступание через дефект элементов мозга и оболочек).
Как группа, дефект нервной трубки — ведущая причина гибели плода, смерти в периоде новорожденности и раннем детстве и отставания у выживших детей. Их встречаемость при рождении варьирует от почти 1% в Ирландии до 0,2% или менее в Соединенных Штатах. Частота также изменяется в зависимости от социальных факторов и сезона рождения и существенно колеблется со временем (с выраженным снижением за последние годы; см. последующую дискуссию).
У небольшой части дефектов нервной трубки известны специфические причины, например амниотические перетяжки (волокнистые тяжи между амнионом и эмбрионом, вызванные ранним разрывом амниона, нарушающие морфогенез в ходе эмбрионального развития), некоторые моногенные пороки с плейотропной экспрессией, некоторые хромосомные заболевания и некоторые тератогены. Большинство дефектов нервной трубки, тем не менее, — изолированные пороки неизвестной причины.
Дефицит фолиевой кислоты у матери и дефекты нервной трубки
Дефекты нервной трубки длительное время считались пороками с многофакторным типом наследования, определяемыми многочисленными генетическими и средовыми факторами. Так было до проведения исследований, обнаруживших единственный главный фактор, вызывающий дефект нервной трубки, — витаминную недостаточность. Риск развития дефекта нервной трубки оказался обратно пропорционален уровню фолиевой кислоты в крови матери во время беременности, с пороговым значением в 200 мкг/л, ниже которого риск возникновения дефекта нервной трубки становится значимым.
Вместе со снижением уровня фолата в крови у матерей детей с дефектом нервной трубки наблюдают повышение уровня гомоцистеина, показывающее, что биохимическая аномалия находится на этапе восстановления тетрагидрофолата при переходе метилгомоцистеина в метионин. Уровень фолиевой кислоты сильно зависит от приема с пищей и может снижаться при беременности даже при обычной дозе примерно в 230 мкг в день. Влияние недостатка фолиевой кислоты потенцируется генетическим вариантом фермента 5,10-метилентетрагидрофолатредуктазы (MTHFR), вызванным частой миссенс-мутацией, делающей фермент менее стабильным, чем в норме.
Нестабильность фермента препятствует восстановлению тетрагидрофолата и создает помехи с метилированием гомоцистеина в метионин.
Мутантный аллель настолько часто встречается во многих популяциях, что от 5-15% популяции гомозиготны по этой мутации. В исследованиях обнаружено, что матери детей с дефектом нервной трубки в 2 раза чаще, чем в контрольной группе, бывают носителями мутантного аллеля, кодирующего нестабильный фермент. Не все матери детей с дефектом нервной трубки с низкими уровнями фолиевой кислоты гомозиготны по мутантному аллелю MTHFR, что доказывает роль других неизвестных генетических факторов или просто диетическиго дефицита, в снижении уровня фолиевой кислоты.
Остается неясным, как дефект фермента содействует формированию дефекта нервной трубки, и является ли аномалия прямым результатом повышения уровня гомоцистеина, снижения уровня метионина или других метаболических нарушений.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Дефекты развития нервной трубки
Что такое Дефекты развития нервной трубки —
Дефекты развития нервной трубки — (neural tube defects) — ряд врожденных пороков, связанных с нарушением нормального развития нервной трубки.
Врожденные уродства развития являются одной из главных причин детской смертности и инвалидности. В Украине в 2001 году родилось почти 400 тысяч детей, из них 48 тысяч имели уродства. Значительное место в этой патологии занимают дефекты развития нервной трубки, которые формируют различные нарушения нервной системы: от пороков развития позвоночника и спинного мозга до анэнцефалии. При грубых дефектах развития невральной трубки (анэнцефалия, полное незаращение позвоночника и другие) плод погибает внутриутробно или рождается нежизнеспособным и погибает в ближайшие часы или дни после рождения. Поэтому социальный и медицинский аспекты грубых дефектов развития невральной трубки сводятся к профилактике формирования дефекта, его ранней диагностике и своевременному прерыванию беременности. Иные проблемы возникают при менее грубых нарушениях формирования спинного мозга и позвоночника, объединенных понятием спинальные дизрафии, или дефекты развития нервной трубки, которые в зарубежной литературе объединены термином spina bifida.
Историческая справка
Исследования палеонтологов убедительно свидетельствуют о том, что врожденные пороки развития позвоночника и спинного мозга существуют также давно, как и человек. Известны описания дефектов развития позвоночника у взрослого человека неолитического периода (5000 лет до нашей эры), бронзового (3000 лет до нашей эры) и позднего железного века (800 лет до нашей эры).
Упоминания об опухолевых образованиях поясничной области мы находим в трудах Гиппократа (460–370 гг. до нашей эры). В работах итальянского анатома Морганьи Батиста (1688–1771 гг.) приведен обзор литературы XVI и XVII столетий, касающейся спинальных дизрафий, дано описание патологии дефектов невральной трубки с указанием связи spina bifida и гидроцефалии, spina bifida и анэнцефалии. Об этом пишут Pieter van Foreest (1522-1597 гг.), Nikolas Tulpii (1593–1674 гг.), Миколай Бидло (1714 г.). Лечению эта патология не подлежала, оно было бесперспективно.
XIX век открывает современную историю изучения спинальных дизрафий. В 1875 году R. Virchov убедительно доказал существование у человека скрытых незаращений позвоночника — spina bifida occulta. В 1881 году А. Лебедев на основании экспериментов на куриных эмбрионах и изучения человеческих плодов сделал вывод о том, что менингомиелоцеле и анэнцефалия являются крайними проявлениями одного и того же нарушения развития. Он также доказал возможность скрытых аномалий формирования нервной трубки. В 1886 году Recklinghausen опубликовал монографию, в которой подробно описал spina bifida как результат нарушения формирования нервной трубки, впервые выделил три ее вида: менингоцеле, менингомиелоцеле и миелоцистоцеле. Все работы исследователей носили описательный характер, хотя и связывали нарушения движений, недержание мочи, деформацию позвоночника и стоп с наличием дефекта развития нервной трубки — со spina bifida.
В доантисептический период лечение спинномозговых грыж сводилось к сдавливанию мешка и повторным проколам его. Рекомендованный Velpeau (1846) метод впрыскивания в полость мешка раствора йода не нашел распространения из-за частых осложнений и даже смерти пациентов. Более эффективный способ лечения был предложен доктором Вауer в 1889 году, который «закрывал» костный дефект выкроенным из подлежащих тканей мышечно-апоневротическим лоскутом. Предложенные в дальнейшем модификации этой методики остаются основными в хирургии спинномозговых грыж и в настоящее время. Однако до 50-х годов XX столетия отношение к хирургическому лечению спинальных дизрафий было отрицательным. В 1929 году J. Fraser опубликовал результаты хирургического лечения 131 ребенка в королевской детской больнице г. Эдинбурга (Англия). После операции выжили 82 ребенка. В течение года после операции еще 16 детей погибли от прогрессирующей гидроцефалии, большая часть выживших детей стали тяжелыми инвалидами. И вновь встал вопрос о целесообразности хирургического лечения спинальных дизрафий. Ситуация изменилась после внедрения в 50-х годах имплантируемых клапанных дренажных систем для лечения гидроцефалии (F. Nulsen, T. Spits, 1951; R. Pudenz, F. Russel, 1957). В сочетании с разработкой новых эффективных антибиотиков для лечения воспалительных осложнений, дренирующие операции, по существу, «открыли двери» для хирургического лечения спинномозговых грыж у детей, включая новорожденных. Однако это поставило новые проблемы перед ортопедами, урологами, неврологами, психологами. У детей часто обнаруживали парезы конечностей, деформации позвоночника и стоп, недержание мочи, задержку физического и психического развития, что требовало конкретного лечения. В 1957 году в Лондоне создано первое «Общество исследования гидроцефалии и spina bifida». По его примеру мультидисциплинарные группы медиков (нейрохирургов, ортопедов, урологов, неврологов, психиатров) для лечения детей со spina bifida были организованы во многих странах.
Что провоцирует / Причины Дефектов развития нервной трубки:
У эмбриона на 20-й день после зачатия на дорсальной стороне формируется нервная пластинка, края которой позднее начинают смыкаться, образуя нервную трубку.
Примерно на 23-й день эта трубка должна полностью закрываться, открытыми остаются только отверстия на ее концах. Если к четвертой неделе беременности часть нервной трубки не сомкнётся полностью или если трубка закрылась, но позднее разошлась, например, вследствие повышенного давления спинномозговой жидкости в первом триместре беременности, у плода может появиться дефект позвоночника.
Пороки развития позвоночника могут быть также следствием вирусной инфекции, облучения и воздействия неблагоприятных факторов окружающей среды. Однако чаще пороки развития спинного мозга встречаются у детей, матери которых уже рожали детей с такими отклонениями. Видимо, наследственность также играет определенную роль.
Какие же факторы способствуют появлению дефекта развития нервной трубки? Во-первых, генетический дефект, унаследованный от одного из родителей. Во-вторых, воздействие неблагоприятных факторов внешней среды, способствующих появлению мутаций в гене. Известно, что встречаемость дефектов развития нервной трубки колеблется от 1:500 до 1:2000 живых новорожденных в различных регионах мира и этнических группах населения, составляя в среднем 1:1000. Однако, если в семье родителей или ближайших родственников встречались случаи рождения детей с дефектами нервной трубки, то вероятность появления ребенка с дефектом возрастает до 2-5%. Это же относится к рождению второго ребенка, если первый родился с дефектом (риск составляет около 5%). Настораживающим моментом в этом плане также являются спонтанные аборты (выкидыши), преждевременные роды, младенческая смертность в семье и у родственников.
Поэтому генетическая предрасположенность к появлению ребенка с дефектом нервной трубки является основным показателем включения беременной в группу высокого риска. К внешним факторам, способствующим появлению дефекта развития нервной трубки, относятся:
— радиация (проживание в районах, загрязненных радионуклидами, работа с источниками радиационного излучения);
— токсические вещества химического происхождения (нефтепродукты, удобрения, пестициды и т. д.);
— применение женщиной до беременности и в первые ее месяцы противосудорожных препаратов;
— высокая температура тела или применение горячих ванн в начале беременности;
— сахарный диабет и ожирение;
— несбалансированное питание, дефицит витаминов и особенно фолиевой кислоты.
Обнаружение одного, а тем более, нескольких из этих факторов, является основанием для включения беременной в группу высокого риска рождения ребенка с дефектом развития нервной трубки.
Патогенез (что происходит?) во время Дефектов развития нервной трубки:
Для понимания сущности формирования пороков развития позвоночника и спинного мозга необходимо, хотя бы в общих чертах, представить процесс эмбриогенеза этих структур. На первой неделе беременности у зародыша происходит деление клеток с образованием зародышевых узелков. На второй неделе — формирование внезародышевых частей и образование осевых органов зародыша. На третьей неделе идет процесс образования первичной невральной трубки из наружного зародышевого листка, который проходит стадии первичной (3-4-я недели беременности) и вторичной (4-7-я недели беременности) нейруляции.
Именно на этих этапах эмбриогенеза возникают первичные нарушения нейруляции и формирование спинальных дизрафий. В стадии вторичной нейруляции могут появляться пороки развития пояснично-крестцового отдела позвоночника. Поэтому ранние периоды беременности, если это не связано с наследственными факторами, являются определяющими для формирования дефектов развития невральной трубки, и все современные методы предупреждения этой патологии распространяются на периоды до наступления беременности и ее первые недели.
Симптомы Дефектов развития нервной трубки:
Несмотря на то, что на связь наследственности и частоты спинномозговых грыж указывали еще исследователи XIX века, истинный интерес генетиков к этой проблеме появился в последние десятилетия XX века.
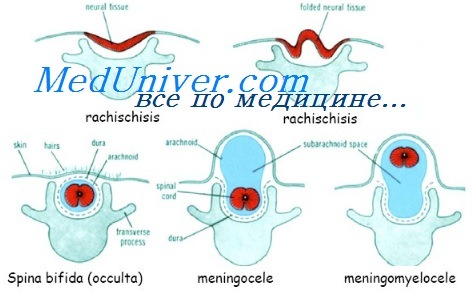
В настоящее время понятие «спинальные дизрафии» объединяет различные нарушения развития спинного мозга и позвоночника:
— spina bifida occulta — скрытое незаращение позвоночника;
— spina bifida cystica uverta — открытое расщепление позвоночника с формированием кистозной спинномозговой грыжи;
— rhachischiasis posterior (totalis et partialis) — расщепления позвоночника и мягких тканей с распластыванием спинного мозга, которые возникают на всем протяжении позвоночника или только в какой-то его части.
Скрытые незаращения позвоночника обычно локализуются в пояснично-крестцовой области и, как правило, клинически ничем не проявляются. Часто они являются случайной «находкой» при рентгенологическом исследовании позвоночника. Кожа в области незаращения дужки позвонка не изменена, но могут отмечаться пигментные пятна, подкожные жировики (липомы), свищевые ходы (дермальные синусы). Анатомическая сущность скрытой расщелины позвоночника состоит в неполном заращении дужки позвонка.
Со времени первых описаний скрытого незаращения позвоночника R. Virchow (1875), Recklinghausen (1886) считалось, что эта аномалия развития позвоночника, обусловленная нарушением окостенения, не требует медицинской помощи. По данным А. Д. Сперанского, опубликованным в 1925 году в работе «Происхождение spina bifida occulta в крестцовом отделе позвоночного столба человека», утверждалось, что неполное смыкание крестцовых дужек встречается у 70% людей и является нормой. Лишь последующие анатомические исследования и данные современных методов диагностики (компьютерная томография, ядерно-магнитная томография) позволили обнаружить сопутствующие изменения в местах дефекта дужек позвонков, которые приводят к ночному недержанию мочи, к болям в пояснично-крестцовой области, нарушению осанки, реже к слабости мышц ног, деформации стоп, чувствительным и трофическим нарушениям. Именно эти случаи spina bifida occulta требуют хирургической помощи.
Открытые кистозные расщепления позвоночника (истинные спинномозговые грыжи) в зависимости от степени вовлечения в патологический процесс нервных структур разделяют на следующие.
1. Оболочечные формы (менингоцеле) — расщепление позвоночника с выпячиванием в дефект твердой мозговой оболочки, но без вовлечения в процесс нервных структур. Твердая мозговая оболочка после выхода из костного дефекта истончается и исчезает. Купол грыжевого мешка представлен тонкой пиальной оболочкой. Кожа грыжевого выпячивания истончена, а на вершине нередко отсутствует. Содержимое грыжевого мешка — мозговые оболочки и ликвор (спинномозговая жидкость), форма его — обычно стебельчатая с суженной ножкой. Костный дефект захватывает обычно два-три позвонка. Каких-либо клинических проявлений при данной форме спинномозговых грыж не отмечается и только угроза разрыва грыжевого мешка, увеличивающиеся его размеры служат основанием для хирургической пластики дефекта.
2. Корешковая форма (менингорадикулоцеле) — расщепление позвоночника с выпячиванием в дефект оболочек спинного мозга и его корешков, которые частично могут заканчиваться в стенке мешка или входить в него, создавая петлю, но в дальнейшем, распространяясь в межпозвонковые отверстия, формируют нормальные нервы. Костный дефект захватывает 3-5 позвонков. Неврологический дефект при этой форме спинномозговых грыж зависит от количества вовлеченных в патологический процесс корешков, слепо заканчивающихся в стенке грыжевого мешка. В зависимости от этого дефекты могут проявляться от легкой слабости в конечностях и тазовых нарушений до грубых парезов и недержания мочи.
3. Мозговая форма (менингомиелоцеле или менингомиелорадикулоцеле) — расщепление позвоночника с вовлечением в грыжевой мешок оболочек, спинного мозга и его корешков. Пиальная оболочка выстилает грыжевой мешок, твердая мозговая оболочка заканчивается в зоне расщепления позвоночника, спинной мозг и корешки часто слепо заканчиваются в грыжевом мешке. Костный дефект обычно широкий и протяженный, захватывает от 3 до 6-8 позвонков. Шейки, как таковой, грыжевой мешок не имеет и из спинномозгового канала непосредственно переходит в грыжевое выпячивание. Кожа на вершине выпячивания отсутствует, грыжа покрыта тонким просвечивающимся листком пиальной оболочки. Степень неврологического дефекта всегда тяжелая — отсутствие движений в конечностях, их недоразвитие, деформации, недержание мочи и кала. Именно эта мозговая форма спинномозговых грыж встречается наиболее часто, и она нередко приводит к разрыву грыжевого мешка с истечением спинномозговой жидкости — к ликворее.
4. Кистозная форма (миелоцистоцеле) — достаточно редкая форма спинномозговых грыж, при которых конечный отдел спинного мозга резко расширен за счет центрального канала спинного мозга. Поэтому грыжевой мешок выстлан изнутри цилиндрическим эпителием, как и центральный канал. Нервные корешки отходят от наружной поверхности грыжевого выпячивания и направляются к межпозвонковым отверстиям. Степень неврологического дефекта, как и при мозговой форме, тяжелая — отсутствие движений в конечностях, грубые тазовые нарушения.
5. Осложненная форма (spina bifida complicata) характеризуется сочетанием одной из вышеперечисленных форм спинномозговых грыж с доброкачественными опухолями (липомами, фибромами), которые фиксированы к оболочкам, спинному мозгу или его корешкам.
Незаращение позвоночника и мягких тканей с несформировавшимся спинным мозгом (rhachischiasis posterior) является крайней степенью уродства, никогда не сопровождается кистозным компонентом и выпячиванием образования над кожей. Дефект кожи, мягких тканей, заднего полукольца позвоночного канала зияет, и в его глубине видна полоска нервной ткани с большим количеством мелких сосудов (area medullo-vasculosa). Дефект кожи прикрыт фрагментированной пиальной оболочкой с истечением ликвора. Частичный рахишизис у живых новорожденных обычно распространяется на 3-5 позвонков.
Типичным для всех видов и форм спинальных дизрафий является их заднее расположение с дефектом заднего полукольца позвоночного канала. Крайне редко (менее 1% случаев) незаращение формируется на переднебоковой поверхности канала, и возникают передние спинномозговые грыжи. При пояснично-крестцовой локализации эти грыжи распространяются в малый таз и затрудняют процесс дефекации. При более высоком расположении они могут сдавливать образования грудной клетки, шеи, носоглотки.
Расположение спинномозговых грыж по длиннику позвоночного столба в 90% случаев ограничивается пояснично-крестцовой областью. Грудная и шейная локализации грыж относительно редки. Интересно, что при исследовании материала спонтанных абортов японские ученые обнаружили более частое нарушение формирования позвоночника и спинного мозга в грудном и шейном отделах, а также высокую частоту дефектов, захватывающих весь позвоночный столб. Это, в определенной степени, говорит о том, что эмбрион и плод с грубым дефектом формирования невральной трубки, как правило, погибают.
Диагностика Дефектов развития нервной трубки:
Несмотря на успехи в ранней диагностике дефектов развития нервной трубки, благодаря внедрению в практику биохимических методик (исследование содержания α-фетопротеина и ацетилхолинестеразы в сыворотке крови матери и околоплодных водах), методов интраскопии плода (ультразвуковой, ядерно-магнитный) основное значение в снижении частоты этой аномалии принадлежит предупредительным мероприятиям. Учитывая, что причины возникновения дефектов развития нервной трубки многофакторные и эти факторы известны, обоснованно формирование групп риска беременных, у которых вероятность рождения ребенка с дефектом наиболее высока. Поэтому во всем мире признано, что при планировании беременности родителям необходимо обследоваться у врача-генетика, а будущей матери у гинеколога, чтобы предпринять меры по профилактике уродств развития нервной трубки, отнести беременных к различным группам риска и с различной настороженностью контролировать течение беременности.
Оптимальный алгоритм пренатального обследования для снижения частоты дефектов развития нервной трубки предполагает следующее.
1. В период планирования беременности — консультации врача-генетика, терапевта, акушера-гинеколога, при необходимости уролога. Выделение групп беременных с высоким и низким риском рождения ребенка с дефектом развития нервной трубки.
2. Пренатальная диагностика и объем обследования беременных отличаются в различных группах риска.
В группах низкого риска проводятся:
— ежемесячные консультации (осмотры) акушером;
— во втором триместре беременности анализ крови беременной на содержание α-фетопротеина и ацетилхолинестеразы (при повышенных уровнях — повторный анализ их содержания в околоплодных водах и ультразвуковое обследование плода). Если наличие дефекта нервной трубки подтверждается, ставится вопрос о прерывании беременности;
— в третьем триместре беременности — ультразвуковое исследование и подготовка к родам.
В группах высокого риска проводятся:
— ежемесячный осмотр акушером;
— во втором триместре беременности обязательный многократный контроль содержания α-фетопротеина и ацетилхолинестеразы в сыворотке крови и околоплодных водах, многократное ультразвуковое исследование плода с целью обнаружения возможных врожденных уродств развития плода, в сложных ситуациях используют магнитно-резонансное обследование.
Подтверждение дефекта развития нервной трубки — обычно основание для прерывания беременности, но современные методы пренатальной диагностики не являются абсолютными. Они чаще диагностируют сам факт наличия дефекта, однако не всегда можно уточнить степень выраженности его. В то же время, степень вовлечения в патологический процесс нервных структур считается определяющей для прогноза. При менингоцеле и своевременной хирургической помощи ребенок полноценно развивается, а в будущем становится нормальным трудоспособным человеком. При менингомиелоцеле даже хирургическая помощь не обеспечивает высокого качества жизни, ребенок будет инвалидом, нередко тяжелым. Поэтому обнаружение у плода дефекта развития нервной трубки — всегда веское основание для прерывания беременности.
Значительно сложнее ситуация в семьях, где беременность долгожданна, а перспектива новой беременности маловероятна. Если выраженность дефекта уточнить не удается, используют дополнительные методы диагностики: ядерно-магнитную резонансную томографию (МРТ), но и она не всегда позволяет ответить на поставленные вопросы. Тогда врачи совместно с родителями, объясняя все обстоятельства и возможные исходы, решают судьбу плода.
Лечение Дефектов развития нервной трубки:
Сразу после рождения ребенка акушер, реаниматолог и неонатолог устраняют угрожающие жизни состояния (отсутствие самостоятельного дыхания, нарушение температуры тела и т. д.), определяют грубые нарушения жизненно важных функций организма, исключая возможность хирургического вмешательства, определяют показатели крови, включая группу крови и резус-фактор. Раневую поверхность в области грыжи обрабатывают дезинфицирующими растворами, прикрывают стерильными салфетками, ребенка укладывают на живот с опущенным головным концом. При отсутствии грубых витальных нарушений, после беседы с родителями и их согласия на операцию ребенка срочно переводят в нейрохирургическое отделение, где проводят только те исследования, которые обеспечивают успешное проведение операции (общие анализы, если они не были проведены в роддоме, УЗИ).
Вопрос ургентного вмешательства возникает при разрывах спинномозговых грыж с истечением спинномозговой жидкости (ликвореей) или угрозе таких разрывов при резком истончении тканей (кожи) грыжевого мешка. Срочность вмешательства связана с наличием «открытых ворот» для инфекции при ликворее, и чем раньше прекращена ликворея, тем меньше возможность инфицирования и развития менингитов, менингоэнцефалитов. Ликворея, продолжающаяся более 24 часов, практически всегда приводит к развитию гнойно-воспалительных процессов в нервной системе, что является основной причиной негативных результатов лечения; в этом случае удаление спинномозговых грыж и устранение ликвореи осложняется гнойно-воспалительными процессами в 78% случаев. При проведении операции в первые 24 часа ликвореи частота гнойно-воспалительных осложнений снижается до 3%. Именно эти данные легли в основу проведения срочных оперативных вмешательств у детей со спинномозговыми грыжами, осложненными ликвореей, или при угрозе ликвореи.
Основным принципом операций при спинномозговых грыжах являются удаление грыжевого мешка, восстановление целости твердой мозговой оболочки (устранение источника ликвореи) и мягких тканей в области грыжевого мешка, устранение фиксации спинного мозга и его корешков.
От существовавшей ранее методики сшивания мягких тканей (кожи) в месте истечения ликвора давно отказались, как не оправдавшей надежд. Разрывы тканей и ликворея обычно возникают на вершине грыжевого мешка, где кожа резко истончена или отсутствует. Поэтому наложенные швы «прорезаются» и ликворея возобновляется. Кроме потери времени для радикальной операции, эта манипуляция ни к чему хорошему не приводит. Приходится отказываться от операции до купирования менингита, что удается далеко не всегда и является основной причиной летальных исходов при спинномозговых грыжах.
При ургентных вмешательствах, естественно, объем обследования минимален и должен обеспечивать информацию, необходимую для проведения операции и сохранения жизни ребенка. Все уточняющие исследования сопутствующей патологии, непосредственно не угрожающие жизни, должны быть отложены на послеоперационный период. Минимальный объем обследования указан выше.
Все оперативные вмешательства по удалению спинномозговых грыж проводятся под общим обезболиванием с использованием искусственной вентиляции легких. Мониторирование показателей пульса, артериального давления, насыщения крови кислородом, температуры тела, особенно для самых маленьких пациентов, обязательно, потому что срыв компенсации витальных функций у них происходит незаметно и очень быстро.
Удаление грыжевого мешка производят путем иссечения кожи на границе измененных тканей окаймляющим разрезом. Грыжевой мешок линейно вскрывают, содержимое мешка медленно удаляют (положение больного с опущенной головой для уменьшения истечения ликвора и предупреждения резкой ликворной гипотензии) и осуществляют ревизию содержимого грыжевого мешка. Впаянные или «заканчивающиеся» в стенке грыжевого мешка нервные элементы (корешки, конечная нить, спинной мозг) осторожно освобождают. Этот момент особенно важен для предупреждения усугубления неврологических нарушений и профилактики синдрома фиксированного спинного мозга в дальнейшем. Все манипуляции проводят с использованием увеличительной оптики, микроинструментария и биполярной микрокоагуляции.
Дефект твердой мозговой оболочки (грыжевые ворота) в зависимости от формы и размеров ушивают кисетным, узловым или непрерывным швом. При большом размере дефекта оболочки производят пластическое его закрытие с применением участка апоневроза, фрагмента консервированной твердой мозговой оболочки или ее искусственного аналога. Костный дефект заднего полукольца позвоночного канала даже при его больших размерах пластически не «закрывают». Все попытки костной пластики, которые применяли ранее, в настоящее время отвергнуты ввиду малой эффективности и увеличения числа осложнений при их применении.
Хирургия частичного рахишизиса имеет некоторые особенности, связанные с морфологической структурой — отсутствием грыжевого выпячивания, значительными по размеру дефектами кожи, наличием не сформировавшегося в трубку спинного мозга (area medulla-vasculosa). Последняя прикрыта и спаяна с арахноидальной оболочкой, через которую просачивается ликвор. Кожу рассекают окаймляющим разрезом на границе неизмененных тканей, тупо сепарируют мягкие ткани до выделения сохранившейся твердой мозговой оболочки, ее края берут на лигатуры.
Арахноидальную оболочку, спаянную с area medulla-vasculosa, осторожно отделяют, а при невозможности отделения многократно обрабатывают перекисью водорода и раствором антибиотика. Распластанную area medulla-vasculosa атравматическим швом (6-00 или 7-00), захватывая латеральные края арахноидальной оболочки, «сворачивают» в трубку. Ревизируют субарахноидальные пространства на уровне костного дефекта, выделяют спинной мозг от арахноидальных спаек для свободного циркулирования ликвора. При выраженном в этом случае спаечном процессе иногда возникает необходимость в дополнительной ламинэктомии вышележащего позвонка, чтобы рассечь арахноидальные спайки. Далее приступают к формированию мешка твердой мозговой оболочки. При ушивании ее краев не должны сдавливаться спинной мозг и его корешки. При недостаточных размерах сохранившейся твердой мозговой оболочки возникает необходимость в пластическом закрытии дефекта. Для этого используют апоневроз, широкую фасцию бедра или искусственную твердую мозговую оболочку. Хорошо зарекомендовала себя методика ушивания или пластики твердой мозговой оболочки на введенной субарахноидально трубке (силикон, полиэтилен, полипропилен), когда обеспечивается натяжение тканей при ушивании и гарантируется формирование свободного субарахноидального пространства для ликвороциркуляции.
Герметичность закрытия твердой мозговой оболочки предупреждает развитие ликвореи и сопутствующих гнойно-воспалительных осложнений в послеоперационном периоде.
Закрытие кожного дефекта при спинномозговых грыжах часто представляет значительные сложности из-за размера дефекта. Мягкие ткани ушивают в несколько слоев. Это создает, с одной стороны, дополнительную герметизацию субдурального пространства, с другой — обеспечивает сближение краев кожной раны. Натяжение ее краев недопустимо, так как это чревато прорезанием швов, расхождением краев раны. Стягивание осуществляется за счет сближения краев апоневроза. Возможно применение способа растяжения тканей за счет проведения надрезов (насечек) апоневроза перпендикулярно линиям натяжения тканей, что обеспечивает увеличение размера кожно-апоневротического лоскута, при этом сохраняется достаточное кровоснабжение тканей. Возможно применение перемещения тканей, основанного на формировании послабляющих разрезов кожи и апоневроза параллельно основной ране. Производится мобилизация тканей в стороны от послабляющих разрезов, что позволяет ушить основную рану, наложить направляющие швы на дополнительные разрезы. Первично окаймляющий разрез кожи для уменьшения натяжения тканей может быть «переведен» в дугообразный, ромбовидный, Т-образный или другой формы, чтобы обеспечить сведение краев раны и уменьшить их натяжение. Значительно реже в ургентной хирургии спинномозговых грыж применяют пересадку кожно-апоневротического лоскута на ножке, свободную кожно-мышечную пластику с питающим сосудом.
В послеоперационном периоде требуются проведение активных лечебных мероприятий по предупреждению и лечению воспалительных осложнений со стороны легких, мочевого пузыря и почек (антибактериальная терапия), многократные перевязки и обработки раневой поверхности, снижение ликворного давления для предупреждения повторной ликвореи. Активную реабилитацию нарушенных функций начинают после снятия швов, заживления операционной раны и купирования воспалительных осложнений.
Основные принципы ургентной и плановой хирургии спинномозговых грыж мало отличаются друг от друга, только возможности плановой хирургии несколько больше, а имеющийся временной резерв, кроме детального дооперационного обследования, позволяет подготовиться более тщательно к операции. При плановой хирургии приходится сталкиваться со случаями, когда грыжевой мешок представлен рубцовой тканью, имеет место грубая фиксация нервных структур к рубцовоизмененной стенке грыжевого мешка. Нежное обращение с корешками и спинным мозгом, возможность наращивания прилежащих тканей путем введения в подапоневротическое пространство рядом с грыжевым мешком силиконовых баллонов (эспандеров) и увеличение их объема на протяжении месяцев обеспечивают высокую эффективность плановых операций.
Отдельной проблемой плановой хирургии является сочетание спинномозговых грыж с прогрессирующей гидроцефалией, когда возникает проблема выбора последовательности операций или их совмещения с одномоментным удалением грыжевого мешка и ликворошунтированием. Оптимальным следует считать одномоментную операцию, при которой устраняется спинномозговой дефект и нормализуется ликворное давление. Это обеспечивает профилактику повышения внутричерепного давления после удаления грыжи, являющейся резервуаром (амортизатором) подъемов давления, и предупреждает вторичную послеоперационную ликворею, обусловленную ликворной гипертензией. Однако чаще приходится сталкиваться с ситуациями, когда одномоментное вмешательство невозможно (тяжесть состояния, малый вес, значительные размеры грыжевого мешка, выраженность гидроцефалии и гипертензии). В зависимости от выраженности того или иного компонента, определяющего состояние больного, а также состояния грыжевого мешка, производят вначале шунтирующую операцию, а через 7-10 дней — удаление грыжи или наоборот.
Профилактика Дефектов развития нервной трубки:
Профилактика spina bifida в странах Европейского союза
Последние 10 лет гинекологи могут предупреждать пороки развития нервной трубки плода. Это можно сделать, если женщина принимает конкретную дозу (400 микрограмм в день) фолиевой кислоты при планировании беременности и вплоть до истечения первого триместра беременности, поскольку нервная трубка плода закладывается именно в этот период.
В странах Европейского союза этот вопрос уже становится социально значимым, система здравоохранения вводит правила обязательного приема фолиевой кислоты. Речь идет о таких странах как Франция, Великобритания, Ирландия, Норвегия, Финляндия, Испания, Италия. Существует ряд исследований, доказавших, что ежедневный прием 400 микрограмм фолиевой кислоты предупреждает развитие пороков нервной трубки плода. В 2005 году Министерство здравоохранения Италии утвердило закон, в соответствии с которым фолиевая кислота в дозировке 400 микрограмм включена в перечень лекарственных средств, обязательно выдаваемых по медицинской страховке всем планирующим беременность женщинам. В соответствии с этим законом, по заказу Министерства Италии, компания Италфармако занимается производством препарата Фолибер.
Министерство здравоохранения Италии, в рамках национальной программы, ставит своей целью на протяжении 5 лет снизить частоту развития spina bifda на 60% путем приема препарата Фолибер.
К каким докторам следует обращаться если у Вас Дефекты развития нервной трубки:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Дефектов развития нервной трубки, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Источник