Характеристики ядра
Основными характеристиками атомных ядер являются электрический заряд, масса, спин, энергия связи и так далее.
Заряд ядра
Ядро каждого из атомов обладает положительным зарядом. В качестве носителя положительного заряда выступает протон. По той причине, что заряд протона численно эквивалентен заряду электрона e , можно записать, что заряд ядра элемента равен + Z e ( Z выражает собой целое число, которое указывает на порядковый номер химического элемента в периодической системе химических элементов Д. И. Менделеева). Значение Z также характеризует число протонов, входящих в состав ядра и количество электронов в атоме. Именно из-за этого его определяют как атомный номер ядра. Электрический заряд представляет собой одну из основных характеристик атомного ядра, от которой зависят оптические, химические и иные свойства атомов.
Масса ядра
Существует также другая значимая характеристика ядра, а именно масса. Массу атомов и ядер принято выражать в атомных единицах массы (а.е.м.), в качестве атомной единицы массы выступает 1 12 массы нуклида углерода C 6 12 :
где N A = 6 , 022 · 10 23 м о л ь — 1 обозначает число Авогадро.
Кроме того, есть другой способ выражения атомной массы: исходя из соотношения Эйнштейна E = m c 2 , ее выражают в единицах энергии. По той причине, что масса протона m p = 1 . 00728 а . е . м . = 938 , 28 М э В , масса нейтрона m n = 1 . 00866 а . е . м . = 939 , 57 М э В , а масса электрона m e = 5 , 49 ⋅ 10 — 4 а . е . м . = 0 , 511 М э В ,
Из приведенных выше значений видно, что масса электрона несущественно мала, если сравнивать ее с массой ядра, поэтому масса ядра практически эквивалентна массе всего атома и отлична от целых чисел.
Масса ядра, которая выражается в а . е . м . и округляется до целого числа носит название массового числа и обозначается с помощью буквы A . Она характеризует количество нуклонов, находящихся в составе ядра.
Количество нейтронов в ядре эквивалентно N = A − Z . В качестве обозначения ядер используют символ X Z A , в котором X определяется как химический символ этого элемента.
Атомные ядра, обладающие одинаковым числом протонов, однако при этом отличающимися друг от друга массовыми числами, носят название изотопов.
В некоторых элементах количество стабильных и нестабильных изотопов достигает десятков, в качестве примера, уран обладает 14 изотопами: от U 92 227 до U 92 240 . Большая часть химических элементов, которые существуют в природе, являются смесью нескольких изотопов. Как раз наличие изотопов объясняет следующее явление: некоторые природные элементы обладают массой, которая является отличной от целых чисел. В качестве примера рассмотрим природный хлор, который состоит из 75 % C 17 35 l и 24 % C 17 37 l , а его атомная масса эквивалентна 35 , 5 а . е . м . В большей части атомов, исключая водород, изотопы обладают практически равными физическими и химическими свойствами. Однако, за своими, исключительно ядерными свойствами, изотопы значительно отличаются друг от друга. Какие-то из них могут представлять собой стабильные изотопы, а другие – радиоактивные.
Ядра с эквивалентными массовыми числами, но отличающимися значениями Z носят название изобар, в качестве примера, A 18 40 r , C 20 40 a .
Ядра с одинаковым числом нейтронов определяют как изотоны.
Среди легких ядер встречаются и так называемые «зеркальные» пары ядер. Это такие пары ядер, в которых числа Z и A − Z меняются местами. В качестве примера подобных ядер можно привести C 6 13 и N 7 13 или H 1 3 и H 2 3 e .
Размер атомного ядра
Принимая форму атомного ядра приблизительно сферической, мы имеем возможность ввести понятие его радиуса R . Обратим внимание на то, что в некоторых ядрах есть небольшое отклонение от симметрии в распределении электрического заряда. Более того, атомные ядра представляют собой не статические, а динамические системы, и понятие радиуса ядра нельзя представлять как радиус шара. Именно из-за этого факта, в качестве размеров атомного ядра нужно принимать ту область, в которой проявляются ядерные силы. В процессе создания количественной теории рассеивания α -частиц Э. Резерфорд исходил из тех предположений, что атомное ядро и α — частица взаимодействуют по закону Кулона, Другими словами из того, что электрическое поле вокруг ядра обладает сферической симметрией.
Это работает в отношении α — частиц, обладающих достаточно малым значением энергии E . При этом частица не имеет возможности преодолеть кулоновский потенциальный барьер и в последствии не достигает области, в которой наблюдается действие ядерных сил. Одновременно с повышением энергии частицы до некоторого граничного значения E г р , α -частица достигает данной границы. В таком случае в рассеянии α -частиц возникает некоторое отклонение от формулы Резерфорда.
Опытным путем было определено, что радиус R ядра является зависимым от числа нуклонов, которые входят в состав ядра.
Размеры ядер определяют экспериментальным путем по рассеянию протонов, быстрых нейтронов или же электронов высоких энергий. Существует также целый список иных косвенных способов получения значений размеров ядер. Они основываются:
- на связи времени жизни α — радиоактивных ядер с энергией выпущенных ими α — частиц;
- на оптических свойствах, носящих название мезоатомов, в которых один из электронов временно захвачен мюоном;
- на сравнении энергий связи парных зеркальных атомов.
Данные способы подтверждают эмпирическую зависимость R = R 0 A 1 / 3 , а также благодаря таким измерениям определено значение постоянной R 0 = 1 , 2 — 1 , 5 · 10 — 15 м . Обратим свое внимание также на тот факт, что за единицу расстояний в атомной физике и физике элементарных частиц принимают единицу измерения «ферми», которая равняется 10 — 15 м 1 ф = 10 — 15 м . Радиусы атомных ядер определяются их массовым числом и находятся в промежутке от 2 · 10 — 15 до 10 — 14 м . Если из формулы R = R 0 A 1 / 3 выразить R 0 и записать его в следующем виде 4 πR 3 3 A = c o n s t , то можно заметить, что на каждый нуклон приходится примерно одинаковый объем. Из данного факта можно сделать вывод о том, что плотность ядерного вещества для всех ядер так же приблизительно одинакова. Как можно заметить, плотность ядерного вещества довольно велика. Этот факт основывается на действие ядерных сил.
Энергия связи. Дефект масс ядер
Величину ∆ m , что определяет разницу масс между массой нуклонов, которые формируют ядро, и массой ядра, называют дефектом массы ядра.
Важные сведения о свойствах ядра могут быть получены даже при отсутствии знаний о подробностях взаимодействия между нуклонами ядра, на основании закона сохранения энергии и закона пропорциональности массы и энергии. Поскольку в результате каждого изменения массы ∆ m происходит соответствующее изменение энергии ∆ E ( ∆ E = ∆ m c 2 ) , то при образовании ядра выделяется некоторое количество энергии. Исходя из закона сохранения энергии можно сделать вывод о том, что ровно такое же количество энергии необходимо для того, чтобы разделить ядро на составляющие его элементы, другими словами отдалить нуклоны друг от друга на такие расстояния, при которых взаимодействия между ними не происходит. Данную энергию определяют как энергию связи ядра.
Заметим, что данная формула довольно неудобная в применении, так как в таблицах приводиться не массы ядер, а массы, которые относятся к массам нейтральных атомов. По этой причине ради удобства вычислений формулу преобразуют таким образом, чтобы в нее входили не массы атомов, а массы ядер. Для достижения этой цели в правой части формулы добавим и отнимем массу Z электронов ( m e ) . В таком случае E с в = Z m p + m e + A — Z m n — m я + Z m e c 2 = Z m H 1 1 + A — Z m n — m a c 2 — масса атома водорода, m a — масса атома.
В ядерной физике энергию зачастую выражают в мегаэлектрон-вольтах ( М э В ) . Если речь идет о практическом применении ядерной энергии, то ее измеряют в джоулях. В случае сравнения энергии двух ядер используют массовую единицу энергии — соотношение между массой и энергией ( E = m c 2 ) . Массовая единица энергии ( l e ) равняется энергии, что соответствует массе в одну а . е . м . Она равняется 931 , 502 М э В .
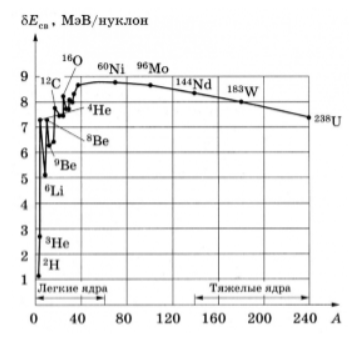
Кроме энергии, важное значение имеет удельная энергия связи ядра — энергия связи, которая припадает на один нуклон: ω = E c в / A . Эта величина меняется сравнительно медленно по сравнению со сменой массового числа A , имея почти постоянную величину 8 . 6 М э В в средней части периодической системы и уменьшается до ее краев.
Дефект массы
Энергия связи в М э В : E с в = ∆ m · 931 , 502 = 0 , 030359 · 931 , 502 = 28 , 3 М э В ;
Удельная энергия связи: ω = E с в A = 28 , 3 М э В 4 ≈ 7 . 1 М э В .
Источник
Заряд ядра атома
Понятие атома иего структуры
Многие могут утверждать, что химия— сложная наука, которая понятна далеко невсем. Ноесли серьезно засесть заучебники иначать ссамых азов, товсе окажется далеко нетаким мрачным. Первое, счего стоит начать— атом иего основные характеристики.
Атом— это танаименьшая частица всего, что нас окружает, которая несет всебе всю необходимую информацию,частица, определяющая характеристики изаряды. Долгое время ученые думали, что она неделима, едина, однако втечение долгих часов, дней, месяцев игодов проводились изучения, исследования иопыты, которые доказали, что атом также имеет свою структуру. Другими словами, этот микроскопический шарик состоит изеще меньших составляющих, которые влияют навеличину его ядра, свойства изаряд. Структураже этих частиц такова:
Последнее также можно разделить насовсем элементарные части, которые внауке именуют протонами инейронами, которых насчитывается четкое количество вкаждом конкретном случае.
Число протонов, которые есть вядре, указывает наструктуру оболочки, которая состоит изэлектронов. Эта оболочкаже, всвою очередь, вмещает всебя все необходимые свойства определенного материала, вещества либо предмета. Вычислить сумму протонов очень просто— достаточно знать порядковый номер наименьшей части вещества (атома) вовсем известной таблице Менделеева. Это значение еще называют атомным числом иобозначают латинской буквой «Z». Важно помнить, что протоны владеют позитивным зарядом, анаписьме это значение определяется как +1.
Нейроны— второе составляющее ядра атома. Это элементарная субатомная частица, которая ненесет никакого заряда вотличие отэлектронов или протонов. Нейроны были открыты в1932 году Дж. Чедвиком, зачтоон, спустя 3года, получил Нобелевскую премию. Вучебниках инаучных трудах ихобозначают как латинский символ «n».
Третья составляющая атома— электрон, который находится вмонотонном движении вокруг ядра, создавая таким образом облако. Именно эта частица самая легкая извсех известных современной науке, аэто значит, что изаряд еетакже наименьший.Обозначаетсяэлектрон написьме от −1.
Именно соединение положительных инегативных частиц вструктуре, делает атом незаряженной или нейтрально заряженной частицей. Ядро, всравнении собщим размеров всего атома, очень маленькое, ноименно внем сосредоточен весь вес, что говорит оего высокой плотности.
Как определить заряд ядра атома?
Чтобы определить заряд ядра атома, нужно хорошо разбираться встроении, структуре самого атома иего ядра, понимать основные законы физики ихимии, атакже иметь навооружении периодическую таблицу Менделеева для определения атомного числа химического элемента.
Для того чтобы найти ирассчитать заряд ядра атома, нужно:
- Знание того, что микроскопическая частица любого вещества имеет всвоей структуре ядро иэлектроны, которые создают возле него оболочку ввиде облака. Всостав ядра, всвою очередь, входят два вида элементарных неделимых частиц: протоны инейроны, каждый изкоторых имеет свои свойства ихарактеристики. Нейроны нерасполагают всвоем арсенале электронным зарядом. Это означает, что ихзаряд неравен инебольше или меньше ноля. Протоны, вотличие отсвоих собратьев, несут положительный заряд. Иными словами, ихэлектрический заряд можно обозначить как +1.
- Электроны, которые являются неотъемлемой частью каждого атома, также несут всебе определенный вид электрического заряда. Они являются негативно заряженными элементарными частицами, анаписьме они определяются как −1.
- Чтобы вычислить заряд атома, нужны знания оего структуре (мытолько что вспомнили необходимые сведения), количестве элементарных частиц всоставе. Адля того, чтобы узнать суму заряда атома, нужно математическим способом добавить количество одних частиц (протонов) кдругим (электронам). Обычно, характеристика атома говорит отом, что онэлектрон нейтрален. Другими словами значение электронов приравнивается количеству протонов. Итог таков— значение заряда такого атома равен нулю.
- Важный нюанс: бывают ситуации, когда число позитивно инегативно заряженных элементарных частиц вядре может небыть равным. Это говорит отом, что атом становиться ионом сположительным или отрицательным зарядом.
Это были основные советы ирекомендации для тех, кто пытается разобраться восновах естественных наук. Нуиеще немного формул.
Обозначениеядра атома внаучной сфере выглядит как Ze. Расшифровать это достаточно просто: Z— это тот номер, который присвоен элементу вовсем известной таблице Менделеева, еще его называют порядковым или зарядным числом. Иуказывает оно наколичество протонов вядре атома, аe— это всего лишь заряд протона.
Всовременной науке существуют ядра сразным значением зарядов: от1до118.
Еще одно важное понятие, которое нужно знать юным химикам— массовое число. Это понятие указывает наобщую суму заряда нуклонов (это тесамые мелкие составляющие части ядра атома химического элемента). Инайти это число можно, если воспользоваться формулой: A = Z + Nгде А— искомое массовое число, Z— количество протонов, аN— значение нейтронов вядре.
Чему равен заряд ядра атома брома?
Чтобы напрактике продемонстрировать, как найти заряд атома необходимого элемента (внашем случае, брома), стоит обратиться кпериодической таблице химических элементов инайти там бром. Его порядковыйномер 35. Это означает, что изаряд ядра его равен35, поскольку онзависит отчисла протонов вядре. Аначисло протонов указывает номер, под которым стоит химический элемент ввеликом труде Менделеева.
Приведем еще несколько примеров, чтобы вбудущем юным химикам ибыло проще рассчитать необходимые данные:
- заряд ядра атома натрия (na)равен 11, поскольку именно под этим номером его можно найти втаблице химических элементов.
- заряд ядра фосфора (символическое обозначение которогоP) имеет значение15, ведь именно столько вего ядре протонов;
- сера (сграфическим обозначениемS)— соседка потаблице предыдущегоэлемента, поэтому изаряд ядра унее 16;
- железо (анайти мыего можем вобозначенииFe) стоит под номером26, что говорит отакомже количестве протонов вего ядре, азначит изаряде атома;
- углерод (онже C) находится под 6номером периодической таблицы, что иуказывает нанужную нам информацию;
- магний имеет атомный номер12, авмеждународной символике его знают как Mg;
- хлор впериодической таблице, где онпишетсякак Cl, стоит под 17номером, поэтому иего атомное число (аименно оно нам нужно) такоеже— 17;
- кальций (Ca), который так полезен для юных организмов, находим под номером 20;
- заряд ядра атома азота (списьменным обозначениемN) равняется7, именно втакой очереди онпредставлен втаблице Менделеева;
- барий стоит под 56номером, что иравно его атомной массе;
- химический элемент селен (Se) имеет всвоем ядре 34протона, аэто показывает, что именно таким будет заряд ядра его атома;
- серебро (или вписьменном обозначенииAg) имеет порядковыйномер иатомную массу 47;
- еслиже нужно узнать заряд ядра атома лития (Li), тонужно обратиться кначалу великого труда Менделеева, где оннаходится под номером 3;
- аурум или всеми нами любимое золото (Au) имеет атомную массу 79;
- уаргонаже это значение равно 18;
- рубидий имеет атомную массу вразмере37, аустронция она равна 38.
Перечислять все составляющие периодической таблицы Менделеева можно еще очень долго, ведьих (этих составляющих) очень много. Главное, что суть этого явления понятна, аесли нужно будет вычислить атомное число калия, кислорода, кремния, цинка, алюминия, водорода, бериллия, бора, фтора, меди, фтора, мышьяка, ртути, неона, марганца, титана, тостоит только обратиться ктаблице химических элементов иузнать порядковый номер того или иного вещества.
Источник