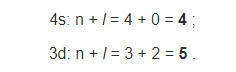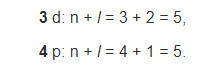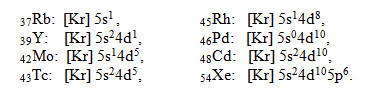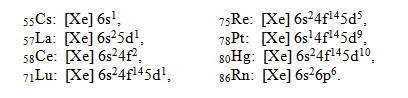Электронная структура атомов
Основными характеристиками атома, которые определяют его поведение в химических реакциях и при образовании простых веществ, является строение внешнего электронного слоя и энергия электронов относительно положительно заряженного ядра. Обе характеристики подлежат периодической зависимости от порядкового номера элемента, который всегда указывается в периодической таблице элементов.
Согласно современным квантово-механическими представлениями конфигурация электронной оболочки определяется зарядом ядра атома и положением элемента в периодической системе. Как уже установлено, электроны с одинаковым значением главного квантового числа образуют квантовые уровни, емкость которых увеличивается по мере удаления от ядра. Квантовые уровне, в свою очередь, построенные из подуровней, объединяющих электроны с одинаковым значением орбитального квантового числа. А подуровни состоят из орбиталей, на каждой из которых может находиться не более двух электронов.
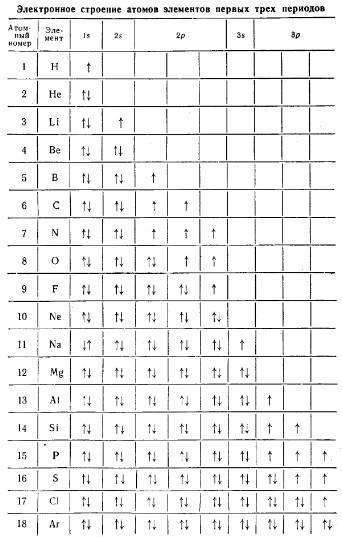
Распределение электронов в атоме выражают с помощью электронной формулы (условного записи распределения электронов в атоме с помощью квантовых чисел) и электронно-графической схемы — квантовых ячеек, в которых клеточка символизирует орбиталь, а стрелка — электрон.
Таблица 1 — Электронное строение атомов элементов первых трех периодов
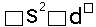
В электронных формулах цифрами указывают номер энергетического уровня, латинскими буквами — энергетические подуровни, а цифрами вверху справа — количество электронов на подуровне. Например, условная запись 5d 4 означает, что на d-подуровне пятого энергетического уровня размещаются четыре электрона.
При составлении электронной формулы атома любого элемента полезно помнить несколько очевидных закономерностей:
Общее количество энергетических уровней (а следовательно, и номер внешнего уровня) определяется значением главного квантового числа n и соответствует номеру периода, в котором размещается элемент.
Например, элемент магний (порядковый номер 12) находится в третьем периоде периодической системы элементов, поэтому двенадцать электронов атома Mg размещаются на трех энергетических уровнях. При этом третий, наиболее удаленный от ядра уровень является внешним, для него главное квантовое число n = 3.
Энергетические уровни расщепляются на энергетические подуровни, для описания которых используются буквенные обозначения орбитального квантового числа l. Количество энергетических подуровней на данном уровне совпадает с номером этого уровня и определяется значением главного квантового числа n (или количеством значений орбитального квантового числа l).
Таким образом, на первом энергетическом уровне (для которого n = 1) существует только один подуровень 1s (напомним: для s-подуровня орбитальное квантовое число l = 0), на втором — два подуровня (2s и 2p), на третьем — три (3s, 3p, 3d), на четвертом — четыре (4s, 4p, 4d, 4f) и т.д.
Энергетические подуровни состоят из орбиталей. Количество орбиталей на энергетическом подуровне определяется количеством значений магнитного квантового числа m, равное (2l + 1).
Графически орбитали изображаются в виде квантовых ячеек, каждая из которых имеет форму небольшого квадратика. Орбитали одного энергетического подуровня изображаются слитно:
Элементы малых периодов
В первых трех периодах, которые называются малыми (или типичными), с увеличением заряда ядра происходит заполнение электронами внешнего энергетического уровня, номер которого совпадает с номером периода в периодической системе.
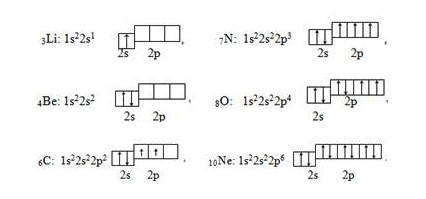
Первый период состоит из двух элементов. У атома водорода один электрон размещается на единой орбитали s-подуровня первого энергетического уровня (n = 1). Электронная формула водорода записывается:
В соответствии с принципом Паули на s-орбитали может находиться два электрона с антипараллельными спинами, поэтому электронная формула атома гелия имеет следующий вид:
Благодаря такому размещению электронов образуется устойчивая конфигурация, которая определяет химическую инертность гелия. В атоме гелия завершается застройка ближайшего к ядру первого энергетического уровня.
Элементы, в атомах которых застраивается электронами s-орбитали внешнего энергетического уровня, называются s-элементами.
Все s-элементы объединяются в s-электронную семью, которая в периодической системе элементов размещается в двух первых группах, за исключением s-элемента гелия Не, который традиционно зачисляют в VIII группу благодаря его принадлежности к инертным элементам.
У элементов второго периода происходит заполнение второго энергетического уровня (второй энергетический уровень, n = 2): сначала заполняется 2s-орбиталь, а затем последовательно три 2р-орбитали. Для упрощения на электронных схемах указываются только полностью заполненные энергетические уровни, например
Элементы Li и Be относятся к s-электронной семьи, поскольку в их атомах именно на s-подуровень поступает последний электрон — так называемый формообразующие электрон (или просто формирующий ), то есть, который определяет принадлежность атома к элементам конкретной электронной семьи. В следующих шести элементах, начиная от карбона 6С и заканчивая неоном 10Ne, формирующие электроны заполняют р-подуровень ( l = 1) второго энергетического L-уровня (n = 2).
Элементы, в атомах которых заполняются электронами р-орбитали внешнего энергетического уровня, называются р-элементами.
Cовокупность всех р-элементов составляет р-электронную семью. Р-элементы размещаются в III-VIII группах периодической системы Д.И.Менделеева.
Для s- и р-элементов присуща интересная особенность: количество внешних (валентных) электронов равно номеру группы. Справедливо и обратное утверждение: по количеству валентных электронов в атомах можно установить, в какой группе находится данный элемент.
Третий период, в котором проходит застройка третьего энергетического уровня (n = 3), как и второй, содержит восемь элементов: два s-элемента (Na, Mg) и шесть р-элементов (Al, Si, P, S, Cl, Ar ), причем конфигурация внешнего энергетического уровня соответствующих элементов второго и третьего периодов аналогична. Например, у элементов VII группы фтора и хлора заполнения электронами внешних энергетических уровней происходит подобным образом, что хорошо видно при сравнении электронных формул:
Благодаря одинаковой электронной конфигурации внешнего электронного слоя, для изображения внешнего энергетического уровня элементов F и Cl можно использовать общую формулу ns 2 np 5 , где n — значение главного квантового числа для внешнего уровня и одновременно номер периода.
Элементы с одинаковой электронной конфигурацией внешнего энергетического уровня называются элементами-аналогами .
Необходимо помнить, что у элементов третьего периода остается свободным 3d-подуровень.
Элементы больших периодов
Четвертый и пятый периоды содержат по восемнадцать элементов. В атомов элементов четвертого периода происходит застройка четвертого энергетического уровня (n = 4), начиная с 4s-орбитали. Появление электрона в 4s-состоянии при наличии свободных 3d-орбиталей обусловлено экранированием ядра электронами, образующими плотный и симметричный слой 3s 2 3p 6 . В связи с отталкиванием от этого слоя для формообразующего девятнадцатого электрона атома калия (№19) и формообразующего двадцатого электрона атома кальция (№20) наиболее выгодным является 4s-состояние:
Застройка электронами внешнего 4s-подуровня атомов К и Са при наличии свободного 3d-подуровня согласуется с первым правилом Клечковского: сумма главного n и орбитального l квантовых чисел для 4s-подуровня меньше, чем для 3d:
А согласно второму правилу Клечковского после 4s-подуровня, несмотря на одинаковую сумму (n + l = 5), будет заполняться электронами 3d, а не 4p, поскольку именно 3d имеет меньшее значение главного квантового числа:
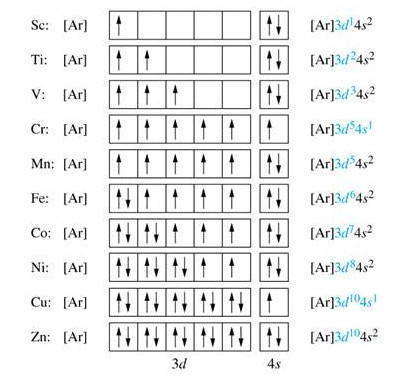
Итак, в десяти элементов — от скандия ( 21Sc) до цинка ( 30Zn) происходит заполнение электронами 3d-подуровня. Для сокращения записи электронных формул в квадратных скобках указывается символ предыдущего инертного элемента (в данном случае аргона Ar), что означает его электронную структуру, которая совпадает с электронными структурами внутренних электронных слоев рассматриваемого элемента. К примеру:
Элементы, в атомах которых заполняются d-орбитали второго снаружи энергетического уровня, называется d-элементами.
Электронная семья d-элементов, в атомах которых проходит заполнения электронами второго извне d-подуровня, размещаются в боковых подгруппах периодической системы Д.И.Менделеева.
Как показал анализ, в атомах некоторых d-элементов наблюдается самовольное перемещение электронов с n s-подуровня на ( n-1 ) d-подуровень. Такое явление называется проскоком электронов. Оно связано со стремлением атома иметь энергетически устойчивую конфигурацию, которой соответствуют полностью или наполовину застроенные электронами энергетические подуровни. Так, для атома хрома наблюдается процесс, когда электрон с 4s-подуровня переходит на 3d. Это приводит к энергетической стабилизации атома: 24Cr: [Ar] 4s 1 3d 5 .
В атоме элемента медь происходит такой же проскок электрона с 4s-подуровня на 3d: 29Сu: [Ar] 4s 1 3d 10 . В результате на внешнем уровне атома Сu остается только один электрон — именно этим объясняется, почему медь размещается в первой группе периодической системы в отличие от следующего элемента цинка ( 30Zn: [Ar] 4s 2 3d 10 ), который имеет два электрона на внешнем энергетическом уровне, что и определяет его принадлежность ко второй группе периодической системы.
Итак, четвертый период начинается 4s-элементами (двумя) и заканчивается 4р-элементами (шестью), а между ними располагаются десять 3d-элементов, в которых заполняется второй снаружи d-подуровень.
В пятом периоде заполнение энергетических уровней и подуровней происходит аналогично четвертому периоду, а именно: у атомов двух первых элементов ( 37Rb и 38Sr) застраиваются 5s-орбитали, у атомов следующих десяти (от 39Y до 48Cd) — 4d- орбитали, а еще в шести (от 49In до 54Xe) — 5p-орбитали. Надо отметить, что в пяти d-элементов пятого периода ( 41Nb, 42Mo, 44Ru, 45Rh, 47Ag) тоже, как и у атома хрома в четвертом периоде, наблюдается проскок одного, а в 46Pd — даже двух электронов с внешнего 5s-подуровня на предыдущей 4d-подуровень. Примеры электронных формул элементов пятого периода:
Шестой период , содержащий 32 элемента, начинается двумя s-элементами ( 55Cs, 56Ba), в атомах которых заполняется 6s орбиталь. В следующем элемента, лантанеа, формирующий, пятьдесят седьмой, электрон поступает на 5d-орбиталь (5d: n + l = 5 + 2 = 7), вопреки второму правилу Клечковского, вместо того, чтобы заполнять 4f-подуровень (4f: n + l = 4 + 3 = 7). Это явление обусловлено более резким уменьшением энергии 4f-электронов с ростом заряда ядра по сравнению с энергией 5d-электронов. Поэтому в 57La энергия 5d-электронов ниже, а в 58Се выше, чем энергия 4f-электронов. Но в следующих четырнадцати элементах от 58Се до 71Lu состояние 4f энергетически более выгодно, чем состояние 5d, поэтому в их атомах происходит застройка 4f-орбиталей.
Элементы, в атомах которых заполняются электронами f-орбитали третьего снаружи уровня, называются f-элементами.
Далее, начиная с 72Hf, продолжается заполнение 5d-орбиталей в десяти элементах до ртути 80Hg включительно. Период заканчивается р-элементами ( 81Tl — 86Rn), в атомах которых застраивается 6р подуровень. Проскоки электронов с внешнего 6s-подуровня на предыдущий 5d-подуровень наблюдаются в двух элементах: платине 78 Pt и золоте 79 Au. Примеры электронных структур элементов шестого периода:
Таким образом, шестой период состоит из двух s-элементов, шести р, десяти d- и четырнадцати f-элементов.
Седьмой период еще не завершен. Заполнение энергетических уровней и подуровней происходит в нем подобно тому, как и у атомов элементов шестого периода. Период начинается двумя s-элементами ( 87Fr, 88Ra ). За ними следуют d-элементы ( 89Ас, 90Th ), а затем тринадцать f-элементов ( 91Ра — 103Lr). Завершают периодическую систему d-элементы. Примеры электронных конфигураций элементов седьмого периода:
Источник
Что значит внешний слой электрона
Если вы внимательно посмотрели приложение 4, то, наверное, заметили, что у атомов некоторых элементов последовательность заполнения электронами орбиталей нарушается. Иногда эти нарушения называют «исключениями «, но это не так – исключений из законов Природы не бывает!
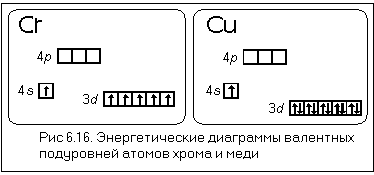
Первым элементом с таким нарушением является хром. Рассмотрим подробнее его электронное строение (рис. 6.16 а). У атома хрома на 4s-подуровне не два, как этого следовало бы ожидать, а только один электрон. Зато на 3d-подуровне пять электронов, а ведь этот подуровень заполняется после 4s-подуровня (см. рис. 6.4). Чтобы понять, почему так происходит, посмотрим, что собой представляют электронные облака 3d-подуровня этого атома.
Каждое из пяти 3d-облаков в этом случае образовано одним электроном. Как вы уже знаете из § 4 этой главы, общее электронное облако таких пяти электронов имеет шарообразную форму, или, как говорят, сферически симметрично. По характеру распределения электронной плотности по разным направлениям оно похоже на 1s-ЭО. Энергия подуровня, электроны которого образуют такое облако, оказывается меньше, чем в случае менее симметричного облака. В данном случае энергия орбиталей 3d-подуровня равна энергии 4s-орбитали. При нарушении симметрии, например, при появлении шестого электрона, энергия орбиталей 3d-подуровня вновь становится больше, чем энергия 4s-орбитали. Поэтому у атома марганца опять появляется второй электрон на 4s-АО.
Сферической симметрией обладает общее облако любого подуровня, заполненного электронами как наполовину, так и полностью. Уменьшение энергии в этих случаях носит общий характер и не зависит от того, наполовину или полностью заполнен электронами какой-либо подуровень. А раз так, то следующее нарушение мы должны искать у атома, в электронную оболочку которого последним «приходит»девятый d-электрон. И действительно, у атома меди на 3d-подуровне 10 электронов, а на 4s-подуровне только один (рис. 6.16 б).
Уменьшение энергии орбиталей полностью или наполовину заполненного подуровня является причиной целого ряда важных химических явлений, с некоторыми из которых вы еще познакомитесь.
В химии свойства изолированных атомов, как правило, не изучаются, так как почти все атомы, входя в состав различных веществ, образуют химические связи. Химические связи образуются при взаимодействии электронных оболочек атомов. У всех атомов (кроме водорода) в образовании химических связей принимают участие не все электроны: у бора – три электрона из пяти, у углерода – четыре из шести, а, например, у бария – два из пятидесяти шести. Эти «активные»электроны называются валентными электронами.
Валентные электроны – электроны, которые могут принимать участие в образовании атомом химических связей.
Иногда валентные электроны путают с внешними электронами, а это не одно и то же.
| Внешние электроны – электроны внешнего электронного слоя. |
Электронные облака внешних электронов имеют максимальный радиус (и максимальное значение главного квантового числа).
Именно внешние электроны принимают участие в образовании связи в первую очередь, хотя бы потому, что при сближении атомов электронные облака, образованные этими электронами, приходят в соприкосновение прежде всего. Но вместе с ними участие в образовании связи может принимать и часть электронов предвнешнего (предпоследнего) слоя, но только в том случае, если они обладают энергией, не сильно отличающейся от энергии внешних электронов. И те и другие электроны атома являются валентными. (У лантаноидов и актиноидов валентными являются даже некоторые «предвнешние» электроны)
Энергия валентных электронов намного больше, чем энергия других электронов атома, а друг от друга валентные электроны по энергии отличаются существенно меньше.
Внешние электроны – всегда валентные только в том случае, если атом вообще может образовывать химические связи. Так, оба электрона атома гелия – внешние, но назвать их валентными нельзя, так как атом гелия вообще никаких химических связей не образует.
Валентные электроны занимают валентные орбитали, которые в свою очередь образуют валентные подуровни.
| Валентные подуровни – электронные подуровни атома, на которых находятся, или могут находиться «свои «или «чужие «валентные электроны при образовании атомом химических связей. |
| Валентные орбитали – атомные орбитали, образующие валентные подуровни. |
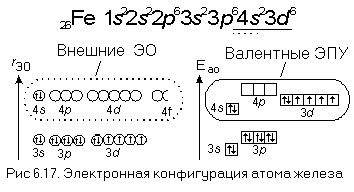
В качестве примера рассмотрим атом железа, электронная конфигурация которого показана на рис. 6.17. Из электронов атома железа максимальное главное квантовое число (n = 4) имеют только два 4s-электрона. Следовательно, именно они и являются внешними электронами этого атома. Внешние орбитали атома железа – все орбитали с n = 4, а внешние подуровни – все подуровни, образуемые этими орбиталями, то есть 4s-, 4p-, 4d— и 4f-ЭПУ.
Внешние электроны – всегда валентные, следовательно, 4s-электроны атома железа – валентные электроны. А раз так, то и 3d-электроны, имеющие чуть большую энергию, также будут валентными. На внешнем уровне атома железа кроме заполненной 4s-АО есть еще свободные 4p-, 4d— и 4f-АО. Все они внешние, но валентные среди них только 4р-АО, так как энергия остальных орбиталей значительно больше, и появление электронов на этих орбиталях для атома железа не выгодно.
Итак, у атома железа
внешний электронный уровень – четвертый,
внешние подуровни – 4s-, 4p-, 4d— и 4f-ЭПУ,
внешние орбитали – 4s-, 4p-, 4d— и 4f-АО,
внешние электроны – два 4s-электрона (4s 2 ),
внешний электронный слой – четвертый,
внешнее электронное облако – 4s-ЭО
валентные подуровни – 4s-, 4p-, и 3d-ЭПУ,
валентные орбитали – 4s-, 4p-, и 3d-АО,
валентные электроны – два 4s-электрона (4s 2 ) и шесть 3d-электронов (3d 6 ).
Валентные подуровни могут быть заполнены электронами частично или полностью, а могут и вообще оставаться свободными. С увеличением заряда ядра уменьшаются значения энергии всех подуровней, но из-за взаимодействия электронов между собой энергия разных подуровней уменьшается с разной «скоростью». Энергия полностью заполненных d— и f-подуровней уменьшается настолько сильно, что они перестают быть валентными.
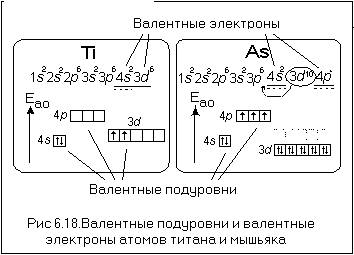
В качестве примера рассмотрим атомы титана и мышьяка (рис. 6.18).
В случае атома титана 3d-ЭПУ заполнен электронами только частично, и его энергия больше, чем энергия 4s-ЭПУ, а 3d-электроны являются валентными. У атома мышьяка 3d-ЭПУ полностью заполнен электронами, и его энергия существенно меньше энергии 4s-ЭПУ, и, следовательно, 3d-электроны не являются валентными.
В приведенных примерах мы анализировали валентную электронную конфигурацию атомов титана и мышьяка.
Валентная электронная конфигурация атома – распределение валентных электронов атома по уровням, подуровням и орбиталям.
Валентная электронная конфигурация атома изображается в виде валентной электронной формулы, или в виде энергетической диаграммы валентных подуровней.


2.Что общего между электронными конфигурациями атомов а) Li и Na, В и Al, O и S, Ne и Ar; б) Zn и Mg, Sc и Al, Cr и S, Ti и Si; в) H и He, Li и O, K и Kr, Sc и Ga. В чем их различия
3.Сколько валентных подуровней в электронной оболочке атома каждого из элементов: а) водорода, гелия и лития, б) азота, натрия и серы, в) калия, кобальта и германия
4.Сколько валентных орбиталей заполнено полностью у атома а) бора, б) фтора, в) натрия?
5.Сколько орбиталей с неспаренным электроном у атома а) бора, б) фтора, в) железа
6.Сколько свободных внешних орбиталей у атома марганца? А сколько свободных валентных?
7.К следующему занятию подготовьте полоску бумаги шириной 20 мм, разделите ее на клеточки (20 ? 20 мм), и нанесите на эту полоску естественный ряд элементов (от водорода до мейтнерия).
8.В каждой клеточке поместите символ элемента, его порядковый номер и валентную электронную формулу, как показано на рис. 6.19 (воспользуйтесь приложением 4).
В основу систематизации химических элементов положен естественный ряд элементов и принцип подобия электронных оболочек их атомов.
С естественным рядом химических элементов вы уже знакомы. Теперь познакомимся с принципом подобия электронных оболочек.
Рассматривая валентные электронные формулы атомов в ЕРЭ, легко обнаружить, что у некоторых атомов они отличаются только значениями главного квантового числа. Например, 1s 1 у водорода, 2s 1 у лития, 3s 1 у натрия и т. д. Или 2s 2 2p 5 у фтора, 3s 2 3p 5 у хлора, 4s 2 4p 5 у брома и т. д. Это значит, что внешние области облаков валентных электронов таких атомов по форме очень похожи и отличаются только размерами (и, конечно, электронной плотностью). А раз так, то электронные облака таких атомов и соответствующие им валентные конфигурации можно назвать подобными. Для атомов разных элементов с подобными электронными конфигурациями мы можем записать общие валентные электронные формулы: ns 1 в первом случае и ns 2 np 5 во втором. Двигаясь по естественному ряду элементов, можно найти и другие группы атомов с подобными валентными конфигурациями.
Таким образом, в естественном ряду элементов регулярно встречаются атомы с подобными валентными электронными конфигурациями. Это и есть принцип подобия электронных оболочек.
Попробуем выявить вид этой регулярности. Для этого воспользуемся сделанным вами естественным рядом элементов.
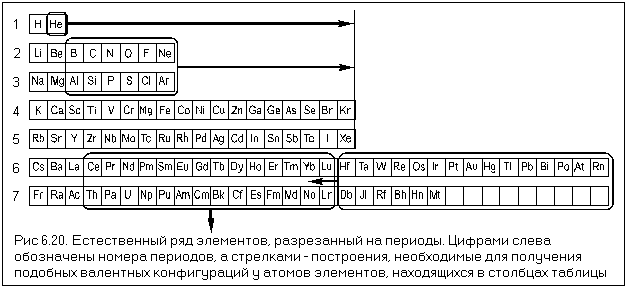
ЕРЭ начинается с водорода, валентная электронная формула которого 1s 1 . В поисках подобных валентных конфигураций разрежем естественный ряд элементов перед элементами с общей валентной электронной формулой ns 1 (то есть, перед литием, перед натрием и т. д.). Мы получили так называемые «периоды» элементов. Сложим получившиеся «периоды» так, чтобы они стали строками таблицы (см. рис. 6.20). В результате подобные электронные конфигурации будут только у атомов первых двух столбцов таблицы.
Попробуем добиться подобия валентных электронных конфигураций и в других столбцах таблицы. Для этого вырежем из 6-го и 7-го периодов элементы с номерами 58 – 71 и 90 –103 (у них происходит заполнение 4f— и 5f-подуровней) и поместим их под таблицей. Символы остальных элементов сдвинем по горизонтали так, как это показано на рисунке. После этого у атомов элементов, стоящих в одной колонке таблицы, получатся подобные валентные конфигурации, которые можно выразить общими валентными электронными формулами: ns 1 , ns 2 , ns 2 (n–1)d 1 , ns 2 (n–1)d 2 и так далее до ns 2 np 6 . Все отклонения от общих валентных формул объясняются теми же причинами, что и в случае хрома и меди (см. параграф 6.6).
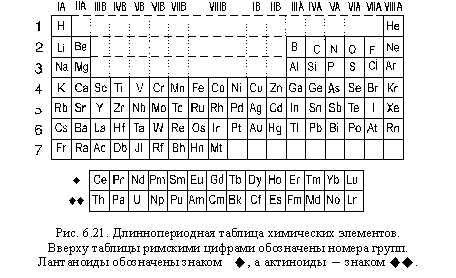
Как видите, использовав ЕРЭ и применив принцип подобия электронных оболочек, нам удалось систематизировать химические элементы. Такая система химических элементов называется естественной, так как основана исключительно на законах Природы. Полученная нами таблица (рис. 6.21) представляет собой один из способов графического изображения естественной системы элементов и называется длиннопериодной таблицей химических элементов.

Познакомимся подробнее со структурой длиннопериодной таблицы химических элементов.
Строки этой таблицы, как вы уже знаете, называются «периодами «элементов. Периоды нумеруются арабскими цифрами от 1 до 7. В первом периоде всего два элемента. Второй и третий периоды, содержащие по восемь элементов, называются короткими периодами. Четвертый и пятый периоды, содержащие по 18 элементов, называются длинными периодами. Шестой и седьмой периоды, содержащие по 32 элемента, называются сверхдлинными периодами.
Столбцы этой таблицы называются группами элементов. Номера групп обозначаются римскими цифрами с латинскими буквами А или В.
Элементы некоторых групп имеют свои общие (групповые) названия: элементы IА группы (Li, Na, K, Rb, Cs, Fr) – щелочные элементы (или элементы щелочных металлов); элементы IIA группы (Ca, Sr, Ba и Ra) – щелочноземельные элементы (или элементы щелочноземельных металлов)(название «щелочные металлы» и щелочноземельные металлы» относятся к простым веществам, образуемым соответствующими элементами и не должны использоваться как названия групп элементов); элементы VIA группы (O, S, Se, Te, Po) – халькогены, элементы VIIA группы (F, Cl, Br, I, At) – галогены, элементы VIIIA группы (He, Ne, Ar, Kr, Xe, Rn) – элементы благородных газов.(Традиционное название «благородные газы» также относится к простым веществам)
Выносимые обычно в нижнюю часть таблицы элементы с порядковыми номерами 58 – 71 (Ce – Lu) называются лантаноиды («следующие за лантаном»), а элементы с порядковыми номерами 90 – 103 (Th – Lr) – актиноиды («следующие за актинием «). Существует вариант длиннопериодной таблицы, в котором лантаноиды и актиноиды не вырезаются из ЕРЭ, а остаются на своих местах в сверхдлинных периодах. Такую таблицу иногда называют сверхдлиннопериодной.
Длиннопериодная таблица делится на четыре блока (или секции).
s-Блок включает элементы IA и IIA-групп с общими валентными электронными формулами ns 1 и ns 2 (s-элементы).
р-Блок включает элементы с IIIA по VIIIA группу с общими валентными электронными формулами от ns 2 np 1 до ns 2 np 6 (p-элементы).
d-Блок включает элементы с IIIB по IIB группу с общими валентными электронными формулами от ns 2 (n–1)d 1 до ns 2 (n–1)d 10 (d-элементы).
f-Блок включает лантаноиды и актиноиды (f-элементы).
Элементы s— и p-блоков образуют А-группы, а элементы d -блока – В-группы системы химических элементов. Все f-элементы формально входят в IIIB группу.
Элементы первого периода – водород и гелий – являются s-элементами и могут быть помещены в IA и IIA группы. Но гелий чаще помещают в VIIIA группу как элемент, которым заканчивается период, что полностью соответствует его свойствам (гелий, как и все остальные простые вещества, образуемые элементами этой группы, – благородный газ). Водород же часто помещают в VIIA группу, так как по своим свойствам он существенно ближе к галогенам, чем к щелочным элементам.
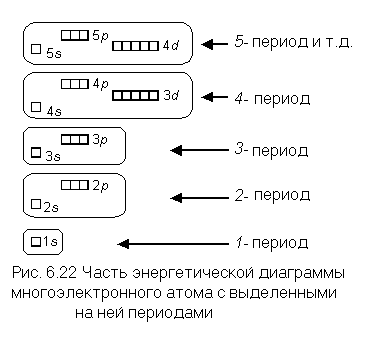
Каждый из периодов системы начинается с элемента, имеющего валентную конфигурацию атомов ns 1 , так как именно с этих атомов начинается формирование очередного электронного слоя, и заканчивается элементом с валентной конфигурацией атомов ns 2 np 6 (кроме первого периода). Это позволяет легко выделить на энергетической диаграмме группы подуровней, заполняющихся электронами у атомов каждого из периодов (рис. 6.22). Проделайте эту работу со всеми подуровнями, изображенными на сделанной вами копии рисунка 6.4. Выделенные на рисунке 6.22 подуровни (кроме полностью заполненных d— и f-подуровней) являются валентными для атомов всех элементов данного периода.
Появление в периодах s-, p-, d— или f-элементов полностью соответствует последовательности заполнения s-, p-, d— или f-подуровней электронами. Эта особенность системы элементов позволяет, зная период и группу, в которые входит данный элемент, сразу же записать его валентную электронную формулу.


2. Что общего между электронными конфигурациями атомов элементов А и В групп? Чем они различаются?
3.Сколько групп элементов входит в а) s-блок, б) р-блок, в) d-блок?
4.Продолжите рисунок 30 в сторону увеличения энергии подуровней и выделите группы подуровней, заполняющихся электронами в 4-м, 5-м и 6-м периодах.
5.Перечислите валентные подуровни атомов а) кальция, б) фосфора, в) титана, г) хлора, д) натрия. 6.Сформулируйте, чем отличаются друг от друга s-, p- и d-элементы.
7.Объясните, почему принадлежность атома к какому-либо элементу определяется числом протонов в ядре, а не массой этого атома.
8.Для атомов лития, алюминия, стронция, селена, железа и свинца составьте валентные, полные и сокращенные электронные формулы и изобразите энергетические диаграммы валентных подуровней. 9.Атомам каких элементов соответствуют следующие валентные электронные формулы: 3s 1 , 4s 1 3d 1 , 2s 2 2p 6 , 5s 2 5p 2 , 5s 2 4d 2 ?
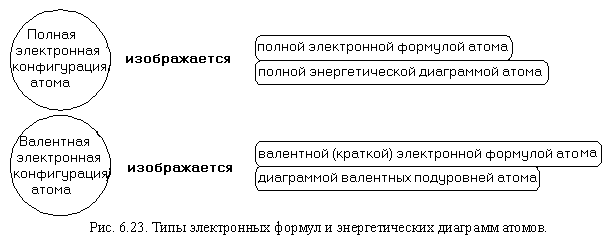
Для разных целей нам нужно знать либо полную, либо валентную конфигурацию атома. Каждая из этих электронных конфигураций может изображаться как формулой, так и энергетической диаграммой. То есть, полная электронная конфигурация атома выражается полной электронной формулой атома, или полной энергетической диаграммой атома. В свою очередь, валентная электронная конфигурация атома выражается валентной (или, как ее часто называют, «краткой «) электронной формулой атома, или диаграммой валентных подуровней атома (рис. 6.23).
Раньше мы составляли электронные формулы атомов, используя порядковые номера элементов. При этом мы определяли последовательность заполнения подуровней электронами по энергетической диаграмме: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s и так далее. И только записав полную электронную формулу, мы могли записать и валентную формулу.
Валентную электронную формулу атома, которая чаще всего и используется, удобнее записывать, исходя из положения элемента в системе химических элементов, по координатам период – группа.
Рассмотрим подробно, как это делается для элементов s-, p— и d-блоков.
Для элементов s-блока валентная электронная формула атома состоит из трех символов. В общем виде ее можно записать так:
На первом месте (на месте большой клеточки) ставится номер периода (равен главному квантовому числу этих s-электронов), а на третьем (в верхнем индексе) – номер группы (равен числу валентных электронов). Взяв в качестве примера атом магния (3-й период, IIA группа), получим:
Для элементов p-блока валентная электронная формула атома состоит из шести символов:
Здесь на месте больших клеточек также ставится номер периода (равен главному квантовому числу этих s— и p-электронов), а номер группы (равен числу валентных электронов) оказывается равным сумме верхних индексов. Для атома кислорода (2-й период, VIA группа) получим:
Валентную электронную формулу большинства элементов d-блока можно записать так:
Как и в предыдущих случаях, здесь вместо первой клеточки ставится номер периода (равен главному квантовому числу этих s-электронов). Число во второй клеточке оказывается на единицу меньше, так как на единицу меньше главное квантовое число этих d-электронов. Номер группы здесь тоже равен сумме индексов. Пример – валентная электронная формула титана (4-й период, IVB группа): 4s 2 3d 2 .
Номер группы равен сумме индексов и для элементов VIB группы, но у них, как вы помните, на валентном s-подуровне всего один электрон, и общая валентная электронная формула ns 1 (n–1)d 5 . Поэтому валентная электронная формула, например, молибдена (5-й период) – 5s 1 4d 5 .
Так же просто составить валентную электронную формулу любого элемента IB группы, например, золота (6-й период)>– >6s 1 5d 10 , но в этом случае нужно помнить, что d— электроны у атомов элементов этой группы еще остаются валентными, и часть из них может участвовать в образовании химических связей.
Общая валентная электронная формула атомов элементов IIB группы – ns 2 (n – 1)d 10 . Поэтому валентная электронная формула, например, атома цинка – 4s 2 3d 10 .
Общим правилам подчиняются и валентные электронные формулы элементов первой триады (Fe, Co и Ni). У железа, элемента VIIIB группы, валентная электронная формула 4s 2 3d 6 . У атома кобальта – на один d-электрон больше (4s 2 3d 7 ), а у атома никеля – на два (4s 2 3d 8 ).
Пользуясь только этими правилами написания валентных электронных формул, нельзя составить электронные формулы атомов некоторых d-элементов (Nb, Ru, Rh, Pd, Ir, Pt), так как у них за счет стремления к высокосимметричным электронным оболочкам заполнение электронами валентных подуровней имеет некоторые дополнительные особенности.
Зная валентную электронную формулу, можно записать и полную электронную формулу атома (см. далее).
Часто вместо громоздких полных электронных формул записывают сокращенные электронные формулы атомов. Для их составления в электронной формуле выделяют все электроны атома кроме валентных, помещают их символы в квадратные скобки и часть электронной формулы, соответствующую электронной формуле атома последнего элемента предшествующего периода (элемента, образующего благородный газ), заменяют символом этого атома.
Примеры электронных формул разных типов приведены в таблице 14.
Источник