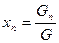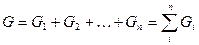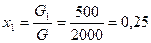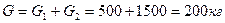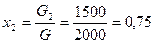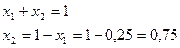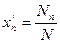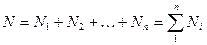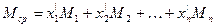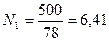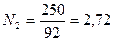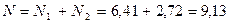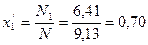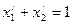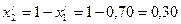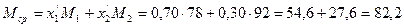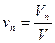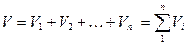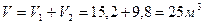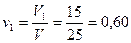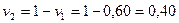Технология приготовления растворов
В процессе изготовления жидких лекарственных форм используют различные дисперсионные среды (растворители, экстрагенты).
Растворители — это индивидуальные химические соединения или их комбинации, способные растворять различные вещества, т.е. образовывать с ними однородные системы, состоящие из одного или нескольких компонентов. Они представляют собой составную часть раствора, как правило, большую. Растворитель способствуют лучшему проникновению в кровь, различные ткани растворенного вещества. При этом сам растворитель не влияет на организм человека и соответственно не является лекарственной субстанцией. В качестве растворителя чаще всего используют воду дистиллированную (т.е. воду, не содержащую минеральных солей и каких-либо других примесей), реже — спирт этиловый 70, 90, 95%-ный, глицерин и жидкие масла (вазелиновое, оливковое, персиковое). Следовательно, выделяют водные, спиртовые, глицериновые и масляные растворы.
Экстрагенты составляют меньшую часть в растворе. Они представляют собой непосредственно активное вещество, оказывающее влияние на течение болезни, а также такие растворители, которые используются для экстракции растительного или другого биологического сырья. К дисперсионным средам предъявляются такие требования, как достаточная растворяющая способность при изготовлении растворов, химическая индифферентность и биологическая безвредность, отсутствие неприятного вкуса и запаха, благоприятных для размножения микроорганизмов условий, а также экономичность в производстве. Экстрагенты, кроме того, должны обладать избирательной растворимостью, высокими диффузионными способностями для обеспечения проникновения их через поры биологического материала, десорбирующими свойствами.
В технологическом отношении важнейшим вопросом, связанным с растворением жидкостей, является концентрация растворов, другими словами — сколько вещества необходимо растворить или смешать в каком количестве или с каким количеством. Необходимая концентрация растворов определяется указаниями в рецепте или в стандартный прописи, регламентируемой Государственной Фармакопеей. Концентрация раствора — это количество растворенного вещества, содержащегося в определенном весовом количестве или определенном объеме раствора.
В фармацевтической практике концентрация растворов выражается различными способами:
При первом способе концентрация обозначается например: 1 + 9, т.е. в 9 частях растворителя растворяется (смешивается) 1 часть растворяемого вещества.
Второй способ предполагает использование соединительных знаков: “:”, “=”, “—”. Например, 1 : 10, или 1 = 10, или 1—10. Во всех трех случаях 1 весовую часть исходного вещества смешивают с 9 частями растворителя.
При третьем способе выражения концентрации раствора важно различать весовые, объемные и весообъемные проценты. Они неравнозначны. Весовой процент обозначает 1 весовую часть растворенной жидкости (вещества) в 100 весовых частях раствора. Объемный процент — 1 объемная часть (например, 1 мл) растворяемой жидкости в 100 объемных частях (мл) раствора.
Весообъемный процент соответствует 1 весовой части (грамму) растворенной жидкости в 100 объемных частях (мл) раствора.
Весовые и объемные проценты связаны друг с другом следующим соотношением:
A = B х (I1 / I2), где
А — концентрация в весовых процентах;
B — концентрация в объемных процентах;
I1 — плотность исходной жидкости;
I2 — плотность полученного раствора.
Весовые и весообъемные проценты связаны отношением:
A = C х (1 / I3), где
А — концентрация в весовых процентах;
С — концентрация в весообъемных процентах;
I3 — плотность полученной жидкости.
Объемные и весообъемные проценты также связаны между собой:
В = С х (1 / I1), где
В — концентрация раствора в объемных процентах;
С — концентрация в весообъемных процентах;
I1 — плотность исходной жидкости.
Если концентрация выписанного в рецепте лекарственного вещества указана в процентах, следует подразумевать весообъемные проценты. А вот под процентным содержанием спирта (70, 96%-ный) следует подразумевать объемный процент. Растворы с большой концентрацией растворенного вещества называются концентрированными, с малой концентрацией — разбавленными. Необходимо различать понятия “концентрированный” и “насыщенный” раствор.
Насыщенный раствор — это такой раствор, в котором взятое вещество больше не растворяется даже при длительном взбалтывании (перемешивании). Концентрированный раствор не обязательно должен быть насыщенным. Например, состав, содержащий 50 г кальция хлорида в 100 мл раствора, является достаточно концентрированным, но при комнатной температуре он далеко не насыщенный. Для получения насыщенного раствора при этом следует дополнительно взять около 80 г кальция хлорида. В некоторых случаях насыщенный раствор может быть разбавленным. Как правило, это наблюдается, если данное вещество плохо растворяется в растворителе. Так, насыщенный раствор кальция сульфата, который при 20 °С содержит только 0,21 г кальция сульфата в 100 мл жидкости, является достаточно разбавленным. Необходимая концентрация растворов определяется соответствующими указаниями в рецепте или, если раствор стандартизован, в соответствующей прописи. Количественно концентрацию растворов выражают одним из трех способов: чаще всего — в процентах, реже (при больших разведениях) — в отношениях (например, 1 : 1000, 1 : 5000 и т.п.) и совсем редко — в массообъемных соотношениях (например, 0,1 — 200 мл, 0,5 — 180 мл и т.п.).
В процентах.
Rp.: Solutionis Natrii bromidi 2 % — 200 ml
D. S. По 1 ст. л. 3 раза в день.
Раздельным способом, т.е. перечислением растворяемого вещества и растворителя.
Aquae destillatae 200 ml
M. D. S. По 1 ст. л. 3 раза в день.
С указанием доведения раствора до заданного объема.
Aquae destillatae ad 200 ml
M. D. S. По 1 ст. л. 3 раза в день.
Отношением количества вещества в граммах к количеству раствора в мл.
Rp: Solution is natrii bromidi ex 4,0 — 200 ml
D. S. По 1 ст. л. 3 раза в день.
Отношением количества вещества к количеству раствора в частях (в данном случае используются знаки деления “:”, например, 1 : 10, т.е. 1 весовую часть исходного вещества необходимо растворить до получения 10 мл раствора, т.е. получается 10%-ный раствор).
Rp.: Solutionis Natrii bromidi 1 : 50—200 ml
D. S. По 1 ст. л. 3 раза в день.
Этот способ прописывания обычно используют для растворов ядовитых веществ.
Пример
Rp.: Solutionis Hydrargyri dichloridi 1 : 500—5000 ml.
Иногда используется способ выражения концентрации раствора отношением растворенного вещества к растворителю (например, 1 + 2; 1 + 9). При этом 1 весовая часть растворяемого вещества растворяется в 2 частях по массе или соответственно в 9 частях по массе растворителя, т.е. в первом случае получается 33,3%-ный раствор, во втором — 10%-ный раствор. Наиболее часто для выписывания растворов используют первый способ, т.е. обозначение концентрации раствора в процентах. При этом важно различать процент по массе, процент по объему и процент по массообъему. Процент по массе обозначает 1 часть (по массе) растворенного вещества в 100 частях (по массе) раствора, процент по объему — соответственно 1 часть по объему (например, 1 мл) вещества в 100 частях по объему (мл) раствора. Процент по массообъему соответствует 1 части по массе (гр) растворенного вещества в 100 частях по объему (мл) раствора.
Связь процентов по массе и по объему можно выразить соотношением:
А = B х r1 / r2, где
А — концентрация в процентах по массе;
B — концентрация в процентах по объему;
r1 — плотность исходной жидкости;
r2 — плотность получаемого раствора.
Проценты по массе и проценты по массообъему связаны другим отношением:
А = С х 1 / r3, где
А — концентрация раствора в процентах по массе;
С — концентрация раствора в процентах по массообъему;
r3 — плотность раствора.
Переход от процентов по объему к процентам по массообъему можно осуществить с помощью следующей формулы:
B = С х 1 / r1, где
B — концентрация раствора в процентах по объему;
С — концентрация раствора в процентах по массообъему;
r1 — плотность исходной жидкости.
Если концентрация прописанного в рецепте раствора указана в процентах, то следует подразумевать проценты по массообъему. При определении спирта под его процентным содержанием понимают процент по объему. Официальные растворы, т.е. произведенные в промышленных условиях, могут продаваться с этикеткой без указания на ней концентрации раствора, так как всем (работающим в медицине) людям известно, что, к примеру, в изотоническом растворе натрия хлорида содержится 1,8 г натрия хлорида на 200 г воды (т.е. раствор 0,9% концентрации).
Растворы, применяемые в фармацевтической практике, готовят различными способами — по массе, объему и массообъемным способом. Наиболее распространен последний способ, при котором растворяемое вещество берут по массе, а растворитель добавляют до получения требуемого объема раствора. Объемный способ используется для изготовления растворов этанола различной крепости.
По массе обычно готовят растворы на вязких растворителях, таких как глицерин, масла растительные (при этом растворяемое вещество и растворитель берут в количествах по массе). Процесс изготовления растворов включает несколько стадий: проверку доз веществ списков А и Б, расчет количества растворителя, растворение, фильтрование, упаковку, укупорку, контроль качества готового препарата.
Источник
Глоссарий
- The ratio between the width and height of a video picture. the standard aspect ratio for cctv monitors, ntsc and pal systems is 4:3.
The relationship between the section height and section width of a tire expressed as a percentage of section width. if the section height is one half the section width, the aspect ratio is 50%.
Отношение ширины изображения к высоте.
Относительное удлинение — термин из области аэродинамики и определяемый длиной профиля, крыла или паруса, разделенной на ширину. парус, плавник или шверт с большим относительным удлинением — длинный и узкий, а с малым относительным удлинением — короткий и
Относительное удлинение а уел asphalt and perchlorate асфальтовое и `перхлоратсодержащее ракетное топливо
The ratio of width to height for the frame of the televised picture. 4:3 for standard systems, 5:4 for 1k x 1k, and 16:9 for hdtv.
The ratio of width to height for the frame of the televised picture. 4:3 for standard systems
This is the ratio between the width and height of a television or cinema picture
Отношение ширины изображения к его высоте.
The ratio of width over height of an image, 43 for a standard tv image, 169 for wide screen.
The ratio of horizontal to vertical dimensions of an image. (35mm slide frame is 3:2, tv 4:3, hdtv 16:9, 4×5 film 5:4)
The ratio of picture width to height (4 to 3 for north american ntsc broadcast video).
This is the ratio between the width and height of a television or cinema picture display. the present aspect ratio of the television screen is 4:3, which means four units wide by three units high. such aspect ratio was elected in the early days of television, when the majority of movies were of the same format. the new, high definition television format proposes a 16:9 aspect ratio.
Aspect ratio refers to the shape, or format, of the image produced by a camera. the ratio is derived by dividing the width and height of the image by their common factor. the aspect ratio of a 35mm image (36 x 24mm) is found by dividing both numbers by their common factor: 12. so, if you divide each by 12, your resulting ratio will be 3:2. most computer monitors and digital cameras have a 4:3 aspect ratio. many digital cameras offer the option of switching between 4:3, 3:2, or 16:9.
The ration of horizontal to vertical dimensions of an image. for example, 35mm slide film = 3:2, tv = 4:3, hdtv = 16:9, 4×5 film = 5:4.
[1] the depth of a rudder relative to its fore-and-aft length. [2] the height of a ship’s hull relative to its beam. [3] the length of the luff of a sail relative to the length of its foot. [4] the ratio of the span of an aerofoil to its mean chord.
Источник
Весовой, объемный и мольный состав
Смесь, состоящая из двух и более компонентов, характеризуется свойствами и содержанием этих компонентов. Состав смеси может быть задан массой, объемом, количеством !числом молей или килограмм-молей) отдельных компонентов, а также значениями их концентраций. Концентрацию компонента в смеси можно выразить в весовых, мольных и объемных долях или процентах, а также в других единицах.
Весовая доля хi, какого-либо компонента определяется отношением массы Gi, данного компонента к массе всей смеси G:

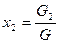
Учитывая, что суммарная масса смеси равна сумме масс отдельных компонентов смеси, т.е.:
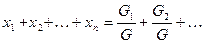
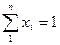
Пример 1. Смесь состоит из двух компонентов: G1= 500 кг, G2 = 1500 кг. Определить весовую долю каждого компонента в смеси.
Решение. Весовая доля первого компонента:
Весовая доля второго компонента:
Весовую долю второго компонента можно определить также, используя равенство (48):
Мольная доля х 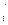
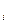
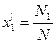
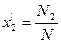
Учитывая, что
Получим 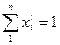
Зная’ мольную долю в смеси и молекулярный вес каждого компонента, можно определить средний молекулярный вес смеси по формуле:
или 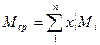
Пересчет мольных долей в весовые можно проводить по формуле:
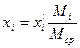
Пример 2. Смесь состоит из 500 кг бензола и 250 кг толуола. Определить мольный состав смеси.
Решение. Молекулярный вес бензола равен 78, толуола — 92. Число килограмм-молей равно:
бензола
толуола
общее число килограмм-молей:
Мольная доля бензола равна:
Для толуола мольная доля может быть найдена из равенства (49):
откуда:
Пример 3. Пользуясь данными Примера 2, определить средний молекулярный вес смеси.
Решение. В Приложении 2 находим молекулярный вес компонентов: для бензола М= 78, для толуола М = 92. Мольные доли (см. Пример 2): бензола 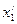
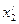
Объемная доля vi компонента в смеси равна отношению объема Vi данного компонента к объему всей смеси V:

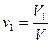
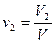
Учитывая, что
Можно написать: 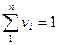
Пример 4. Газ состоит из двух компонентов: V1 = 15, 2 м 3 метана и V2 = 9,8 м 3 этана. Подсчитать объемный состав смеси.
Решение. Общий объем смеси равен:
Объемная доля в смеси:
метана
этана (см. формулу 52):
88. Смесь состоит из трех компонентов: н-пентана (G1 = 100 кг), н-гексана (G2 = 60 кг) и н-гептана (G3 = 40 кг). Определить весовую и мольную доли этих компонентов в смеси.
89. Определить мольный состав смеси, состоящей из н-пентана (G1= 30 кг) и н-гептана (G2 = 20 кг).
90. Определить мольный состав и средний молекулярный вес смеси двух компонентов, если для первого компонента G1= 2500 кг, М1 = 108, а для второго G2 =1500 кг и М2 = 160.
91. Определить мольную долю следующих фракций в нефти:
| Фракции: | Масса, кг. | Молекулярный вес |
| Бензиновая | ||
| Лигроиновая | ||
| Керосиновая | ||
| Соляровая | ||
| Мазут |
ЛАБОРАТОРНЫЕ ЗАНЯТИЯ
Общие положения работы в лаборатории
Для работы в лаборатории допускаются только те студенты, которые изучили и успешно сдали зачет по правилам техники безопасности работы в химической лаборатории.
После сдачи зачета по правилам техники безопасности и получения от преподавателя на выполнение одной из работ из лабораторного практикума студент обязан:
1) внимательно изучить методику проведения и меры предосторожности при выполнении данной работы;
2) сдать зачет по методике проведения и мерам предосторожности при выполнении данной работы и получить на разрешение полученного задания;
3) перед выполнением работы надеть спецодежду (халат), получить у лаборанта необходимые реактивы и приступить к выполнению работы.
В процессе выполнения работы студенту запрещается:
1) оставлять работающие приборы или установку без присмотра либо поручать наблюдение за ними другим студентам, не знающим мер безопасной работы на этих приборах или установке;
2) выливать в раковины низкотемпературные охлаждающие смеси, остатки агрессивных или органических веществ и выпускать в атмосферу лаборатории остаточные газы из приборов или установки;
3) устранять возникшие неисправности на работающих приборах или установке;
4) пить воду из лабораторной посуды и принимать пищу в помещении лаборатории.
Источник