- Роль макрофагов в маточно-плацентарных взаимодействиях при урогенитальном хламидиозе
- Интерпретация клеточного состава, особенности изменений в клетках при различных патологических процессах
- Расшифровка результатов цитологии при предраковых патологиях
- Оксана Жосан, гинеколог-онколог. Редактор А. Герасимова
- Чем предраковые клетки, обнаруженные при цитологии шейки матки, отличаются от здоровых и злокачественных
- Как выглядят предраковые клетки при проведении цитологии шейки матки. Расшифровка и интерпретация терминов, встречающихся в результатах исследования
- Результаты цитологии при различных предраковых состояниях
Роль макрофагов в маточно-плацентарных взаимодействиях при урогенитальном хламидиозе
Сибирский государственный медицинский университет, г. Томск
Введение. Макрофаги, наряду с NK-клетками (Natural killer, естественными киллерными клетками), являются наиболее многочисленной популяцией иммунокомпетентных клеток в маточно-плацентарной области [8]. Цитокины, вырабатываемые местными макрофагами, выступают посредниками в развитии воспалительных и иммунных реакций в системе мать-плацента-плод с нарушением морфологических и функциональных свойств клеточных мембран, энергетического обмена, истощением защитного резерва клеток [3].
Однако при наступлении беременности макрофаги, находящиеся в базальной децидуальной оболочке, приобретают специфический фенотип, который участвует в различных аспектах местного гомеостаза, развитии плаценты и в толерантности материнского организма к полуаллогенному трофобласту [12, 15]. Изменения количественного содержания или функционирования децидуальных макрофагов может нарушать функции инвазивного цитотрофобласта и плацентарное развитие, приводя к различным нарушениям беременности, вплоть до ее прерывания [13, 14]. Согласно данным разных исследователей, содержание макрофагов в базальной децидуальной оболочке достаточно велико (около 20 %) и остается таковым на протяжении всей беременности [13, 14]. При наличии инфекции, в условиях сниженной общей иммунореактивности беременной, децидуальные макрофаги участвуют в клеточном иммунном ответе, реализуют иммунные реакции, располагаясь в непосредственной близости к «объекту реакции» [2, 4, 7].
Второй популяцией макрофагов, локализующихся на границе мать-плод, являются макрофаги ворсин хориона или клетки Кащенко-Гофбауэра, имеющие плодное происхождение [8]. Их содержание в 4-20 недель гестации может составлять до 40 % всех нетрофобластных клеток [10]. В ранние сроки беременности клетки Кащенко-Гофбауэра являются единственной значимой популяцией иммунокомпетентных клеток в строме ворсин, способной стимулировать пролиферацию материнских лимфоцитов in vitro и, следовательно, участвовать в неспецифических защитных реакциях в плаценте при проникновении патогена [11].
В связи с этим целью настоящего исследования явилась оценка изменений численной плотности материнских и плодных макрофагов в ранние сроки беременности при инфицировании Chlamydia trachomatis.
Материал и методы. Методом сплошной выборки были обследованы 102 беременные женщины, направленные для искусственного прерывания беременности по немедицинским показаниям в гестационном сроке 6-8 недель. Средний возраст пациенток, включенных в исследование, статистически значимо не различался в исследованных группах и составил в среднем 28±5,3 лет.
До оперативного вмешательства все женщины были клинически обследованы. Оценку вагинально-цервикального биоценоза проводили на основании анализа уретральных, влагалищных и цервикальных мазков с окраской по Граму. Идентификацию урогенитальных хламидий осуществляли методом полимеразной цепной реакции. Критерием диагностики персистентной формы хламидийной инфекции являлось обнаружение антител класса G в сыворотке крови к рекомбинантному белку теплового шока hsp60 Chlamydia trachomatis; активной формы – совместное обнаружение антител класса G в сыворотке крови иммуноферментным методом к рекомбинантным белкам МОМР (главный белок наружной мембраны) и pgp3 (плазмидийный гликопротеин) Chlamydia trachomatis.
По результатам исследования были выделены следующие группы:
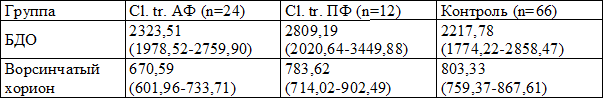
1-я – 24 пациентки с инфицированием Chlamydia trachomatis в активной форме;
2-я – 12 пациенток с инфицированием Chlamydia trachomatis в персистентной форме;
3-я (контрольная) – 66 пациенток без хламидийного инфицирования.
Критериями исключения из исследования являлись: наличие неразвивающейся беременности, анэмбриония, аутоиммунные заболевания, декомпенсированная экстрагенитальная патология и инфекции, передаваемые половым путем (гонорея, трихомониаз, уреа- и микоплазмоз). Женщины, лечившиеся по поводу хламидийной инфекции до наступления настоящей беременности, также исключались из исследования. Критериями включения в настоящее исследование были случаи нормально прогрессирующей беременности у женщин с хламидийной инфекцией.
Материал, полученный при выскабливании полости матки во время артифициального аборта, забирали для гистологического исследования. Объекты фиксировали в 10%-м растворе нейтрального формалина и по общепринятой методике заливали в парафин. После приготовления срезов толщиной 4-6 мкм, проводили иммуногистохимическое окрашивание при помощи моноклональных антител СD68 (Cluster of Differentiation 68) (DakoCytomation, Дания), визуализацию экспрессии осуществляли с использованием набора EnVision (DakoCytomation, Дания). Ядра докрашивали гематоксилином Майера.
Для подсчета численной плотности клеток в 1 мм 2 среза базальной децидуальной оболочки и ворсинчатого хориона использовали окулярную вставку с известной площадью, при ок. 10 и об. 90. Просмотр и фотографирование микропрепаратов осуществляли на микроскопе «Axiostar plus» (Carl Zeiss, Германия). Cтатистическую обработку результатов проводили при помощи лицензионного пакета программ Statistica 6,0 for Windows. Анализ полученных данных осуществляли методами описательной статистики с вычислением медианы Ме и интерквартильного интервала Q1-Q3. Для оценки различий использовали непараметрический критерий Манна-Уитни. Значимость различий между показателями разных групп принимали при р 2
Примечание: статистически значимые отличия от соответствующей группы при р
Список использованных источников:
1. Айламазян Э.К., Полякова В.О., Линькова Н.С. и др. Роль резидентных иммунных клеток в развитии плаценты в норме и при патологии// Журнал акушерства и женских болезней. 2010. № 6. С. 8-14.
2. Гуревич П.С. Иммунопатология зародышевого, эмбрионального и раннего фетального периодов человека. Аллогенные конфликты. — Израиль, 2011. 182 с.
3. Канн Н.Е., Орджоникидзе Н.В. Современные представления о внутриутробной инфекции// Акушерство и гинекология. 2004. № 6. С. 3-5.
4. Михнина Е.А. Морфо-функциональное состояние эндометрия у женщин с бесплодием и невынашиванием беременности: Автореф. дис. … д-ра мед. наук. — СПб., 2009. 40 с.
5. Мустафина Л.Р., Хон Е.В., Логвинов С.В., Юрьев С.Ю. Морфофункциональная характеристика ворсинчатого хориона в ранние сроки беременности при наличии урогенитальной инфекции// Бюллетень сибирской медицины. 2011. № 6. С. 19-23.
6. Мустафина Л.Р., Логвинов С.В., Юрьев С.Ю. Влияние хламидийного инфицирования цервикального канала на показатели локального иммунитета базальной децидуальной оболочки в ранние сроки беременности// Врач-аспирант. 2012. № 5 (54). С. 176-181.
7. Романовская В.В. Прогностическое значение компонентов врожденного иммунитета (TLR2, TLR4 и HBD1) у беременных с высоким риском реализации внутриутробной инфекции: Автореф. дис. … канд. мед. наук. – М., 2008. 17 с.
8. Сельков С. А., Павлов О.В. Плацентарные макрофаги. — М.: Товарищество научных изданий КМК, 2007. 186 с.
9. Сельков С.А., Соколов Д.И. Иммунологические механизмы контроля развития плаценты// Журнал акушерства и женских болезней. 2010. № 1. С. 6-10.
10. Goldstein J., Braverman M., Salafia C. et al. The phenotype of human placental macrophages and its variation with gestational age// Am. J. Pathol. 1988 N 3. Р. 648-659.
11. Hunt J.S., King C.R. Jr., Wood G.W. Evaluation of human chorionic trophoblast cells and placental macrophages as stimulators of maternal lymphocyte proliferation in vitro// J. Reprod. Immunol. 1984 N 6. Р. 377-391.
12. Hunt J.S., Petroff M.G. IFPA Senior Award Lecture: Reproductive immunology in perspective — Reprogramming at the maternal-fetal interface// Placenta. 2013. N 3. Р. 52-55.
13. Lash G.E., Otun H.A., Innes B.A. et al. Regulation of extravillous trophoblast invasion by uterine natural killer cells is dependent on gestational age// Hum. Reprod. 2010. N5. P. 1137-1145.
14. Nagamatsu T., Schust D.J. The immunomodulatory roles of macrophages at the maternal-fetal interface// Reprod. Sci. 2010. N3. Р. 209-218.
15. Renaud S.J., Graham C.H. The role of macrophages in utero-placental interactions during normal and pathological pregnancy// Immunol. Invest. 2008. N 5. Р. 535-564.
16. Takeda K., Akira S. Toll-like receptors in innate immunity// Int. Immunol. 2005. N 1. P. 1-14.
Источник
Интерпретация клеточного состава, особенности изменений в клетках при различных патологических процессах
Основу цитологической диагностики составляет изучение клеток, изменений в их расположении и строении. Критерии цитологической диагностики включают анализ клеточного и неклеточного состава: количество клеток, наличие клеток разного типа, их расположение в структурах или разрозненно, вид структур, размер, форма, строение клеток и ядер, наличие или отсутствие клеточного и ядерного полиморфизма и другие параметры. По характеру и степени выраженности отклонения от нормального клеточного состава судят о природе патологического процесса. По признакам, характерным для определенных тканей, судят о тканевой принадлежности опухоли. При этом учитывают фон препарата — элементы крови, бесструктурное вещество, коллоид, жир и др.
Количество клеток в мазке определено прочностью межклеточных связей и обилием стромы. Богатый клеточный состав бывает в низкодифференцированных опухолях, гемато- и лимфосаркоме, нейроэндокринных опухолях. Скудный материал и даже единичные клетки встречают, в частности, при скиррозном и дольковом раке молочной железы.
Расположение клеток. Клетки в мазке могут располагаться разрозненно или в виде структур. Для доброкачественных поражений характерно правильное, упорядоченное расположение клеток, одинаковое расстояние между ними, сходные размеры клеток и ядер, образующих структуру. Для злокачественных новообразований характерны структуры (комплексы, пучки) с неупорядоченным расположением клеток.
Размеры клеток и ядер. Размеры клеток по возможности оценивают в сравнении с размерами нормальных клеток того же типа. Размеры ядер обычно сравнивают с размером эритроцита (в норме достаточно стабильным, примерно 7 мкм). Соотношение размера ядра и цитоплазмы (ядерно-цитоплазматическое соотношение) также весьма различно в разных клетках, и при его оценке учитывают степень отклонения этого параметра от нормальной клетки того же типа.
Фон препарата часто имеет большое диагностическое значение. Фоном могут быть элементы периферической крови или воспаления, связанного с инфекцией, сопровождающего опухолевый и другие процессы, клеточный детрит, межуточное вещество. Фон препарата может иметь диагностическое значение при определении тканевой принадлежности или гистологической формы опухоли.
При реактивных и фоновых поражениях чаще всего увеличено число клеток (гиперплазия, пролиферация), размер ядер и отмечается их более интенсивная окраска (гиперхромия). Хроматин распределен сравнительно равномерно. В некоторых ядрах (особенно характерно для железистого эпителия) увеличен размер ядрышек. При некоторых состояниях изменен размер клеток и наблюдаются особенности окрашивания цитоплазмы.
При пограничном процессе (поражении, близком к злокачественной опухоли) размер ядер увеличен значительно, ядро деформировано, контуры его неровные, ядерная мембрана неравномерно утолщена, встречаются многоядерные клетки. Хроматин распределен неравномерно, чередуются мелкие и крупные участки уплотнения. Образуются множественные мелкие ядрышки, возможно увеличение их размеров. Однако в отличие от злокачественной опухоли в разных клетках изменения оценивают как мономорфные (однотипные).
Изменения в клеточном составе мазка при злокачественной опухоли характеризуются клеточным и ядерным полиморфизмом (различием характеристик разных клеток), образованием структур, отличающихся от нормальных, изменением фона препарата; для многих злокачественных опухолей характерен так называемый опухолевый диатез — реакция соединительной ткани на инвазию (прорастание опухоли).
Если количество материала достаточное, клетки сохранены, хорошо приготовлен и окрашен препарат, то можно без характеристики микроскопической картины формулировать цитологический диагноз с указанием на гистологическую форму опухоли и степень дифференцировки (низкодифференцированная аденокарцинома, плоскоклеточный рак с ороговением, фиброаденома).
Источник
Расшифровка результатов цитологии при предраковых патологиях
Оксана Жосан, гинеколог-онколог. Редактор А. Герасимова
- Запись опубликована: 04.01.2020
- Время чтения: 1 mins read
Предраковыми патологиями шейки матки считаются заболевания, приводящие к развитию злокачественных опухолей. Существует несколько таких болезней, каждую из которых отличают особенности цитологических мазков
Осмотрев под микроскопом окрашенный материал, взятый с поверхности шейки и проходящего в ней цервикального канала, врач по внешнему виду и расположению клеток может определить, какое заболевание имеется у женщины. Все данные вносятся в бланк. Расшифровку анализа проводит врач онколог-гинеколог.
Чем предраковые клетки, обнаруженные при цитологии шейки матки, отличаются от здоровых и злокачественных
Эти клетки отличаются от здоровых размерами, строением, наличием различных включений. Они не имеют столь разительных отличий, как злокачественные, но и здоровыми их назвать нельзя. То есть предрак – это переходное состояние между нормой и онкологией.
Существуют также клетки с атипией неясного значения, обозначаемые в результатах анализа ASC-US, ASC-H, AGC. AGUS-NOS. Хотя они имеют патологические изменения – увеличенные ядра и другие аномалии строения, это отклонения не столь явные, чтобы отнести их к предраку или раку. Например, такие клеточные элементы могут появляться при воспалении, а потом исчезать после проведенного лечения.
Со временем, при отсутствии лечения, предраковое состояние утяжеляется. По мере проникновения патологического очага внутрь тканей, клетки все больше напоминают раковые. В результате предрак переходит в злокачественную опухоль шейки матки.
Перерождение здоровых клеток в предраковые, а затем – в злокачественные, происходит постепенно, поэтому обнаружить границу между этими состояниями может только опытный врач-цитолог.
Осмотр материала под микроскопом
Как выглядят предраковые клетки при проведении цитологии шейки матки. Расшифровка и интерпретация терминов, встречающихся в результатах исследования
Клетки, обнаруженные в мазках при предраке, отличаются от здоровых. У них наблюдаются:
- Атипия – несоответствие размера, формы и других показателей норме. Клетки могут быть слишком большими или маленькими, с неправильным строением или несвойственными включениями. При окраске образца, их жидкая часть – цитоплазма часто имеет неравномерную окраску.
- Дискариоз – аномалии ядра – центральной части клетки, служащей для хранения генетической информации. При дискариозе ядра могут быть увеличенными, уменьшенными, иметь неправильную форму и контуры, утолщенную наружную оболочку – мембрану.
- Проявления койлоцитоза – в мазке обнаруживаются клетки-койлоциты, присутствие которых указывает на инфицирование папилломавирусом. Они крупные с увеличенными деформированными ядрами и неправильным строением. Из-за большого размера ядер жидкая часть клетки – цитоплазма сохраняется только по краю, образуя тонкий ободок-– гало.
- Кератоз – ороговение клеток. Шейка матки не имеет рогового слоя, оставаясь мягкой, поэтому такие клетки в норме в мазке не обнаруживаются. Степень ороговения может быть разной: слабой – паракератоз, более выраженной – гиперкератоз и значительной – акантоз. Ороговевшие клетки содержат сморщенные, деформированные, неправильно развитые ядра и измененную жидкую клеточную часть – цитоплазму. При выраженном ороговении в них обнаруживается прочный белок кератин, поэтому при кератозе в мазках обнаруживают блестящие плотные роговые клетки.
- Атипичный митоз (неправильное деление). Единичные делящиеся клеточные элементы в образце – норма, особенно если деление происходит правильно. Нарушение этого процесса характерно для предрака и рака.
Результаты цитологии при различных предраковых состояниях
| Предраковая патология | Характеристика | Цитологическая картина |
| Дисплазия | Патологическое состояние шейки матки, вызванное инфицированием папилломавирусом. Возбудитель попадает в эпителии шейки, влияет на процесс формирования и развития клеток, приводя к появлению неправильно развитых клеточных структур | Слабая степень (CINI). На этой стадии болезни поражается только верхний слой эпителия (1/3), поэтому в мазке обнаруживаются неправильно развитые клетки, принадлежащие к наружному слою шейки |
В мазках обнаруживаются клетки с признаками койлоцитоза, появившиеся из-за инфицирования папиломавирусом.
Обнаруживаются клетки с дискариозом, у которых ядра увеличены, имеют неправильные контуры и окраску. Видны другие клетки, отличающиеся строением и окраской, но количество неправильно развитых клеточных элементов невелико
Отличительная черта таких клеток – большой размер и нарушение пропорций между размерами ядра и жидкой части – цитоплазмы. Количество атипичных клеток значительно выше, чем при легкой степени
Наблюдаются неправильно делящиеся клетки (атипичный митоз)
В образцах много лейкоцитов за счёт постоянного вялотекущего воспалительного процесса, а ранимость шейки приводит к появлению примесей крови
По мере утяжеления предрака клетки все больше напоминают злокачественные. Они сбиваются в комплексы, напоминающие сгустки, пчелиные соты, розетки, наслаиваются друг на друга, образуя пласты.
Соотношение классификаций по стадиям развития предраковых состояний шейки матки
В документе, выдаваемом по результатам цитологии, врач-цитолог перечисляет клеточные структуры, обнаруженные в мазке. Это позволит гинекологу-онкологу после расшифровки результатов анализа поставить правильный диагноз.
При обнаружении в анализах на цитологию клеток, характерных для дисплазии, указывается степень предрака:
- Лёгкая (LSIL) – результат, соответствующий первой стадии болезни (CINI)
- Тяжёлая (HSIL) – вторая-третья стадия болезни (CINII-CINIII)
Самостоятельно расшифровать такое заключение крайне сложно – документ содержит термины, для понимания которых нужны знания в области цитологии, гинекологии и анатомии. Поэтому для расшифровки и интерпретации анализов нужно обращаться к гинекологу-онкологу. Специалист объяснит результаты анализа на цитологию, а, при необходимости, назначит дополнительное обследование и лечение.
Источник