- Что значит тетраэдрическое строение
- Тетраэдрические комплексы
- Тетраэдрический 18-электронный комплекс
- Соединения состава $ML_4$
- Готовые работы на аналогичную тему
- Синтез тетраэдрических координационных соединений
- Тетраэдрическая молекулярная геометрия — Tetrahedral molecular geometry
- СОДЕРЖАНИЕ
- Тетраэдрический валентный угол
- Примеры
- Химия основной группы
- Химия переходных металлов
- Структура воды
- Битетраэдрические конструкции
- Исключения и искажения
- Перевернутая тетраэдрическая геометрия
- Планаризация
- Тетраэдрические молекулы без центрального атома
Что значит тетраэдрическое строение
Предмет органической химии
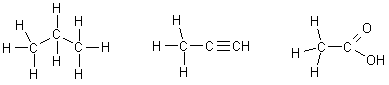
Способы изображения органических молекул, пространственные модели
В настоящее время считается общепринятым, что одна прямая линия, соединяющая два атома, обозначает одну двухэлектронную связь (простая связь), на образование которой затрачивается по одной валентности от каждого из связанных атомов, две линии – одну четырехэлектронную связь (двойная связь), три линии – одну шестиэлектронную связь (тройная связь).
Изображение соединения с известным порядком связей между всеми атомами с помощью связей такого типа называется структурной формулой:
Для экономии времени и места чаще применяют сокращенные формулы, в которых часть связей подразумевается, но не пишется:
Иногда, особенно в карбоциклических и гетероциклических рядах, формулы еще больше упрощаются: не пишутся не только некоторые связи, но и часть атомов углерода и водорода не изображается, а лишь подразумевается (в местах пересечения линий); упрощенные формулы:
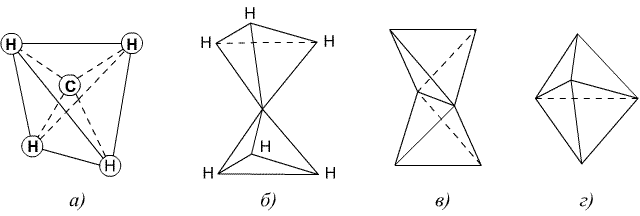
Тетраэдрическая модель атома углерода
Основные представления о химическом строении, заложенные А.М. Бутлеровым, были дополнены Я. Г. Вант-Гоффом и Ж. А. Ле-Белем (1874), которые развили идею о пространственном расположении атомов в молекуле органического вещества и поставили вопрос о пространственной конфигурации и конформации молекул. Работа Вант-Гоффа «Химия в пространстве» (1874) положила начало плодотворному направлению органической химии – стереохимии, т. е. учению о пространственном строении.
Вант-Гофф предложил тетраэдрическую модель атома углерода. Согласно этой теории, четыре валентности атома углерода в метане направлены к четырем углам тетраэдра, в центре которого находится углеродный атом, а в вершинах – атомы водорода (а). Этан, согласно Вант-Гоффу, можно представить себе как два тетраэдра, соединенных вершинами и свободно вращающихся около общей оси (6). Модель молекулы этилена представляет собой два тетраэдра, соединенных ребрами (в), а молекулы с тройной связью изображаются моделью, в которой тетраэдры соприкасаются плоскостями (г).
Модели по Вант-Гоффу: метана (а), этана (б), этилена (в) и ацетилена (г)
Такого типа модели оказались весьма удачными и для сложных молекул. Они с успехом используются и сегодня для объяснения ряда стереохимических вопросов. Теория, предложенная Вант-Гоффом, хотя и пригодная почти во всех случаях, не давала, однако, обоснованного объяснения типа и существа связывающих сил в молекулах.
Источник
Тетраэдрические комплексы
Вы будете перенаправлены на Автор24
Тэтраэдр является типичной формой некоторых комплексных соединений формулы $ML_4$ Кроме того форму тетраэдра имеют комплексы состава $M_4L_6$
Однако комплексы состава $[ML_4]$ могут иметь как тетраэдрическое, так и плоскоквадратное строение. Например, комплексы платины($II$) и палладия($II$), а также большое количество комплексов никеля имеют плоскоквадратное строение, комплексы кобальта($II$) — тетраэдрическое. Энергия прямого межлигандного взаимодействия в тетраэдре меньше чем в плоском квадрате. Значит, форма комплексов кобальта обусловлена отталкиванием лигандов, а в комплексе платины, палладия и никеля этот фактор не является определяющим.
Тетраэдрический 18-электронный комплекс
Четырехкоординационные комплексы нульвалентных металлов конфигурационно имеют 18-электронную валентную оболочку металла, и, как было сказано выше, плоская квадратная конфигурация этих комплексов не будет стабильной вследствие высокой энергии девятой орбитали $\chi_9$. Тем не менее, такие комплексы существуют (например, $Pd[PPh_3]4$). Стабилизация достигается путем искажения плоского квадрата в тетраэдр, которое может произойти в результате скручивания одной пары цис-лигандов вокруг оси $X$ или в результате уменьшения углов между транс-лигандами:
Рисунок 1. Тетраэдрический 18-электронный комплекс. Автор24 — интернет-биржа студенческих работ
Устойчивость тетраэдрического 18-электронного комплекса зависит от тонкого баланса между понижением орбиталей $\chi_8$ и $\chi_9$ и повышением энергии орбиталей $d_
Соединения состава $ML_4$
Соединения состава $[ML_4]$ могут иметь форму тетраэдра, квадрата или промежуточные формы с диагональной или тригональной деформацией. Диаграмма молекулярных уровней тетраэдрического комплекса $[ML_4]$, где $M$ — непереходный металл, приведена на рис. 1
Готовые работы на аналогичную тему
Рисунок 2. Диаграмма молекулярных уровней тетраэдрического комплекса $ML_4$. Автор24 — интернет-биржа студенческих работ
Рассмотрим сначала ряд изоэлектронных соединений состава $[ML_4]$, в которых $M$ — непереходный элемент, a $L$ — ^-лиганды, например, галогениды (Г) или кислород. Такие соединения металлов разных групп Периодической системы $[МГ_4]^<2->$, $[МГ_4]^-$, $[МГ_4]$, $[МО_4]^<3->$, $[МО_4]^<2->$ и $[МО_4]^-$ имеют полностью заполненную (замкнутую) электронную оболочку $(a_1)^2(t_2)^6(e)^4(t_1)^6(t_2)^<6_•>$ содержащую 24 электрона, с основным невырожденным термом А, (см. рис. 1).
Энергия возбуждения с верхнего занятого на нижний свободный молекулярный уровень довольно большая, поэтому основное и возбужденное состояния не смешиваются за счет энергии нормальных колебаний. Это, в свою очередь, означает, что тетраэдрическая форма должна быть устойчивой. Напротив, в плоскоквадратной форме расстояние между ВЗМО и НСМО достаточно мало. Это создает условия для реализации псевдоэффекта Яна—Теллера, вследствие чего плоскоквадратная пространственная форма этих соединений становится неустойчивой и деформируется. В рассмотренных соединениях стабилизация тетраэдрической формы достигается за счет межлигандного взаимодействия, а вибронное взаимодействие, дестабилизирующее плоскоквадратную форму, также способствует образованию тетраэдрической формы.
К аналогичным выводам приходим, рассматривая комплексы $
Последовательность уровней в плоско квадратных комплексах переходных металлов передается такой конфигурацией:
Рисунок 3. Последовательность уровней. Автор24 — интернет-биржа студенческих работ
где фигурными скобками отделены молекулярные орбитали, заселенность которых зависит от количества J-электронов в центральном атоме и силы поля лигандов. Если основной стан невырожденный, нестабильность плоскоквадратной формы может возникнуть вследствие возбуждений. Если орбитали заполнены, то нет электронных возбужденных состояний, способных взаимодействовать с колебаниями, приводящиvb к искажению плоско-квадратной конфигурации в направлении тетраэдра. Поэтому в низкоспиновых соединениях $d^8$-металлов $Ni(II)$, $Pd(II)$ и $Pt(II)$, плоскоквадратная конфигурация стабильна. В высокоспиновых координационных соединениях (например, $Co(II)$ чаще всего образует высокоспиновые комплексы. Энергетическая близость уровней $2b_
Таким образом, в низкоспиновых комплексах $d^8$-металлов типа $[MX_4]$ вибронные взаимодействия превышают энергию межлигандного взаимодействия в конкуренции за пространственную форму: плоский квадрат или тетраэдр.
Синтез тетраэдрических координационных соединений
Для синтеза координационных соединений с тетраэдрическим расположением атомов металла в соответствии с «молекулярной библиотекой» необходимо ввести в реакцию четыре угловых тритопных и шесть линейных дитопных лигандов.
Исходя из симметрии синтезируемого соединения, можно применить другой путь синтеза тетраэдрического тетрамера. Для этого нужно синтезировать соединение состава $M_4L_6$, в котором дитопные лиганды имеют угол близкий к 70,6$^\circ$, а четыре металла образуют октаэдрические комплексы. Именно такой подход был реализован в лаборатории профессора Р. Саалфранка. Схемs темплатного синтеза тетрамерных координационных соединений с тетраэдрическим расположением атомов металла показаны ниже:
Синтез тетрамерных координационных соединений с тетраэдрическим расположением атомов металла без включения аниона $BF_4$ в тетраэдрическую полость
Рисунок 4. Синтез тетрамерных координационных соединений с тетраэдрическим расположением атомов металла без включения аниона. Автор24 — интернет-биржа студенческих работ
Синтез тетрамерных координационных соединений с тетраэдрическим расположением атомов металла с включением аниона $BF_4$ в тетраэдрическую полость
Рисунок 5. Синтез тетрамерных координационных соединений с тетраэдрическим расположением атомов металла с включением аниона. Автор24 — интернет-биржа студенческих работ
Реакция самосборки проходит одновременно с синтезом лигандов, ионы металлов при этом являются темплатами.
Это соединение синтезировано и исследовано в лаборатории американского профессора Мак-Клеверти. Исследование кристаллического строения этого соединения показало, что один из восьми анионов расположен в середине тетраэдрической полости, и атомы фтора этого аниона направлены к серединам граней тетраэдра.
Источник
Тетраэдрическая молекулярная геометрия — Tetrahedral molecular geometry
| Тетраэдрическая молекулярная геометрия | |
|---|---|
 | |
| Примеры | CH 4 , MnO — 4 |
| Группа точек | Т д |
| Координационный номер | 4 |
| Угол крепления | ≈ 109,5 ° |
| μ (полярность) | 0 |
В тетраэдрической геометрии молекулы центральный атом расположен в центре с четырьмя заместителями , которые расположены в углах тетраэдра . В валентных углами являются совами -1 (- 1 / 3 ) = +109,4712206 . ° ≈ 109,5 ° , когда все четыре заместителей являются такими же, как и в метане ( CH
4 ), а также его более тяжелые аналоги . Метан и другие идеально симметричные тетраэдрические молекулы принадлежат точечной группе T d , но большинство тетраэдрических молекул имеют более низкую симметрию . Тетраэдрические молекулы могут быть хиральными .
СОДЕРЖАНИЕ
Тетраэдрический валентный угол
Валентный угол для симметричной тетраэдрической молекулы, такой как CH 4, может быть вычислен с использованием скалярного произведения двух векторов . Как показано на диаграмме, молекула может быть вписана в куб с четырехвалентным атомом (например, углеродом ) в центре куба, который является источником координат, О. Четыре одновалентных атома (например, атомы водорода) находятся в четырех углах куба. (A, B, C, D) выбраны так, чтобы никакие два атома в соседних углах не были связаны только одним ребром куба. Если длина ребра куба выбрана равной 2 единицам, то две связи OA и OB соответствуют векторам a = (1, –1, 1) и b = (1, 1, –1), а валентный угол θ — угол между этими двумя векторами. Этот угол может быть вычислен из скалярного произведения двух векторов, определяемых как a • b = || а || || б || cos θ где || а || обозначает длину вектора a . Как показано на диаграмме, скалярное произведение здесь равно –1, а длина каждого вектора равна √3, так что cos θ = –1/3 и тетраэдрический валентный угол θ = arccos (–1/3) ≃ 109,47 °.
Примеры
Химия основной группы
Помимо практически всех насыщенных органических соединений, большинство соединений Si, Ge и Sn являются тетраэдрическими. Часто тетраэдрические молекулы имеют множественные связи с внешними лигандами, как, например, в тетроксиде ксенона (XeO 4 ) перхлорат- ион ( ClO —
4 ), сульфат- ион ( SO 2-
4 ), фосфат- ион ( PO 3-
4 ). Тиазилтрифторид ( ОЯТ
3 ) является тетраэдрическим с тройной связью сера-азот.
Другие молекулы имеют тетраэдрическое расположение электронных пар вокруг центрального атома; например аммиак ( NH
3 ) с атомом азота, окруженным тремя атомами водорода и одной неподеленной парой . Однако обычная классификация рассматривает только связанные атомы, а не неподеленную пару, так что аммиак фактически считается пирамидальным . Углы H – N – H составляют 107 °, уменьшенные с 109,5 °. Это различие объясняется влиянием неподеленной пары, которая оказывает большее отталкивающее влияние, чем связанный атом.
Химия переходных металлов
Опять же, эта геометрия широко распространена, особенно для комплексов, в которых металл имеет конфигурацию d 0 или d 10 . Иллюстративные примеры включают тетракис (трифенилфосфин) палладий (0) ( Pd [P (C
6 ЧАС
5 )
3 ]
4 ), карбонил никеля ( Ni (CO)
4 ) и тетрахлорид титана ( TiCl
4 ). Многие комплексы с неполностью заполненными d-оболочками часто являются тетраэдрическими, например тетрагалогениды железа (II), кобальта (II) и никеля (II).
Структура воды
В газовой фазе одна молекула воды имеет атом кислорода, окруженный двумя атомами водорода и двумя неподеленными парами, а атом H
2 Геометрия O просто описывается как изогнутая, без учета несвязанных неподеленных пар.
Однако в жидкой воде или во льду неподеленные пары образуют водородные связи с соседними молекулами воды. Наиболее распространенное расположение атомов водорода вокруг кислорода — тетраэдрическое, с двумя атомами водорода, ковалентно связанными с кислородом, и двумя, присоединенными водородными связями. Поскольку водородные связи различаются по длине, многие из этих молекул воды не симметричны и образуют временные нерегулярные тетраэдры между своими четырьмя связанными атомами водорода.
Битетраэдрические конструкции
Многие соединения и комплексы имеют битетраэдрическую структуру. В этом мотиве два тетраэдра имеют общее ребро. Неорганический полимерный дисульфид кремния имеет бесконечную цепочку тетраэдров с общими ребрами.
Исключения и искажения
Инверсия тетраэдра широко встречается в органической химии и химии основных групп. Так называемая инверсия Вальдена иллюстрирует стереохимические последствия инверсии углерода. Инверсия азота в аммиаке также влечет за собой кратковременное образование плоских NH
3 .
Перевернутая тетраэдрическая геометрия
Геометрические ограничения в молекуле могут вызвать серьезное искажение идеализированной тетраэдрической геометрии. В соединениях с «перевернутой» тетраэдрической геометрией у атома углерода все четыре группы, присоединенные к этому углероду, находятся на одной стороне плоскости. Атом углерода находится на вершине квадратной пирамиды или рядом с ней, а остальные четыре группы находятся в углах.

Простейшими примерами органических молекул, демонстрирующих геометрию перевернутого тетраэдра, являются самые маленькие пропелланы , такие как [1.1.1] пропеллан ; или, в более общем смысле , паддланы и пирамидан ([3.3.3.3] фенестран). Такие молекулы обычно напряжены , что приводит к повышенной реакционной способности.
Планаризация
Тетраэдр также можно исказить, увеличив угол между двумя связями. В крайнем случае получается сплющивание. Для углерода это явление можно наблюдать в классе соединений, называемых фенестранами .
Тетраэдрические молекулы без центрального атома
Некоторые молекулы имеют тетраэдрическую геометрию без центрального атома. Неорганический пример — тетрафосфор ( P
4 ), который имеет четыре атома фосфора в вершинах тетраэдра, каждый из которых связан с тремя другими. Органический пример — тетраэдран ( C
4 ЧАС
4 ) с четырьмя атомами углерода, каждый из которых связан с одним водородом и тремя другими атомами углерода. В этом случае теоретический валентный угол C-C-C составляет всего 60 ° (на практике угол будет больше из-за изогнутых связей ), что представляет собой большую степень деформации.
Источник