Соляная кислота ГОСТ 3118-77
| Соляная кислота | |
|---|---|
  |
наименование
Соляная кислота (также хлороводородная, хлористоводородная кислота, хлористый водород) — раствор хлороводорода (HCl) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около ω = 0,5 % присутствует в желудке человека, что соответствует pH = pω − lg ( ρH2O / μHCl ) ≅ 0,86 . Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см³. Соли соляной кислоты называются хлоридами.
Содержание
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), кг HCl/кг | Конц. (г/л), кг HCl/м³ | Плотность, кг/л | Молярность M | Водородный показатель (pH) | Вязкость, мПа·с | Удельная теплоемкость, кДж/(кг·К) | Давление пара, Па | Температура кипения, °C | Температура плавления, °C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
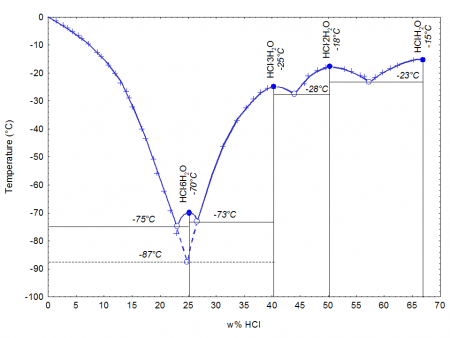
При 20 °C, 1 атм (101 кПа)При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
2Na + 2HCl ⟶ 2NaCl + H2 ↑ Mg + 2HCl ⟶ MgCl2 + H2 ↑ 2Al + 6HCl ⟶ 2AlCl3 + 3H2 ↑
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
Na2O + 2HCl ⟶ 2NaCl + H2O MgO + 2HCl ⟶ MgCl2 + H2O Al2O3 + 6HCl ⟶ 2AlCl3 + 3H2O
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
NaOH + HCl ⟶ NaCl + H2O Ba(OH)2 + 2HCl ⟶ BaCl2 + 2H2O Al(OH)3 + 3HCl ⟶ AlCl3 + 3H2O
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:
Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2 ↑
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
2KMnO4 + 16HCl ⟶ 5Cl2 ↑ + 2MnCl2 + 2KCl + 8H2O
- Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония:
NH3 + HCl ⟶ NH4Cl
- Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте:
HCl + AgNO3 → AgCl ↓ + HNO3
Получение
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение
Промышленность
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения
Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен.
Источник
Что такое кислота соляная ингибированная?
Существуют сотни всевозможных химических соединений, которые широко применяются в промышленности десятки лет, однако, особое место среди них занимает кислота соляная ингибированная. Наверняка каждый хотя бы раз слышал об этом сочетании, однако, далеко не все представляют, где и для чего применяется кислота соляная ингибированная. Вещество крайне полезное, что является производным качеством от химических свойств такой кислоты. Впрочем, не стоит забегать вперед, рассмотрим данный вопрос с самого начала, отмечая основные аспекты, которые могут быть полезными.
Кислота соляная ингибированная представляет собой жидкость негорючего типа, способную растворять внушительное число металлов и оксидов. Кислота соляная ингибированная может смешиваться с водой, бензолом и эфиром, что позволяет добиться проявления новых качеств и свойств. По собственной сути такое вещество представляет собой сочетание двух компонентов – соляной кислоты и ингибитора кислотной коррозии, что и позволяет HCl демонстрировать свои непревзойденные качества. Речь идет о способности оказывать расщепляющее и антибактериальное воздействие. кислота соляная ингибированная. Исходя из этого, кислота соляная ингибированная нашла свое применение в трех основных направлениях. Рассмотрим каждое из них:
- Очистка котлов и аппаратов. Кислота соляная ингибированная с легкостью справляется с неорганическими отложениями, поэтому вещество активно используется в промышленности в качестве очистительного средства.
- Травление металлов. Мы уже отмечали, что кислота соляная ингибированная способна растворять металлы – именно это свойство используется в металлургии, причем, чаще всего речь идет о черных металлах. Тот же состав приходит на помощь тем, кто занимается художественной обработкой – создает химическую гравировку каких-либо изделий, например, предметов роскоши, табличек и т.д.
- Нефтяная промышленность. Пожалуй, здесь кислота соляная ингибированная используется активнее всего. Главное качество такой кислоты – способность растворять карбонатные отложения. Именно по этой причине нефтяники обрабатывают скважины HCl, чтобы повысить качество добываемого черного золота. Кроме того, кислота соляная ингибированная позволяет осуществить бактериологическую обработку и значительно увеличить срок службы нефтяного оборудования, что тоже очень важно. Гораздо выгоднее применять кислоту во время подготовки месторождения, чем впоследствии очищать нефть от примесей, реализуя дорогостоящие операции. И здесь кислота соляная ингибированная способна продемонстрировать себя во всей красе.
Теперь вы имеете представление о том, что такое кислота соляная ингибированная. Несмотря на малую известность среди населения, вещество является незаменимым. Мы постоянно отмечаем выгоду HCl, пусть и не осознавая этого. Ведь заправка автомобилей топливом, использование результатов работы нефтехимической промышленности и введение в обиход металлических изделий с гравировкой – это заслуга вещества под названием кислота соляная ингибированная, о чем нельзя забывать.
Знаете ли Вы, что
Компания MAX PETROLEUM SERVICES тоже производит
кислоту соляную ингибированную?
Источник