- Оксид серы (VI)
- Содержание
- Получение
- Оксид серы (VI) SO3, серный ангидрид
- Химические свойства серного ангидрида
- Получение и применение серного ангидрида
- Трехокись серы (SO3): структура, свойства, риски, применение
- Содержание:
- Состав
- Номенклатура
- Физические свойства
- Физическое состояние
- Молекулярный вес
- Температура плавления
- Тройная точка
- Точка кипения
- Плотность
- Давление газа
- Стабильность
- Химические свойства
- Получение
- Приложения
- При приготовлении олеума
- В химических реакциях сульфирования
- При добыче металлов
- В различных применениях
- Риски
- На здоровье
- От пожара или взрыва
- Воздействие на окружающую среду
- Ссылки
Оксид серы (VI)
Оксид серы (VI)
| Оксид серы(VI) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид серы(VI) |
| Химическая формула | SO3 |
| Отн. молек. масса | 80.06 а. е. м. |
| Молярная масса | 80.06 г/моль |
| Физические свойства | |
| Плотность вещества | 1.92 г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | 16,9 °C |
| Температура кипения | 45 °C |
| Энтальпия (ст. усл.) | −397.77 кДж/моль |
| Классификация | |
| номер CAS | [7446-11-9] |
Окси́д се́ры(VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
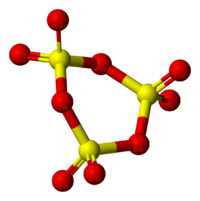
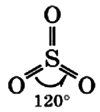
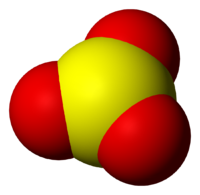
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °С и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул тримера. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO3. Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3. Взаимный переход в другие модификации протекает очень медленно. Разнообразие форм триоксида серы связано со способностью молекул SO3 полимеризоваться благодаря образованию донорно-акцепторных связей. Полимерные структуры SO3 легко переходят друг в друга, и твердый SO3 обычно состоит из смеси различных форм, относительное содержание которых зависит от условий получения серного ангидрида.
Содержание
Получение
Можно получить термическим разложением сульфатов:
Источник
Оксид серы (VI) SO3, серный ангидрид
Взаимодействуя с кислородом, сера образует два оксида:
- SO2 (IV) — сернистый газ (сернистый ангидрид, диоксид серы)
- SO3 (VI) — серный ангидрид
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
В таком виде молекула серного ангидрида может находиться только в газообразном состоянии.
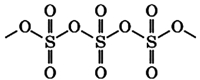
В жидком и твердом состоянии происходит полимеризация молекул:
Физические свойства серного ангидрида:
- бесцветная жидкость;
- при температуре менее 16,8°C серный ангидрид превращается в белую кристаллическую массу;
- обладает высокой гигроскопичностью.
Химические свойства серного ангидрида
Оксид серы (VI) является типичным кислотным оксидом:
- с основаниями реагирует с образованием гидросульфатов (кислых солей) и сульфатов (средних солей):
- с основными оксидами реагирует с образованием сульфатов:
- с водой реагирует бурно, при этом образуется серная кислота:
Серный ангидрид очень хорошо растворяется в серной кислоте, образуя раствор, называемый олеумом:
В кислотно-восстановительных реакциях выступает в роли сильного окислителя, восстанавливаясь до сернистого ангидрида:
Получение и применение серного ангидрида
В промышленных целях серный ангидрид получают путем окисления сернистого газа в присутствии катализатора:
Серный ангидрид используют для получения серной кислоты, а также, в качестве сульфирующего и обезвоживающего реагента.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник
Трехокись серы (SO3): структура, свойства, риски, применение
Содержание:
В триоксид серы Это неорганическое соединение, образованное объединением атома серы (S) и 3 атомов кислорода (O). Его молекулярная формула SO3. При комнатной температуре SO3 это жидкость, которая выделяет газы в воздух.
Структура ОС3 газообразный — плоский и симметричный. Все три атома кислорода равномерно расположены вокруг серы. SO3 Реагирует бурно с водой. Реакция экзотермическая, что означает выделение тепла, другими словами, она становится очень горячей.
Когда SO3 жидкость остывает, превращается в твердое тело, которое может иметь три типа структуры: альфа, бета и гамма. Наиболее стабильным является альфа-канал, состоящий из слоев, объединенных в сеть.
Газообразный триоксид серы используется для приготовления дымящей серной кислоты, также называемой олеумом, из-за ее сходства с маслом или маслянистыми веществами. Еще одно его важное применение — сульфирование органических соединений, то есть добавление групп -SO.3— этим. Таким образом, могут быть получены полезные химические вещества, такие как моющие средства, красители, пестициды и многие другие.
SO3 Это очень опасно, может вызвать сильные ожоги, повреждение глаз и кожи. Его также нельзя вдыхать или проглатывать, так как это может вызвать смерть от внутренних ожогов во рту, пищеводе, желудке и т. Д.
По этим причинам с ним нужно обращаться с большой осторожностью. Он не должен контактировать с водой или горючими материалами, такими как дерево, бумага, ткани и т. Д., Поскольку это может привести к пожару. Его нельзя утилизировать или попадать в канализацию из-за опасности взрыва.
SO3 Газообразные вещества, образующиеся в промышленных процессах, не должны выбрасываться в окружающую среду, так как они являются одним из виновников кислотных дождей, которые уже повредили большие площади лесов в мире.
Состав
Молекула триоксида серы SO3 в газообразном состоянии имеет плоскую треугольную структуру.
Это означает, что и сера, и три атома кислорода находятся в одной плоскости. Кроме того, распределение кислорода и всех электронов симметрично.
В твердом состоянии известны три типа структуры SO.3: альфа (α-SO3), бета (β-SO3) и гамма (γ-SO3).
Гамма γ-SO форма3 содержит циклические тримеры, т. е. три звена SO3 вместе образуя циклическую или кольцевую молекулу.
Бета-фаза β-SO3 имеет бесконечные винтовые цепочки тетраэдров состава SO4 связаны вместе.
Самая стабильная форма — альфа α-SO3, похожий на бета-версию, но с многоуровневой структурой, в которой цепи соединены в сеть.
Номенклатура
Физические свойства
Физическое состояние
При комнатной температуре (около 25 ºC) и атмосферном давлении SO3 это бесцветная жидкость, выделяющая пары в воздух.
Когда SO3 жидкость чистая при 25 ºC это смесь SO3 мономерный (одна молекула) и тримерный (3 соединенные молекулы) формулы S3ИЛИ9, также называемый SO3 гамма γ-SO3.
При понижении температуры, если SO3 он чистый, когда температура достигает 16,86 ºC, он затвердевает или замерзает до γ-SO3, также называемый «SO ice3”.
Если он содержит небольшое количество влаги (даже следы или очень маленькие количества), SO3 полимеризуется в форму бета-β-SO3 который образует кристаллы с шелковистым блеском.
Затем образуется больше связей, создавая структуру альфа-α-SO.3, который представляет собой игольчатое кристаллическое твердое вещество, напоминающее асбест или асбест.
Когда альфа и бета сливаются, они создают гамму.
Молекулярный вес
Температура плавления
ЮЗ3 гамма = 16,86 ºC
Тройная точка
Это температура, при которой присутствуют три физических состояния: твердое, жидкое и газообразное. В альфа-форме тройная точка находится при 62,2 ºC, а в бета-форме — при 32,5 ºC.
Нагревание альфа-формы имеет большую тенденцию к сублимации, чем к плавлению. Сублимировать означает переходить из твердого состояния в газообразное напрямую, минуя жидкое состояние.
Точка кипения
Все формы ОС3 кипятить при 44,8ºC.
Плотность
SO3 жидкость (гамма) имеет плотность 1,9225 г / см 3 при 20 ° С.
SO3 газообразный имеет плотность 2,76 относительно воздуха (воздух = 1), что означает, что он тяжелее воздуха.
Давление газа
ЮЗ3 альфа = 73 мм рт. ст. при 25 ºC
ЮЗ3 бета = 344 мм рт. ст. при 25 ºC
ЮЗ3 гамма = 433 мм рт. ст. при 25 ºC
Это означает, что гамма-форма имеет тенденцию испаряться легче, чем бета и это, чем альфа.
Стабильность
Альфа-форма является наиболее стабильной структурой, остальные — метастабильными, то есть менее стабильными.
Химические свойства
SO3 бурно реагирует с водой с образованием серной кислоты H2ЮЗ4. При реакции выделяется много тепла, поэтому водяной пар быстро выделяется из смеси.
При контакте с воздухом SO3 быстро впитывает влагу, выделяя густые пары.
Это очень сильный обезвоживающий агент, а это значит, что он легко удаляет воду из других материалов.
Сера в SO3 он имеет сродство к свободным электронам (то есть электронам, которые не находятся в связи между двумя атомами), поэтому он имеет тенденцию образовывать комплексы с соединениями, которые обладают ими, такими как пиридин, триметиламин или диоксан.
Образуя комплексы, сера «заимствует» электроны у другого соединения, чтобы восполнить их недостаток. Триоксид серы все еще доступен в этих комплексах, которые используются в химических реакциях для получения SO3.
Это мощный сульфирующий реагент для органических соединений, что означает, что он используется для простого добавления группы -SO.3— молекулам.
Он легко реагирует с оксидами многих металлов с образованием сульфатов этих металлов.
Он вызывает коррозию металлов, тканей животных и растений.
SO3 С этим материалом трудно обращаться по нескольким причинам: (1) его температура кипения относительно низкая, (2) он имеет тенденцию к образованию твердых полимеров при температурах ниже 30 ºC и (3) он обладает высокой реакционной способностью почти ко всем органическим веществам. И вода.
Он может взрывоопасно полимеризоваться, если не содержит стабилизатора и присутствует влага. Диметилсульфат или оксид бора используются в качестве стабилизаторов.
Получение
Его получают реакцией при 400 ºC между диоксидом серы SO2 и молекулярный кислород O2. Однако реакция протекает очень медленно, и для увеличения скорости реакции требуются катализаторы.
Среди соединений, которые ускоряют эту реакцию, есть металлическая платина Pt, пятиокись ванадия V2ИЛИ5, оксид железа Fe2ИЛИ3 и оксид азота NO.
Приложения
При приготовлении олеума
Одно из основных его применений — приготовление олеума или дымящей серной кислоты, названной так потому, что она выделяет пары, видимые невооруженным глазом. Для его получения SO абсорбируется3 в концентрированной серной кислоте H2ЮЗ4.
Это делается в специальных башнях из нержавеющей стали, где концентрированная серная кислота (которая является жидкостью) опускается вниз, а SO3 газообразный поднимается.
Жидкость и газ вступают в контакт и объединяются, образуя олеум, который представляет собой маслянистую жидкость. Это обладает смесью H2ЮЗ4 Так что3, но в нем также присутствуют молекулы дисерной кислоты H2S2ИЛИ7 и трисерный H2S3ИЛИ10.
В химических реакциях сульфирования
Сульфирование — ключевой процесс в крупномасштабных промышленных применениях для производства детергентов, поверхностно-активных веществ, красителей, пестицидов и фармацевтических препаратов.
SO3 Он служит в качестве сульфирующего агента для приготовления сульфированных масел и алкиларилсульфированных моющих средств, среди многих других соединений. Ниже показана реакция сульфирования ароматического соединения:
Для реакций сульфирования можно использовать олеум или SO.3 в форме его комплексов с пиридином или с триметиламином, среди прочих.
При добыче металлов
SO газ3 Он использовался при лечении минералами. Простые оксиды металлов можно превратить в гораздо более растворимые сульфаты, обработав их SO3 при относительно низких температурах.
Сульфидные минералы, такие как пирит (сульфид железа), халькозин (сульфид меди) и миллерит (сульфид никеля), являются наиболее экономичными источниками цветных металлов, поэтому обработка SO3 позволяет легко и недорого получить эти металлы.
Сульфиды железа, никеля и меди реагируют с газом SO3 даже при комнатной температуре образуются соответствующие сульфаты, которые очень растворимы и могут быть подвергнуты другим процессам для получения чистого металла.
В различных применениях
SO3 используется для приготовления хлорсерной кислоты, также называемой хлорсульфоновой кислотой HSO3Cl.
Трехокись серы — очень мощный окислитель, который используется при производстве взрывчатых веществ.
Риски
На здоровье
SO3 Это высокотоксичное соединение при всех путях, то есть при вдыхании, проглатывании и контакте с кожей.
Раздражает и разъедает слизистые оболочки. Вызывает ожоги кожи и глаз. Его пары очень токсичны при вдыхании. Возникают внутренние ожоги, одышка, боль в груди и отек легких.
Это ядовито. Его проглатывание вызывает сильные ожоги рта, пищевода и желудка. Кроме того, предполагается, что он канцероген.
От пожара или взрыва
Он представляет опасность возгорания при контакте с материалами органического происхождения, такими как дерево, волокна, бумага, масло, хлопок и др., Особенно если они влажные.
Также существует риск при контакте с основаниями или восстановителями. Он взрывоопасно соединяется с водой, образуя серную кислоту.
При контакте с металлами может образовываться газообразный водород H2 который очень легко воспламеняется.
Следует избегать нагрева в стеклянных банках, чтобы предотвратить возможный сильный разрыв емкости.
Воздействие на окружающую среду
SO3 Он считается одним из основных загрязнителей, присутствующих в атмосфере Земли. Это связано с его ролью в образовании аэрозолей и его вкладом в кислотные дожди (из-за образования серной кислоты H2ЮЗ4).
SO3 образуется в атмосфере при окислении диоксида серы SO2. При формировании СО3 быстро реагирует с водой с образованием серной кислоты H2ЮЗ4. Согласно последним исследованиям, существуют и другие механизмы трансформации SO3 в атмосфере, но из-за присутствия в ней большого количества воды считается, что это гораздо более вероятно, чем SO3 становится в основном H2ЮЗ4.
SO3 Газ или газообразные промышленные отходы, содержащие его, нельзя сбрасывать в атмосферу, так как это опасный загрязнитель. Это высокореактивный газ, и, как упоминалось выше, при наличии влажности в воздухе SO3 превращается в серную кислоту H2ЮЗ4. Поэтому в воздухе SO3 он сохраняется в форме серной кислоты, образуя мелкие капли или аэрозоли.
Если капли серной кислоты попадают в дыхательные пути человека или животных, они быстро увеличиваются в размере из-за присутствующей там влаги, поэтому у них есть возможность проникнуть в легкие. Один из механизмов, с помощью которого кислотный туман H2ЮЗ4 (т.е. SO3) может вызывать сильную токсичность, поскольку изменяет внеклеточный и внутриклеточный pH живых организмов (растений, животных и людей).
По мнению некоторых исследователей, туман от SO3 Это причина увеличения числа астматиков в одном районе Японии. ТАК туман3 Он оказывает очень агрессивное воздействие на металлы, поэтому металлические конструкции, построенные людьми, такие как некоторые мосты и здания, могут быть серьезно повреждены.
SO3 Жидкость нельзя сбрасывать в канализацию или канализацию. В случае попадания в канализацию может возникнуть опасность пожара или взрыва. В случае случайного проливания не направляйте струю воды на продукт. Он никогда не должен попадать в опилки или другие горючие абсорбенты, так как это может вызвать пожар.
Его следует абсорбировать сухим песком, сухой землей или другим абсолютно сухим инертным абсорбентом. SO3 он не должен попадать в окружающую среду и не должен вступать в контакт с ним. Его следует держать вдали от источников воды, поскольку он производит серную кислоту, вредную для водных и наземных организмов.
Ссылки
- Sarkar, S. et al. (2019). Влияние аммиака и воды на судьбу триоксида серы в тропосфере: теоретическое исследование путей образования сульфаминовой кислоты и серной кислоты. J Phys Chem A. 2019; 123 (14): 3131-3141. Восстановлено с ncbi.nlm.nih.gov.
- Мюллер, Т. (2006). Серная кислота и триоксид серы. Кирк-Отмер Энциклопедия химической технологии. Том 23. Получено с сайта onlinelibrary.wiley.com.
- НАС. Национальная медицинская библиотека. (2019). Трехокись серы. Получено с pubchem.ncbi.nlm.nih.gov.
- Кикучи, Р. (2001). Экологический менеджмент выбросов триоксида серы: влияние SO3 по здоровью человека. Environmental Management (2001) 27: 837. Получено с сайта link.springer.com.
- Коттон, Ф. Альберт и Уилкинсон, Джеффри. (1980). Продвинутая неорганическая химия. Четвертый выпуск. Джон Вили и сыновья.
- Исмаил, М. (1979). Извлечение металлов из сульфидов с использованием триоксида серы в псевдоожиженном слое. J. Chem. Tech. Biotechnol. 1979, 29, 361-366. Получено с сайта onlinelibrary.wiley.com.
Классическая древность: периоды и их характеристики
Источник