Биосинтез углеводов: кратко и понятно 9 класс
Биосинтез углеводов: кратко и понятно
Затем глю-6-ф превращается в глю-1-ф. В процессе активации глю-1-ф участвуют уридиннуклеотиды. В ходе этого процесса два концевых фосфорных остатка УДФ освобождаются в виде неорганического пирофосфата͵ остаток УМФ соединяется с глю-1-ф, образуя УДФ-глюкозу.
Глюкоза как моносахарид свободно диффундирует через мембрану печеночных клеток, она не может служить резервом углеводородов в печени. Так как фосфатные эфиры глюкозы и фруктозы не столь легко проникают через мембраны, фосфорилирование этих сахаров создает как бы ловушку для них, эффективно изолируя реакции гликолиза и фосфоглюконатного пути в пределах внутриклеточного отсека. Тем не менее фосфаты сахаров не могут накапливаться в больших количествах в печени, так как благодаря осмосу увеличение их запасов будет сопровождаться накоплением больших количеств воды.
Обмен гликогена
Реакции пентозофосфатного пути протекают в цитозоле.
Образование АТФ.
По другому вторичному пути катаболизма глюкозы в животных тканях образуются два специализированных продукта: D-глюконат, важная роль которого связана с обезвреживанием и выведением из организма чужеродных органических веществ, и L-аскорбиновая кислота (витамин С).
Взаимосвязь пентозного пути и гликолиза.
В печени происходит превращение избытка углеводов в нерастворимый полимер – гликоген. Эта резервная форма глюкозы может составлять одну десятую всей массы печени. При голодании запас гликогена почти полностью истощается.
Обмен гликогена включает в себя 2 процесса: гликогенез или синтез гликогена и гликогенолиз или распад гликогена.
Гликогенез – синтез гликогена — ϶ᴛᴏ анаболический процесс, требующий затраты энергии в форме как АТФ, так и уридинтрифосфата (УТФ). Исходным источником для синтеза гликогена является глю, d под действием глюкокиназы превращается в глю-6-фосфат.
Глю-6-ф занимает ключевое положение как общий промежуточный продукт ряда процессов углеводного обмена: он способен к обратимому превращению в пируват путем гликолиза или глюконеогенеза, а также к необратимому – в пентозы в ходе фосфоглюконатного пути. Глю-6-ф может обратимо превращаться в гликоген.
Источником глю при синтезе гликогена является УДФ-глю, d образуется из глюкозо-1-ф и УТФ:
Глю-1-ф + УТФ 
На следующей стадии происходит перенос остатка глю с УДФ-глю на затравку гликогена с помощью гликогенсинтетазы:
УДФ-глю + (глю)n
Гликогенсинтетаза катализирует образование только 

Гликогенолиз – распад гликогена идет путем фосфоролиза.
Гликолиз, пентозофосфатный путь, гликогенолиз — ϶ᴛᴏ катаболические пути, которые сходятся в цикле лимонной кислоты, чтобы передать свои богатые энергией электроны в дыхательную цепь. Перемещаясь по дыхательной цепи к кислороду, эти электроны поставляют энергию для синтеза АТФ. Теперь нам предстоит рассмотреть анаболические пути. На этих путях химическая энергия в форме АТФ и НАДФН используется для синтеза клеточных компонентов из простых предшественников.
Анаболизм прокариот
Основные компоненты прокариотной клетки состоят из органических веществ-полисахаридов, белков, нуклеиновых кислот, липидов, большинство из которых (исключая липиды) являются полимерами. Образованию полимеров предшествует биосинтез мономеров, их составляющих. На процессы биосинтеза мономеров и реакции их полимеризации расходуется большая часть энергии, получаемой клеткой в процессах катаболизма.
Биосинтез углеводов.Прокариоты способны синтезировать моно-, олиго-, и полисахариды, а также и другие соединения, в состав которых входят углеводы.
Для прокариот-автотрофов исходным продуктом для синтеза углеводов является СО2.
Фотосинтезирующие автотрофные микроорганизмы фиксируют СО2 и осуществляют биосинтез углеводов также, как растения при фотосинтезе, через восстановительный пентозофосфатный цикл, или цикл Кальвина. Из клеток автотрофных прокариот выделены два специфических фермента этого цикла:
1. Фосфорибулокиназа, фосфорилирующая рибулозо-5-фосфат при участии АТФ в рибулозо-1,5-дифосфат, выступающий далее акцептором СО2.
Рибулозодифосфаткарбоксилаза, катализирующая реакцию фиксации СО2 рибулозо-1,5-дифосфатом с образованием двух молекул
3-фосфоглицериновой кислоты. 3-ФГК подвергается различным превращениям до получения глюкозы.
Подобным образом фиксируют СО2 и ведут синтез углеводов хемосинтезирующие автотрофные микроорганизмы.
Но они используют энергию АТФ, получаемую клеткой в результате реакций окисления неорганических веществ субстрата.
Моносахариды, образовавшиеся в результате фиксации СО2, используются на синтез олиго- и полисахаридов.
Биосинтез углеводов
Биосинтез полисахаридов осуществляется путем трансгликозилирования (переноса остатков моносахаридов на конец растущей цепи полисахарида) и всегда сопровождается затратой энергии.
Прокариоты-гетеротрофы способны синтезировать углеводы из С2 и С3-соединений, используя при этом реакции гликолитического пути, идущие в обратном направлении.
Все гетеротрофные микроорганизмы, помимо усвоения органических углерод содержащих веществ, фиксируют углекислый газ и используют его в реакциях анаболизма и катаболизма.
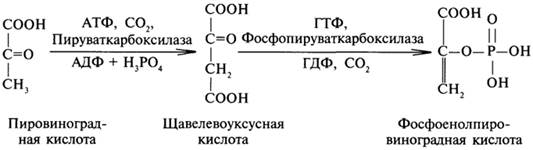
Включение СО2 в вещества клетки у гетеротрофных микроорганизмов происходит в реакциях карбоксилирования. В большинстве случаев акцепторами СО2 выступают органические кислоты, например реакции карбоксилирования пировиноградной кислоты с образованием щавелевоуксусной (ЩУК) или яблочной кислот:
СН3-СО-СООН + СО2 +АТФ пируваткарбоксилазаНООС-СН2-СО-СООН + +АДФ+Фн.
СН3-СО-СООН +СО2 +НАД(Ф)Н малатдегидрогеназа НООС-СН2-СНОН-СООН +НАД(Ф)+
Как осуществляется биосинтез углеводов?
Биосинтез крахмала начинается с глюкозо-6-фосфата. Донором глюкозы служит сахароза. На первой стадии синтеза глюкозо-6-фосфат превращается в глюкозо-1-фосфат.
На второй стадии образуется донор активированной глюкозы:
АТФ + глюкозо-1-фосфат АДФГ + пирофосфат
Для большинства растений донором активированной глюкозы является АДФГ.
На третьей стадии синтеза осуществляется перенос активированной глюкозы от АДФГ на акцептор.
Акцептором, или затравкой, в данном случае служит небольшая молекула полисахарида, состоящая иногда всего лишь из 3-4 остатков глюкозы, соединенных гликозидными связями. Реакцию катализирует фермент из подкласса гликозилтрансфераз.
В результате затравка постепенно удлиняется. Так происходит биосинтез амилозы. Затем часть амилозы используется для биосинтеза амилопектина.
Синтез амилопектина подразделяется на синтез неразветвленной и разветвленной частей. Неразветвленная часть образуется аналогично амилозе.
В синтезе разветвленной части участвует ветвящий фермент (Q-фермент), который отщепляет от неразветвленной цепочки фрагмент, построенный из остатков глюкозы, соединенных а-1,4-гликозидными связями, и переносит его к шестому атому углерода одного из остатков глюкозы неразветвленной части амилопектина.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Липиды
Липиды имеют очень большое значение в метаболизме клетки. Все липиды — ϶ᴛᴏ органические водонерастворимые соединения, присутствующие во всех живых клетках. Необходимо отметить, что по своим функциям липиды разделяются на три группы:
— структурные и рецепторные липиды клеточных мембран
— энергетическое ʼʼдепоʼʼ клеток и организмов
— витамины и гормоны ʼʼлипиднойʼʼ группы
Основу липидов составляют жирные кислоты (насыщенные и ненасыщенные) и органический спирт – глицерол.
Основную массу жирных кислот мы получаем из пищи (животной и растительной). Животные жиры — ϶ᴛᴏ смесь насыщенных (40-60%) и ненасыщенных (30-50%) жирных кислот. Растительные жиры наиболее богаты (75-90%) ненасыщенными жирными кислотами и наиболее полезны для нашего организма.
Основная масса жиров используется для энергетического обмена, расщепляясь специальными ферментами – липазами и фосфолипазами.
В результате получаются жирные кислоты и глицерин, которые в дальнейшем используются в реакциях гликолиза и цикла Кребса.С точки зрения образования молекул АТФ — жиры составляют основу энергетического запаса животных и человека.
Эукариотическая клетка получает жиры с пищей, хотя сама может синтезировать большинство жирных кислот (за исключением двух незаменимых– линолевой и линоленовой).
Синтез начинается в цитоплазме клеток с помощью сложного комплекса ферментов и заканчивается в митохондриях или гладком эндоплазматическом ретикулуме.
Исходным продуктом для синтеза большинства липидов (жиров, стероидов, фосфолипидов) служит ʼʼуниверсальнаяʼʼ молекула – ацетил-Коэнзим А (активированная уксусная кислота), являющаяся промежуточным продуктом большинства реакций катаболизма в клетке.
Жиры есть в любой клетке, но особенно много их в специальных жировых клетках – адипоцитах, образующих жировую ткань. Контролируется жировой обмен в организме специальным гормонами гипофиза, а также инсулином и адреналином.
Углеводы (моносахариды, дисахариды, полисахариды) являются важнейшими соединениями для реакций энергетического обмена.
В результате распада углеводов клетка получает большую часть энергии и промежуточные соединения для синтеза других органических соединений (белков, жиров, нуклеиновых кислот).
Основную массу сахаров клетка и организм получает извне – из пищи, но может синтезировать глюкозу и гликоген из неуглеводных соединений.
Субстратами для разного вида углеводного синтеза выступают молекулы молочной кислоты (лактат) и пировиноградной кислоты (пируват), аминокислоты и глицерин. Эти реакции идут в цитоплазме при участии целого комплекса ферментов – глюкозо-фосфотаз. Для всех реакций синтеза требуется энергия – синтез 1 молекулы глюкозы требует 6 молекул АТФ!
Основной объём собственного синтеза глюкозы протекает в клетках печени и почек, но не идет в сердце, мозге и мышцах (там нет необходимых ферментов).
По этой причине нарушения углеводного обмена в первую очередь сказываются на работе этих органов. Углеводный обмен контролируется группой гормонов: гормонами гипофиза, глюкокортикостероидными гормонами надпочечников, инсулином и глюкагоном поджелудочной железы. Нарушения гормонального баланса углеводного обмена приводит к развитию диабета.
Мы кратко рассмотрели основные части пластического обмена.
Источник
Биосинтез углеводов
В тканях и органах человека происходит синтез сложных углеводов. Строительным блоком (мономерным звеном) для синтеза служит глюкоза. Большая часть глюкозы поступает в организм человека с пищей, однако при длительном голодании может включаться механизм синтеза глюкозы из неуглеводных источников.
Глюконеогенез— процесс новообразования глюкозы из неуглеводных источников. В качестве субстратов глюконеогенеза могут служить аминокислоты, превращающиеся в пировиноградную и в щавелевоуксусную кислоты; такие аминокислоты называютсягликогенными. К гликогенным относятся все протеиногенные аминокислоты, кроме лейцина. Также к неуглеводным источникам глюконеогенеза относятся глицерин, кислоты цикла Кребса, молочная кислота. Преобразование всех указанных веществ (кроме глицерина) в глюкозу проходит через стадию пировиноградной и щавелевоуксусной кислот.
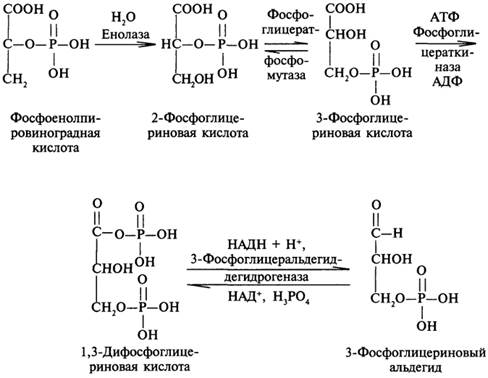
Большая часть реакций на пути от пирувата до глюкозы катализируется ферментами гликолиза путем обращения соответствующих реакций. Однако нормальный путь гликолиза («сверх вниз») включает 4 необратимых этапа, которые не могут быть использованы в глюконеогенезе, идущем «снизу вверх». Это реакции, катализируемые гексокиназой, фосфофруктокиназой, фосфоглицераткиназой и пируваткиназой; в глюконеогенезе эти этапы осуществляются обходными путями.
Превращение ПВК в фосфоенолпировиноградную кислоту происходит через стадию образования щавелевоуксусной кислоты:
Далее фосфоенолпировиноградная кислота превращается в фосфотриозы, которые дают фруктозо-1,6-дифосфат:
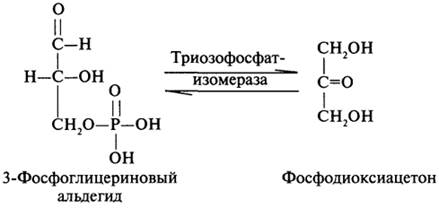
Для образования фруктозе-1,6-дифосфата требуется две молекулы 3-фосфоглицеринового альдегида, одна из которых превратится в фосфодиоксиацетон при участии фермента триозофосфатизомеразы:
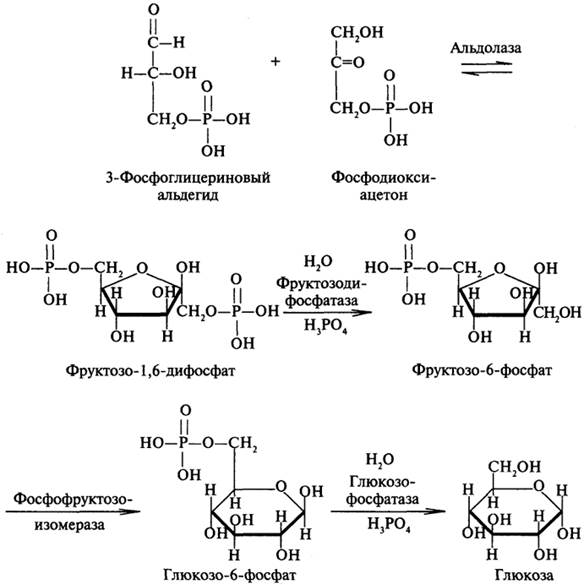
Далее из этих двух фосфотриоз образуется фруктозо-1,6-дифосфат. На последних стадиях глюконеогенеза «работают» ферменты фосфатазы, которые не представлены в гликолизе. Это еще один факт, подтверждающий самостоятельность глюконеогенеза:
Глюконеогенез — регулируемый процесс, на скорость протекания которого оказывают влияние гормоны. Инсулин тормозит образование углеводов из аминокислот, кортикостероиды, наоборот, стимулируют глюконеогенез.
Столь подробное рассмотрение процесса глюконеогенеза связано с тем, что этот метаболический путь использует молочную кислоту, накапливающуюся в мышцах во время интенсивной мышечной работы. Следовательно, глюконеогенез, протекающий в печени, можно рассматривать как приспособление для разгрузки организма от молочной кислоты, образующейся в мышцах в анаэробных условиях.
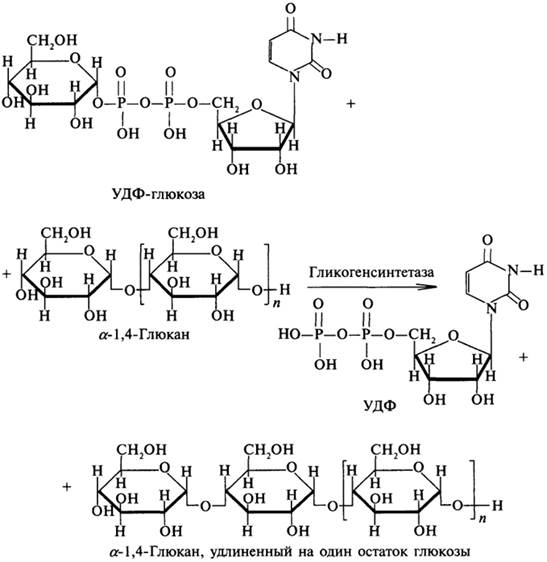
Биосинтез гликогена.Иначе биосинтез гликогена называется гликогеногенезом. Он осуществляется практически во всех тканях, но особенно активно протекает в скелетных мышцах и в печени. Биосинтез гликогена может идти двумя путями. Один из них заключается в переносе олигосахаридных фрагментов с одного полисахарида на существующий фрагмент гликогена, другой — в переносе остатков глюкозы. Источником остатков глюкозы служит уридиндифосфатглюкоза (УДФ-глюкоза), которая образуется из глюкозо-1-фосфата и УТФ при участии фермента глюкозо-1-фосфатуридилтрансферазы:
Глюкозо-1 -фосфат + УТФ → УДФ-глюкоза + Н4Р2О7
Синтез гликогена осуществляет фермент гликогенсинтетаза. Фермент снимает остаток глюкозы с УДФ-глюкозы и переносит его на нередуцирующий конец растущей цепи гликогена:
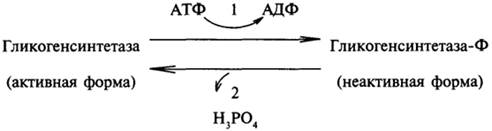
Активность гликогенсинтетазы регулируется за счет реакций фосфорилирования — дефосфорилирования. Активной формой гликогенсинтетазы является ее дефосфорилированная форма. Эти процессы катализируют два фермента: киназа гликогенсинтетазы (1) и фосфатаза гликогенсинтетазы (2).
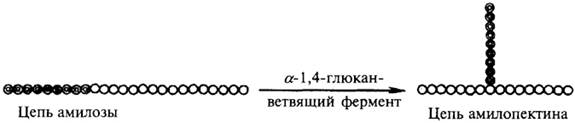
Гликогенсинтетаза ведет синтез цепи амилозного типа. Разветвленная структура образуется путем переноса полиглюкозидной цепи у α-1,4-глюкана из положения 4 в положение 6. Этот механизм реализуется с помощью фермента, который называется α-1,4-глюканветвящий фермент. Трансгликозилирование, катализируемое этим ферментом, можно схематично представить следующим образом.
Интеграция разных путей обмена углеводов в организме.Интенсивность катаболических и анаболических путей обмена углеводов в разных тканях организма неодинакова и определяется прежде всего особенностями обмена каждой ткани и органа. Если рассматривать организм в целом, то можно выявить некоторую специализацию путей превращения углеводов в отдельных тканях. Такая специализация, несомненно, оправдана, так как отвечает функциональной направленности ткани или органа. Поскольку функционирование отдельных органов обеспечивает жизнедеятельность всего организма, существенным моментом в обмене веществ в целом и в обмене углеводов в частности является интеграция катаболических и анаболических процессов.
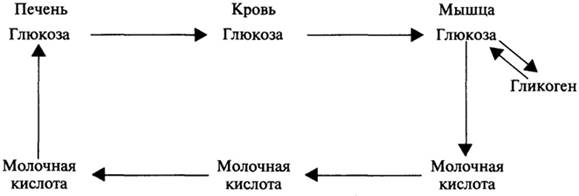
Приведем пример. При активной мышечной работе затрачиваются большие количества энергии, которая первоначально извлекается в ходе распада гликогена до молочной кислоты.
Схема действия α-1,4-глюканветвящего фермента.
Молочная кислота, как говорилось выше, вымывается в кровь, которая доставляет ее в печень, где происходит синтез глюкозы в ходе глюконеогенеза. Глюкоза из печени переносится кровью в скелетные мышцы, где либо расходуется на образование энергии, либо запасается в виде гликогена. Этот межорганный цикл в обмене углеводов получил название цикла Кори:
Схема Цикл Кори
Функция мышечного гликогена заключается в том, что он является легкодоступным источником глюкозы для самой мышцы. Гликоген печени используется главным образом для поддержания физических концентраций глюкозы в крови в основном в промежутках между приемами пищи. Через 12 — 18 ч после приема пищи запас гликогена в печени почти полностью истощается. Содержание мышечного гликогена заметно снижается только после продолжительной и напряженной физической работы. Повышенное содержание гликогена в мышцах может наблюдаться при диете с высоким содержанием углеводов, если перед этим запасы гликогена были снижены в результате высокой мышечной нагрузки.
Дата добавления: 2015-03-14 ; просмотров: 6410 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник