- Синдром Стиклера ( Врожденная артроофтальмопатия )
- МКБ-10
- Общие сведения
- Причины
- Патогенез
- Классификация
- Симптомы
- Осложнения
- Диагностика
- Лечение синдрома Стиклера
- Консервативная терапия
- Хирургическое лечение
- Прогноз и профилактика
- Что значит синдром сметкина
- Высокопоточная оксигенация: ключевые принципы
- Основные эффекты высокопоточной назальной оксигенации
- Высокопоточная оксигенация в лечении ОРДС
- Использование ВПО на начальных этапах лечения ОРДС
- Использование ВПО в ходе индукции анестезии у пациентов с ОРДС
- Применение ВПО в период прекращения ИВЛ при ОРДС
- Заключение
Синдром Стиклера ( Врожденная артроофтальмопатия )
Синдром Стиклера — это редкий вариант наследственных коллагенопатий, при котором происходит нарушение структуры коллагена II, IX, XI типов. Наследуется по аутосомно-доминантному и аутосомно-рецессивному механизмах. Заболевание проявляется прогрессирующей миопией с отслойкой сетчатки, поражением костно-суставного аппарата, характерными фенотипическими особенностями. Диагностика синдрома проводится при помощи рентгенографии скелета, офтальмоскопии, биохимического и молекулярно-генетического тестирования. Лечение поддерживающее: реабилитационные программы, психологическая поддержка, хирургическая коррекция осложнений.
МКБ-10
Общие сведения
Синдром Стиклера назван в честь американского педиатра Г.Б. Стиклера, который в 1965 г. выпустил статью с анализом своей многолетней работы с пациентами, имевшими типичный комплекс симптомов: прогрессирующую миопию, дегенерацию суставов, расширение эпифизов. Генетические основы патологии были открыты только в 1980-1990-х гг. Заболевание имеет второе название «врожденная артроофтальмопатия». Распространенность синдрома Стиклера составляет 1 случай на 7,5-10 тыс. взрослого населения, половых различий в структуре заболеваемости нет.
Причины
При синдроме Стиклера выделено 5 вариантов мутаций в генах, кодирующих синтез коллагеновых волокон: COL2A1, COL11A1, COL11A2, COL9A1, COL9A2. Заболевание 1, 2, 3 подтипов характеризуется аутосомно-доминантным вариантом наследования, то есть вероятность рождения больного ребенка составляет 50%, если один из родителей — носитель мутантного гена. Синдром 4 и 5 подтипов передается аутосомно-рецессивно, проявляется только если оба родителя имеют мутантный ген.
Патогенез
Болезнь возникает при нарушении структуры коллагеновых волокон 2-го, 9-го и 10-го типов, которые входят в состав костной и хрящевой ткани, стекловидного тела глазного яблока. Дефектный коллаген изменяет нормальную структуру соединительной ткани. При этом у пациентов нарушается формирование суставов, происходят дегенеративные процессы, деформируется костный скелет и, как следствие, становятся заметными характерные фенотипические признаки.
Классификация
В клинической практике систематизация заболевания на отдельные подтипы используется редко, что обусловлено схожестью их симптоматики, общностью подходов лечения. По результатам молекулярно-генетической диагностики были выделены 5 разновидностей синдрома Стиклера, которые отличаются локализацией мутации, видом дефектного коллагена. В классификации наследственной коллагенопатии выделяют такие варианты:
- I — мутация COL2A1, кодирующего альфа-1 цепь коллагена 2 типа.
- II — аномалия COL11A1, который отвечает за синтез альфа-1 цепи коллагена 11 типа.
- III — патология COL11A2, отвечающего за образование α-2 цепи коллагеновых волокон 11 типа.
- IV — изменение последовательности COL9A1, регулирующего синтез α-1 коллагеновых цепей 9 типа.
- V — точечная мутация COL9A2, который кодирует альфа-2 цепь коллагеновых волокон 9 типа.
Симптомы
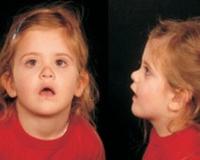
Дети с врожденной артроофтальмопатией имеют специфические изменения черт лица, которые заметны уже в неонатальном периоде. У больных проявляется аномалия Робина: плоское лицо с недоразвитой нижней челюстью, расщелины неба, западение языка. Также наблюдается выпирание верхней губы, деформация скуловых дуг, западение переносицы. Изредка пациенты имеют типичный марфаноидный фенотип, что затрудняет постановку диагноза.
Суставные поражения вначале проявляются гипермобильностью, чрезмерной гибкостью и подвижностью. Дети и подростки часто страдают искривлениями позвоночника в виде кифоза, лордоза, сколиоза. По мере прогрессирования синдрома дегенеративные изменения провоцируют контрактуры, боль, увеличение и припухлость суставов. Пациенты после 30 лет обычно сталкиваются с артропатией тазобедренных, коленных, голеностопных суставов.
Повреждение зрительного аппарата состоят в прогрессирующем ухудшении зрения, появлении катаракты, дегенеративных изменений стекловидного тела. Возникают нарушения слуха по типу кондуктивной тугоухости. У части больных отмечается задержка психомоторного развития, снижение интеллектуальных способностей легкой или средней степени тяжести.
Осложнения
Наиболее опасным последствием синдрома является отслойка сетчатки, которая может начаться в детском возрасте при отсутствии лечения прогрессирующей миопии. В результате наступает слепота на один или оба глаза. Поражение суставов со временем приводит к ограничению подвижности и без коррекции заканчивается инвалидностью больных. Неэстетичные изменения лицевого скелета становятся причинами комплексов, проблем с социализацией.
Вовлечение в процесс слухового анализатора чревато частыми отитами, а при неблагоприятном течении есть риск снижения слуха вплоть до глухоты. Изредка патология соединительной ткани затрагивает клапанный аппарат сердца, что вызывает пролапс митрального клапана, нарушения кровообращения, сердечную недостаточность. Аномалии строения ротовой полости сопровождаются проблемами с употреблением пищи, высоким риском аспирации, затруднениями при дыхании.
Диагностика
Синдром Стиклера отличается полиморфностью клинической картины, схожестью симптоматики с другими наследственными нарушениями соединительной ткани, что усложняет диагностический поиск. При первичном осмотре у педиатра определяются фенотипические проявления коллагенопатий, изучается семейный анамнез. Для подтверждения врожденной артроофтальмопатии назначаются следующие методы исследования:
- Рентгенография скелета. Патогномоничными симптомами синдрома Стиклера являются расширенные эпифизы костей, измененная структура диафизов, дегенерация суставов. Для более детальной диагностики делаются компьютерная томография суставов, КТ лицевого черепа.
- Молекулярно-генетическое тестирование. Исследование генома рекомендовано для 100% подтверждения диагноза у страдающих болезнью Стиклера. В генетических лабораториях используют методики флуоресцентной гибридизации, секвенирования генома, чтобы выявить поврежденный ген, уточнить подтип синдрома.
- Лабораторные методы. С помощью тонкослойной хроматографии выявляют повышение уровня гликозаминогликанов в крови, их усиленное выделение с мочой. Состояние коллагеновых волокон оценивают иммуногистохимическим способом с определением специфических антител, а также путем анализа свободного гидроксипролина в моче.
- Консультации специалистов. Осмотр офтальмолога с проведением офтальмоскопии необходим, чтобы оценить состояние зрительного аппарата, осмотреть глазное дно, выявить признаки начинающейся отслойки сетчатки. Прием отоларинголога с выполнением аудиометрии применяется при проблемах со слухом.
Лечение синдрома Стиклера
Консервативная терапия
Этиопатогенетическое лечение болезни Стиклера отсутствует. Усилия врачей направлены на коррекцию существующих проблем со здоровьем, повышение качества жизни пациентов. Комплексный подход к терапии таких больных включает несколько направлений:
- ЛФК. Лечебная физкультура необходима для устранения тугоподвижности суставов, возникающей при прогрессировании синдрома, коррекции искривлений позвоночника и сопутствующего им мышечно-тонического синдрома. ЛФК, как правило, дополняется массажем, кинезиотейпированием.
- Абилитация. Детям со сниженным интеллектом требуется обучение в специальных школах, занятия с дефектологами, логопедами, олигофренопедагогами. Таким образом удается повысить обучаемость пациентов, подготовить их к самостоятельной жизни.
- Психологическая помощь. Дефекты внешности в сочетании со снижением когнитивных возможностей затрудняют социализацию детей, провоцируют замкнутость, депрессии. Для коррекции этих проблем требуется регулярные визиты к детскому психологу.
Хирургическое лечение
Больным зачастую требуется помощь офтальмохирургов, которые проводят лазерную коагуляцию или криотерапию для лечения отслоения сетчатки, сохранения зрения. При критическом ухудшении слуха рассматривается вопрос о постановке слухового аппарата. Аномалии развития лицевого черепа требуют поэтапной пластической коррекции, чтобы устранить проблемы с дыханием и приемом пищи, улучшить эстетику внешности.
Прогноз и профилактика
Состояние пациентов зависит от своевременности постановки диагноза, полноты терапевтических, хирургических, реабилитационных мероприятий. При должном лечении удается поддерживать хорошее качество жизни больных, поэтому прогноз относительно благоприятный. Меры первичной профилактики синдрома не разработаны. Семейным парам с отягощенной наследственностью рекомендована консультация генетика при планировании зачатия.
Источник
Что значит синдром сметкина
ГБУЗ АО «Первая городская клиническая больница им. Е.Е. Волосевич», 163000, Архангельск, Россия
ФГБОУ ВО «Северный государственный медицинский университет» Минздрава России, 163000, Архангельск, Россия; ГБУЗ АО «Первая городская клиническая больница им. Е.Е. Волосевич», 163000, Архангельск, Россия
ФГБОУ ВО «Северный государственный медицинский университет» Минздрава России, 163000, Архангельск, Россия; ГБУЗ АО «Первая городская клиническая больница им. Е.Е. Волосевич», 163000, Архангельск, Россия
ФГБОУ ВО «Северный государственный медицинский университет» Минздрава России, 163000, Архангельск, Россия
ФГБОУ ВО СГМУ Минздрава России, Архангельск, Россия
Применение высокопоточной оксигенации в терапии острого респираторного дистресс-синдрома
Журнал: Анестезиология и реаниматология. 2020;(1): 47-54
Ушаков А. А., Смёткин А. А., Фот Е. В., Кузьков В. В., Киров М. Ю. Применение высокопоточной оксигенации в терапии острого респираторного дистресс-синдрома. Анестезиология и реаниматология. 2020;(1):47-54.
Ushakov A A, Smyotkin A A, Fot E V, Kuzkov V V, Kirov M Yu. High flow oxygenation in acute respiratory distress syndrome: possibilities and perspectives. Russian Journal of Anaesthesiology and Reanimatology. 2020;(1):47-54.
https://doi.org/10.17116/anaesthesiology202001147
ГБУЗ АО «Первая городская клиническая больница им. Е.Е. Волосевич», 163000, Архангельск, Россия


Высокопоточная назальная оксигенация позволяет обеспечить доставку увлажненной и подогретой кислородно-воздушной смеси с фракцией вдыхаемого кислорода от 21 до 100% и величиной потока до 80 л/мин. Высокопоточная оксигенация имеет определенные преимущества перед неинвазивной вентиляцией легких. Как показывают результаты недавних исследований, высокопоточная оксигенация не менее эффективна, чем традиционная оксигенотерапия, а в ряде ситуаций более комфортна для пациента и может эффективно использоваться на различных этапах лечения острого респираторного дистресс-синдрома.
ГБУЗ АО «Первая городская клиническая больница им. Е.Е. Волосевич», 163000, Архангельск, Россия
ФГБОУ ВО «Северный государственный медицинский университет» Минздрава России, 163000, Архангельск, Россия; ГБУЗ АО «Первая городская клиническая больница им. Е.Е. Волосевич», 163000, Архангельск, Россия
ФГБОУ ВО «Северный государственный медицинский университет» Минздрава России, 163000, Архангельск, Россия; ГБУЗ АО «Первая городская клиническая больница им. Е.Е. Волосевич», 163000, Архангельск, Россия
ФГБОУ ВО «Северный государственный медицинский университет» Минздрава России, 163000, Архангельск, Россия
ФГБОУ ВО СГМУ Минздрава России, Архангельск, Россия
Кислородотерапия является средством первого ряда для лечения гипоксемической дыхательной недостаточности, однако эффективность этой методики ограничена, особенно при необходимости наращивания фракции вдыхаемого кислорода. Следует также учитывать, что при использовании стандартной маски или носовых канюль фракция вдыхаемого кислорода, как правило, не превышает 40% за счет «примешивания» окружающего воздуха. Ограничены также возможности подогрева дыхательной смеси и поддержания положительного давления в конце выдоха, что снижает клиническую эффективность метода [1]. Альтернативой в таких случаях является инвазивная искусственная вентиляция легких (ИВЛ). Данный метод сам по себе является жизнеспасающим, но при этом не лишен ряда недостатков. К наиболее частым осложнениям ИВЛ относят вентилятор-ассоциированную пневмонию и трахеобронхит, баро-, волюмо-, оксигено- и ателектотравму [2—5].
В качестве еще одного метода респираторной терапии может выступать неинвазивная вентиляция легких (НИВЛ). Данная методика хорошо зарекомендовала себя в лечении декомпенсации хронической обструктивной болезни легких (ХОБЛ), некардиогенного и кардиогенного отека легких [6—12]. К факторам, ограничивающим ее активное применение, можно отнести трудоемкость метода, а в ряде ситуаций — дискомфорт для пациента. В начале XXI века для респираторной поддержки пациентов в критическом состоянии начали рассматривать еще менее инвазивную методику — высокопоточную оксигенацию (ВПО) [6, 12, 13]. Последняя имеет ряд преимуществ перед стандартной оксигенотерапией и НИВЛ в лечении артериальной гипоксемии, не вызывает существенного дискомфорта у больного и обеспечивает величину инспираторного потока, близкую к потребностям пациента с дыхательной недостаточностью (40—60 л/мин) [14, 15].
Возможности применения ВПО в терапии острого респираторного дистресс-синдрома (ОРДС) являются в настоящее время предметом повышенного интереса со стороны врачей-анестезиологов-реаниматологов и требуют активного изучения. На данный момент нет четких алгоритмов по применению ВПО при ОРДС, не определены оптимальные показания для использования данной методики у этой категории больных, что побудило авторов к написанию обзора.
Высокопоточная оксигенация: ключевые принципы
Высокопоточная назальная оксигенация позволяет обеспечить доставку увлажненной и подогретой кислородно-воздушной смеси с фракцией вдыхаемого кислорода от 21 до 100% и величиной потока до 80 л/мин. Методика ВПО включает различные системы для эффективного увлажнения и согревания газовой смеси [13].
Принципиальными особенностями ВПО являются возможности пошаговой регуляции скорости потока и температуры, а также точность установки фракции вдыхаемого кислорода. Современные системы ВПО располагают специальными дыхательными контурами из полупроницаемого материала, не допускающего образования конденсата, а также оригинальными носовыми или трахеостомическими канюлями. При этом максимальный поток, тип увлажнения и дизайн носовых канюль варьируют в зависимости от модели устройства. На сегодняшний день оборудование для высокопоточной кислородотерапии представлено несколькими производителями [13, 14]. Кроме того, ВПО стала появляться в качестве дополнительной опции на аппаратах ИВЛ [15].
Основные эффекты высокопоточной назальной оксигенации
Основными положительными эффектами ВПО являются соответствие величины потока аппарата на вдохе потоку в дыхательных путях пациента с дыхательной недостаточностью и возможность повышения фракции кислорода на вдохе. К физиологическим эффектам ВПО относится и уменьшение мертвого пространства дыхательных путей, что обеспечивается за счет высокого потока кислородно-воздушной смеси (эффект вымывания, washout effect). Более того, высокий поток обеспечивает динамический рост давления в дыхательных путях на выдохе (эффект положительного давления в конце выдоха, ПДКВ), что способствует расправлению спавшихся альвеол и вовлечению их в газообмен [16, 17]. Повышение ПДКВ на фоне высокопоточной назальной оксигенации ограничено 2—7 см вод. ст., поэтому оно не сопровождается нарушениями гемодинамики [13, 18, 19]. Поток газовой смеси с температурой от 31 °C и выше дает возможность дополнительного согревания и увлажнения слизистой дыхательных путей, что благоприятно влияет на газообмен и переносимость пациентом процедуры. Благодаря оригинальной методике постоянного испарения влаги в контуре обеспечивается оптимальная влажность подаваемой смеси.
Таким образом, подогрев и адекватное увлажнение смеси способствуют улучшению клиренса слизистого секрета, что уменьшает бронхообструкцию и препятствует дальнейшему ателектазированию. Следует также отметить, что создание высокого потока сводит к минимуму «примешивание» окружающего воздуха, позволяя обеспечить стабильную и управляемую фракцию вдыхаемого кислорода, вплоть до 100% [20, 21]. Описанные эффекты позволяют улучшить элиминацию углекислого газа (СО2), снизить частоту дыхания и стабилизировать показатели оксигенации (рис. 1). 
Простота использования метода и «дружелюбный» интерфейс минимизируют потенциальную возможность ошибок в результате человеческого фактора. Основные противопоказания к ВПО включают нарушение сознания, высокий риск аспирации и обструкцию носовых ходов (травма, кровотечение, операция) [17, 20, 22]. Проведение ВПО может быть крайне опасным у пациентов с переломом основания черепа в связи с риском пневмоцефалии и менингита [17]. Кроме того, у пациентов с ХОБЛ при использовании ВПО с высокой фракцией кислорода возможно развитие респираторного ацидоза вследствие снижения частоты дыхательных движений и гиповентиляции [17, 22]. К специфическим, но достаточно редким проблемам проведения ВПО относят раздражение, дискомфорт и заложенность слизистой носоглотки, ощущение избыточного тепла, нарушения обоняния, дополнительный шумовой эффект и аэрофагию [17].
Определенную озабоченность вызывают вопросы инфекционной безопасности применения ВПО. В ходе ряда исследований оценена степень бактериального загрязнения окружающей среды на фоне использования высокопоточных носовых канюль по сравнению с обычной кислородной маской у пациентов с пневмонией.
Результаты показали, что использование ВПО не ассоциировалось с ростом контаминации окружающей среды грамотрицательными или иными бактериями [13, 23].
Преимущества стандартной кислородотерапии, высокопоточной назальной оксигенации и НИВЛ [22—24] суммированы в таблице. 
Высокопоточная оксигенация в лечении ОРДС
С момента первого описания ОРДС в 1967 г. прошло более полувека, однако данное состояние до сих пор является одной из ключевых проблем в отделении интенсивной терапии (ОИТ) и сопровождается высокой летальностью [25, 26]. Исход лечения ОРДС зависит от многих факторов, из них решающее значение имеют следующие: в какой стадии ОРДС начато лечение и насколько оно эффективно, какие еще органы и системы поражены, насколько устранима причина, вызвавшая ОРДС [5]. Большую роль играет и проведение респираторной поддержки, необходимой для обеспечения адекватного газообмена в легких, уменьшения работы дыхания, расправления спавшихся альвеол и поддержания нестабильных альвеол в раскрытом состоянии во время выдоха [5, 20, 25, 27].
Использование ВПО на начальных этапах лечения ОРДС
Возможность применения ВПО как стартовой терапии гипоксемической дыхательной недостаточности, в том числе ОРДС, активно обсуждается в медицинской литературе последних лет [28—30].
Однако стоит учитывать, что нарушение сознания, полиорганная недостаточность и шок являются противопоказаниями к использованию данного метода. Кроме того, одна из опасностей использования ВПО на начальных этапах лечения гипоксемической дыхательной недостаточности заключается в возможной задержке необходимой интубации трахеи, что, в свою очередь, может ухудшить результат лечения больного [29]. Наличие четких критериев для начала ИВЛ облегчает принятие такого решения.
Следует также иметь в виду, что, если в течение первого часа от начала ВПО у пациента с гипоксемической дыхательной недостаточностью не отмечено существенного клинического улучшения, риск дальнейшей неэффективности подобного лечения становится очень высоким [30]. В качестве факторов риска неэффективности ВПО при ОРДС отмечены отсутствие улучшения оксигенации, сохраняющееся тахипноэ, а также участие вспомогательной мускулатуры в акте дыхания [30]. В числе нереспираторных предикторов неудачного проведения ВПО, как правило, выделяют потребность в вазопрессорах, тахикардию, тяжесть исходного заболевания, а также полиорганную недостаточность [27—29]. Кроме того, ВПО становится неэффективной при большом объеме плеврального выпота, когда приоритетом в лечении дыхательной недостаточности становится плевральная пункция [31].
Имеющиеся на данный момент исследования относительно эффективности ВПО при гипоксемической дыхательной недостаточности противоречивы. Так, J. Frat и соавт. в своем многоцентровом исследовании, в которое включены преимущественно пациенты с пневмонией, показали, что ВПО не снижает риск интубации по сравнению с традиционной оксигенотерапией и НИВЛ (38, 47 и 50% соответственно, р=0,18) [24]. Это может объясняться ограниченными возможностями мобилизации альвеол у этой категории больных и отсутствием у них выраженных нарушений механики дыхания. Тем не менее в подгруппе пациентов с PaO2/FiO2, равном или менее 200 мм рт.ст., частота интубации трахеи и количество дней без ИВЛ к 28-м суткам исследования были статистически значимо ниже на фоне ВПО. Кроме того, ВПО сопровождалась большим комфортом, снижением выраженности дыхательной недостаточности и уменьшением тахипноэ по сравнению с НИВЛ и традиционной оксигенотерапией [24].
Анализируя результаты последних cтатей и обзоров, можно отметить, что применение ВПО у пациентов с дыхательной недостаточностью различного генеза снижает частоту интубации по сравнению со стандартной кислородотерапией и НИВЛ, не влияя при этом на длительность пребывания в ОИТ и летальность [29—32]. Так, использование ВПО снижает частоту интубации только по сравнению с традиционной оксигенотерапией, при этом степень комфорта пациентов при ВПО выше, чем при традиционной кислородотерапии и при НИВЛ [29]. Интересно отметить, что даже в тех исследованиях, в которых на фоне применения ВПО не получено статистически значимого снижения частоты интубации трахеи, авторы отмечают безопасность ВПО. Так, R. Parke и соавт. показали, что подавляющее большинство пациентов из группы ВПО хорошо переносили эту методику [22].
В настоящее время нет однозначного мнения относительно оптимального алгоритма выбора первичных настроек ВПО и последующей их коррекции у больных с дыхательной недостаточностью различного генеза. Рабочий алгоритм коррекции гипоксемии с использованием ВПО представлен на рис. 2. 
Как указано выше, аппараты для ВПО имеют простой и информативный интерфейс, при этом врач при проведении ВПО корректирует только три параметра: температуру, скорость потока и фракцию вдыхаемого кислорода (рис. 3). 
На данный момент нет четких рекомендаций по выбору температуры для согревания кислородно-воздушной смеси. В то же время показано, что применение более низкой температуры (31—34 °С) ассоциируется с большим комфортом для пациентов с ОРДС по сравнению с температурой 37 °C [33]. В любом случае подбор температуры носит строго индивидуальный характер, с учетом ощущений конкретного пациента.
Что касается устанавливаемой скорости потока, продемонстрировано, что в подгруппе пациентов с выраженной дыхательной недостаточностью больные лучше переносили максимальный поток 60 л/мин, при этом пациенты с ОРДС легкой степени не испытывали дискомфорта и при более низком потоке [33].
Таким образом, при ОРДС легкой степени тяжести допустимо начинать ВПО со скорости потока 20—30 л/мин с последующим увеличением последней в зависимости от показателей газообмена и состояния больного. В то же время у пациентов с более выраженной гипоксемией, вероятно, стоит начинать процедуру с более высоких цифр потока (50—60 л/мин) для развития максимального эффекта ПДКВ [34].
При выборе оптимальной фракции вдыхаемого кислорода у пациентов с ОРДС необходимо учитывать потенциальный вред от применения высокой концентрации кислорода, при этом следует подбирать минимальные значения, необходимые для достижения уровня SpO2 92—97% [27, 35]. Адекватной оксигенации следует добиваться прежде всего за счет увеличения скорости потока, а не фракции вдыхаемого кислорода. Подбор этих двух переменных должен строиться на принципах подбора ПДКВ и FiO2, описанных в рамках концепции респираторной поддержки у пациентов с ОРДС [5, 7, 27].
Ключевые принципы отлучения от ВПО аналогичны таковым при прекращении ИВЛ и подразумевают снижение FiO2 в условиях комплексного мониторинга оксигенации, постепенное снижение скорости потока кислородно-воздушной смеси на 5 л/мин каждые 6—8 часов; переход на традиционную кислородотерапию или спонтанное дыхание при скорости потока, равной или менее 20 л/мин, и FiO2менее 0,4 при адекватных показателях газообмена и в отсутствие признаков нарастания дыхательной недостаточности (см. рис. 2) [29].
Использование ВПО в ходе индукции анестезии у пациентов с ОРДС
В случае неэффективности стартовой консервативной терапии пациентам с ОРДС требуется обеспечение инвазивной вентиляции легких, при этом одним из критических моментов может стать сам процесс интубации трахеи с обеспечением седации и миорелаксации [36—40]. В этом плане перспективным видится направление по использованию ВПО на этапе преоксигенации. За счет поддержания высокого потока, возможности использования 100% кислорода, а также отсутствия необходимости прекращать оксигенацию во время ларингоскопии риск десатурации может быть минимизирован [41].
В настоящее время лишь в нескольких исследованиях проведено сравнение эффективности преоксигенации при помощи ВПО и лицевой маски у пациентов с гипоксемической дыхательной недостаточностью. Так, в исследовании М. Simon и соавт. у пациентов группы традиционной преоксигенации через минуту после индукции анестезии при переводе на ИВЛ у больных с гипоксемией наблюдалась более выраженная десатурация, чем у пациентов группы ВПО, у которых период ларингоскопии и интубации прошел без выраженного снижения уровня SpO2 [40].
В то же время ряд авторов уже продемонстрировали эффективность ВПО для преоксигенации у пациентов с интактными легкими. Так, А. Patel и S. Nourei показали, что преоксигенация при помощи ВПО позволяла избежать снижения уровня SpO2 менее 90%, несмотря на апноэ средней продолжительностью 17 мин [42]. Кроме того, применение ВПО во время экстренной интубации у пациентов ОИТ без признаков значимой гипоксемии (PaO2/FiO2 более 200 мм рт.ст.) ассоциируется с меньшей частотой десатурации (менее 90%), а также с меньшей частотой осложнений в ходе выполнения интубации трахеи [29].
Применение ВПО в период прекращения ИВЛ при ОРДС
Этап прекращения респираторной поддержки остается одним из ключевых аспектов ведения пациентов с ОРДС. Несмотря на улучшение состояния пациента и разрешающуюся дыхательную недостаточность, на этом этапе возможно развитие эпизодов гипоксемии и/или гиперкапнии, не менее клинически значимых, чем при манифестации ОРДС. В этих обстоятельствах нередко возникает потребность в реинтубации трахеи и продолжении инвазивной ИВЛ, особенно у пациентов высокого риска. Потребность в реинтубации остается серьезной проблемой отлучения от ИВЛ, встречающейся в 10—20% случаев ОРДС [43], и ассоциируется с ростом количества осложнений и повышением летальности (до 50% при необходимости реинтубации) [36]. В связи с этим, как показано в недавних исследованиях развития гипоксемической дыхательной недостаточности, в том числе у послеоперационных больных, необходимость поддержания адекватного газообмена после прекращения ИВЛ на фоне сохраняющейся гипергидратации легких требует дальнейшего поиска мер терапии, включая использование ВПО [30, 44].
В последнее время опубликован ряд работ, посвященных методам респираторной поддержки в постэкстубационном периоде. К таким методам относятся ВПО, НИВЛ и традиционная оксигенотерапия [34]. В недавнем рандомизированном исследовании G. Hernаndez и соавт. продемонстрировали, что применение ВПО по сравнению с традиционной оксигенотерапией способно снизить риск повторного перевода на ИВЛ у пациентов с клиникой дыхательной недостаточности в постэкстубационном периоде (4,9% по сравнению с 12,2%, р=0,004) [13].
Данное исследование включало широкий спектр пациентов с преобладанием больных хирургического профиля, с низким риском развития постэкстубационной острой дыхательной недостаточности. Более того, доля пациентов с ОРДС в этой работе невелика, что указывает на необходимость проведения дальнейших исследований. Эти же авторы оценили эффект ВПО по сравнению с НИВЛ у пациентов высокого риска в постэкстубационном периоде, показав схожее влияние обеих методик на частоту реинтубации при меньшем количестве осложнений, связанных с применением ВПО [45]. При этом одной из причин более выраженной гипоксемии у больных группы НИВЛ было раннее прекращение сеансов респираторной поддержки на фоне нарастающего дискомфорта у пациента [45].
S. Maggiore и соавт. в своем двуцентровом исследовании с участием пациентов смешанного профиля показали, что превентивное использование ВПО в раннем постэкстубационном периоде у больных с PaO2/FiO2 менее 300 мм рт.ст., находившихся на ИВЛ не менее 24 часов, сопровождается улучшением оксигенации, уменьшением дискомфорта, а также снижением частоты реинтубации по сравнению с применением кислородной маски с клапаном Вентури [46]. Следует отметить, что в эту работу включены преимущественно пациенты с пневмонией и с травмой, что указывает на необходимость проведения дальнейших исследований у больных с ОРДС.
После принятия решения о прекращении ИВЛ и экстубации целесообразно начинать ВПО с достаточно высокой скоростью потока газовой смеси (50—60 л/мин) с учетом индивидуальной переносимости. Фракция вдыхаемого кислорода также подбирается индивидуально для достижения адекватной оксигенации. При стабильном состоянии пациента показано постепенное снижение фракции вдыхаемого кислорода с последующим поэтапным снижением скорости потока кислородно-воздушной смеси (пошагово по 3—5 л/мин в течение 2—4 часов). В отсутствие признаков нарастания дыхательной недостаточности, а также при фракции вдыхаемого кислорода менее 40% и скорости потока не более 15—20 л/мин возможно прекращение ВПО [29].
Отсутствие эффекта от ВПО в раннем постэкстубационном периоде, как правило, является показанием для реинтубации и продолжения ИВЛ. Критерии повторного перевода на ИВЛ пациентов, получающих ВПО, не отличаются от стандартных. К ним относятся развитие тахипноэ, участие в акте дыхания вспомогательной мускулатуры, неспособность самостоятельно откашливать трахеальный секрет, уровень SpO2 менее 90%, а также нестабильность гемодинамики и ухудшение неврологического статуса [47].
Важным вопросом является и прекращение респираторной поддержки у пациентов с трахеостомой. Несмотря на снижение работы дыхания, риск инфекционных осложнений и невозможность в полной мере самостоятельно санировать мокроту усложняют их перевод на спонтанное дыхание.
Применение ВПО как переходного этапа между ИВЛ и спонтанным дыханием имеет определенные клинические перспективы, однако информация на эту тему ограничена и носит противоречивый характер.
Так, L. Corley и соавт., сравнивая эффекты высокопоточной и низкопоточной оксигенации у пациентов с трахеостомой и осложненным течением послеоперационного периода в кардиохирургии, отметили улучшение PaO2/FiO2 на фоне применения ВПО и связали это с возможностями более точного дозирования фракции вдыхаемого кислорода [19].
Напротив, Т. Stripoli и соавт. показали, что применение ВПО у больных с трахеостомой не имело существенных преимуществ по сравнению с традиционной кислородотерапией на этапе отлучения от респиратора [48]. Согласно данной работе, применение ВПО не сопровождалось улучшением нейрореспираторного драйва, снижением работы дыхания, а также улучшением газообмена по сравнению с пациентами контрольной группы.
Снижение преимуществ ВПО при дыхании через трахеостому может объясняться устранением одного из благоприятных эффектов методики при этом способе ее проведения — улучшения элиминации CO2 за счет вентиляции назофарингеального мертвого пространства. Ранее показано, что наличие трахеостомы само по себе позволяет снизить нейрореспираторный драйв на 30% за счет снижения сопротивления в дыхательных путях и анатомического мертвого пространства [49].
Заключение
Учитывая физиологические предпосылки, а также результаты клинических исследований, можно заключить, что высокопоточная оксигенация через назальные канюли претендует на место важного компонента респираторной поддержки пациентов с легким и умеренным острым респираторным дистресс-синдромом. Применение этой методики обосновано не только на начальных этапах ведения пациентов с острым респираторным дистресс-синдромом, но и на стадии прекращения искусственной вентиляции легких. Требуется проведение дальнейших крупных многоцентровых исследований по применению высокопоточной оксигенации.
Финансирование. Грант Президента Р.Ф. НШ—3927.2018.7.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Источник