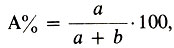Что значит сантинормальный раствор
Концентрация растворов
Концентрацией раствора называется количество (масса или объем) растворенного вещества, содержащееся в определенном количестве (массе или объеме) раствора или растворителя. Ее выражают различными способами. В химии наиболее часто применяются следующие способы:
1. Процентная концентрация по массе — это отношение массы растворенного вещества к массе всего раствора, умноженное на 100. Если раствор состоит из компонентов А и В, то процент компонента А вычисляется по формуле:
где а и b — массовые количества каждого компонента раствора. Например, 5%-ный раствор гидроксида натрия содержит 5 г гидроксида натрия в 100 г раствора, или, что то же самое, 5 г гидроксида натрия приходится на 100 — 5 = 95 г воды. Процентная концентрация — безразмерная величина.
2. Молярная концентрация, или молярность, выражается числом молей растворенного вещества, содержащихся в 1 л раствора. Раствор, в 1 л которого содержится один моль растворенного вещества, называется молярным. Если в 1 л раствора содержится 0,1 моль вещества, то он называется децимолярным, 0,01 моль-сантимолярным, 0,001 моль-миллимолярным. Размерность молярной концентрации-моль/л.
Молярность раствора обычно обозначается буквой М. Например, 1 М NaOH — молярный раствор гидроксида натрия, 1 л такого раствора содержит 40 г NaOH; 0,01 М NaOH — сантимолярный раствор, 1 л его содержит 0,01 моль, т.е. 0,4 г NaOH, и т.д. Чтобы приготовить, например, децимолярный раствор гидроксида натрия, надо взвесить 0,1 моль его, т. е. 4 г внести в литровую мерную колбу, на горлышке которой отмечен объем, точно равный 1 л, добавить воды до полного растворения вещества и затем раствор довести до метки (нижняя часть мениска должна касаться метки) и тщательно перемешать.
3. Моляльная концентрация, или м о-ляльность — это число молей растворенного вещества, содержащихся в 1 кг растворителя. Например, одномоляльный водный раствор серной кислоты состоит из 98 г кислоты и 1 кг воды. Если в 1 кг воды растворено 0,5/моля вещества, то такой раствор называется полумоляльным. Размерность моляльной концентрации — моль/кг. Моляльность обычно обозначается буквой m.
4. Нормальная концентрация, или нормальность, выражается числом эквивалентов вещества, содержащихся в 1 л раствора. Раствор, в 1 л которого содержится один эквивалент (экв) растворенного вещества, называется нормальным. Если в 1 л раствора содержится 0,1 экв вещества, то он называется децинормальным, 0,01 экв-сантинормальным, 0,001 экв-миллинормальным. Нормальность обычно обозначается буквой н. (иногда N).
Так, например, 1 н. H2SO4 — нормальный раствор серной кислоты, 1 л такого раствора содержит 1 экв, т.е. 49 г H2SO4; 0,01 н. NaOH-сантинормальный раствор гидроксида натрия, 1 л его содержит 0,01 экв, т.е. 40/100 = 0,4 г NaOH, и т.д.
Нормальный раствор готовится аналогично молярному.
Источник
Большая Энциклопедия Нефти и Газа
Сантинормальный раствор
Сантинормальный раствор AgNO3 пропускали через сорбент со скоростью 2 мл / мин до проскока ионов Ag в фильтрат. [2]
Что называется нормальным, децинормальным, сантинормальным раствором . [3]
Вычислить количество углекислого натрия Na2CO3, необходимое для приготовления 1 л сантинормального раствора . [4]
Затем раствор нейтрализуют карбонатом лития и добавляют гидроокись лития до получения сантинормального раствора щелочи . Раствор фильтруют через гуммированный рамный фильтрпресс и сливают в гуммированный сборник. Часть хлорида выдается потребителю в виде 40 % — ного раствора, а большая часть перерабатывается на сухую соль. [5]
Величина рН13 соответствует деци ормальному раствору щелочи, а рН12 — сантинормальному раствору щелочи . [6]
Промывка змеевика осуществляется нейтральным конденсатом, и полученный раствор кислоты титруется сантинормальным раствором едкого натра . Температура воды поддерживается в термостате 80 — 90 С. [7]
В [22] промывку змеевика осуществляют нейтральным конденсатом, и полученный раствор кислоты титруется сантинормальным раствором едкого натра . Температура воды поддерживается в термостате 80 — 90 С. [8]
Количество вещества в граммах, содержащееся в 1 мл раствора, называется титром раствора. Приготовляют нормальные, полунормальные, децинормальные, сантинормальные растворы , содержащие соответственно 1, У, ] / 1о, V100 грамм-эквивалента растворенного вещества в литре раствора. [10]
Для этого влить в чистый химический стакан точно 10 мл исследуемого раствора аскорбиновой кислоты, 10 капель 1-процентного раствора крахмала и оттитровать из микробюретки сантинормальным раствором йода в йодистом калии до неисчезающего в течение 10 сек синего окрашивания. [11]
В таком случае на 1 грамм-атом калия, равный 39 граммам, расходовалось бы 6 литров нормального раствора марганцовокислого калия и, обратно, литр его нормального раствора отвечал бы 6 5 г калия. Однако, так как осадок состоит из смеси K2NaCo ( NO2) e и КзСо ( 1 тО2) 6, то количество калия, приходящееся на 1 мл сантинормального раствора КМпО4, несколько больше. [12]
Затем склянку осторожно закрывают пробкой и несколько раз тщательно взбалтывают. Отстоявшийся осадок растворяют прибавлением 2 — 3 мл крепкой серной или соляной кислоты, затем склянку снова взбалтывают, содержимое ее приливают в эрленмен-еровскую колбу, тщательно трижды промытую дестиллированной водой. Выделившийся иод титруется с сантинормальным раствором гипосульфита , титр которого предварительно установлен по точно сантинормальному раствору хромпика илп по титрованному раствору иода. [13]
После пропуска газов прибор отсоединяют от схемы, ставят в вертикальное положение и промывают змеевик и фильтр 200 — 250 мл нейтрального конденсата. Промывку ведут со стороны фильтра под небольшим давлением, для чего можно использовать сжатый воздух или резино вую грушу. Полученный при промывке раствор кислоты титруется по смешанному индикатору сантинормальным раствором едкого натра . [14]
Затем склянку осторожно закрывают пробкой и несколько раз тщательно взбалтывают. Отстоявшийся осадок растворяют прибавлением 2 — 3 мл крепкой серной или соляной кислоты, затем склянку снова взбалтывают, содержимое ее приливают в эрленмен-еровскую колбу, тщательно трижды промытую дестиллированной водой. Выделившийся иод титруется с сантинормальным раствором гипосульфита, титр которого предварительно установлен по точно сантинормальному раствору хромпика илп по титрованному раствору иода. [15]
Источник
Н, 0,ЗН, 0,4Н — децинормальная концентрация. 0,01 Н, 0,02 Н, 0,03 Н, 0,04 Н — сантинормальная концентрация



Лабораторная работа № 14.
Тема: Приготовление раствора точной заданной концентрации.
Содержание типовой задачи деятельности:
Осуществление оперативного регулирования хода производства и обслуживания.
Умения: Используя рациональные способы ведения технологических процессов, учиться готовить растворы различной концентрации, уметь рассчитывать массу вещества, массу раствора, нормальность и титр.
ПФ. С. 17. ПП. Н. 03 ПФ — профессиональная задача;
С — класс задач (стереотипная);
ПП — вид умения (профессионально-предметный)
Н — уровень сформированности умения (умение выполнять действие автоматически).
Материально-техническое обеспечение:
Мерные колбы, титровальные колбы, пипетки Мора, химические реактивы, химические стаканы, воронки, технохимические весы, разновесы, мерный цилиндр.
Техника безопасности:
Во время работы в химической лаборатории необходимо соблюдать осторожность, поддерживать порядок и чистоту на рабочем месте. Не брать реактивы руками, а только металлической или фарфоровой ложечкой или шпателем. Нельзя взятый избыток реактива высыпать или выливать из своей пробирки в общую реактивную склянку. Ни в коем случае нельзя пробовать химические вещества на вкус.
Межпредметная связь:
Неорганическая химия, физическая и коллоидная химия, микробиология и физиология, технология приготовления пищи.
Перечень заданий:
Приготовление растворов различной концентрации в лабораторных условиях.
Решение типовых задач по различным методам объемного анализа.
3. Вопросы для самоконтроля.
Теоретические основы:
В количественном анализе концентрацию растворов выражают нормальностью и титром (Н и Т).
Раствор называется нормальным, если в 1л его содержится 1 грамм-эквивалент растворённого вещества.
Различают растворы различной нормальности 1 Н, 2 Н, 3 Н, 4 Н и т.д. 0,1 Н,
Н, 0,ЗН, 0,4Н — децинормальная концентрация. 0,01 Н, 0,02 Н, 0,03 Н, 0,04 Н — сантинормальная концентрация.
Титр показывает, сколько граммов вещества растворено в 1мл раствора. Между нормальностью и титром существует определенная связь. Так, например:


где Т — титр;
Н — нормальная концентрация;
Источник
2. Концентрация растворов
Концентрацией растворов называется количество растворенного вещества в определенном количестве раствора или растворителя.
Растворы с большой концентрацией растворенного вещества называются концентрированными, с малой – разбавленными.
Различают концентрацию процентную, нормальную, мольно-весовую, мольно-объемную, мольную долю, титр.
Процентная концентрация выражается в % растворенного вещества по отношению ко всему количеству раствора.
Например, 15% раствор хлорида натрия – это такой раствор, в 100г которого содержится 15г NaCl и 85г воды.
Пример. Приготовить 500 мл 0,5% раствора хрома темносинего.
Для приготовления 100 мл 0,5% раствора необходимо взять
0,5г хрома темносинего и довести до 100мл растворителем;
для приготовления 500 мл надо взять Х г
Х=
Т.е. для приготовления 500мл 0,5%раствора необходимо взять 2,5г хрома темносинего и довести до 500 мл растворителем (497,5г растворителя).
Нормальная концентрация (1Н или 1N) выражается числом грамм-эквивалентов растворенного вещества в одном литре раствора.
Пример. Приготовить 10литров 6Н раствора Cu(NO3)2 :
ЭCu(NO3)2=
94 
Децинормальный раствор (0,1Н или 0,1N) – это нормальный раствор, разбавленный в 10 раз, а значит количество вещества взято в 10 раз меньше.
Если на приготовление 1л 1Н раствора пойдет 94г Cu(NO3)2, то на приготовление 1л 0,1Н раствора – 9,4г Cu(NO3)2.
Сантинормальный раствор (0,01Н или 0,01N) – это нормальный раствор, разбавленный в 100 раз, значит количество вещества взято в 100 раз меньше.
Если на приготовление 1л 1Н раствора пойдет 94г Cu(NO3)2, то на приготовление 1л 0,01Н раствора – 0,94г Cu(NO3)2.
Задача. Приготовить 3литра 0,01Н раствора Na2SO4.
1 г-экв Na2SO4=
для приготовления 1 литра 0,01N раствора необходимо 0,71г
для приготовления 3литров – 0,71х3=2,13г Na2SO4
Мольно-объемная или молярная концентрация(М) выражается числом молей растворенного вещества в 1литре раствора.
Мольно-весовая или моляльная концентрация (m) выражается числом молей растворенного вещества, приходящихся на 1000г растворителя
Мольная доля выражается числом г-молекул данного вещества к общему числу г-молекул всех веществ, имеющихся в растворе.
3.Растворимость – способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора.
Поэтому численно растворимость может быть выражена теми же способами, что и концентрация, например, в процентах растворенного вещества.
Часто растворимость выражается числом весовых частей безводного вещества, насыщающих при данных условиях 100 весовых частей растворителя. Выраженную таким образом растворимость называют коэффициентом растворимости.
Растворимость различных веществ в воде колеблется в широких пределах. Если в 100г воды растворяется более 10г вещества, то это вещество принято называть хорошо растворимым; если растворяется менее 1г вещества – малорастворимым; и практически нерастворимым, если в раствор переходит менее 0,01г вещества.
Растворение большинства твердых тел сопровождается поглощением теплоты. (Реакции, протекающие с выделением энергии называются экзотермическими, с поглощением – эндотермическими).
Это объясняется затратой значительного количества энергии на разрушение кристаллической решетки твердого тела. Поэтому, как правило, повышение температуры должно приводить к увеличению растворимости твердых тел.
Например, растворимость натриевых солей (NaCl, Na2SO4, Na2CO3, Na3PO4) в пределах температур до 200˚С с ростом температуры увеличивается.
К трудно растворимым веществам можно отнести карбонат кальция CaCO3, сульфат CaSO4, силикат CaSiO3, фосфат Ca3(PO4)2, гидроокись магния Mg(OH)2 и др. Их растворимость с повышением температуры уменьшается.
Растворимость газов в воде представляет собой экзотермический процесс. Поэтому растворимость газов с повышением температуры уменьшается.
Если оставить в теплом помещении стакан с холодной водой, то внутренние стенки его покрываются пузырьками газа – это воздух, который был растворен в воде, выделяется из нее вследствие нагревания. Кипячением можно удалить из воды весь растворенный в ней воздух (поэтому кипяченая вода имеет иной вкус, чем сырая).
Но иногда растворение газов в органических жидкостях сопровождается поглощением теплоты, в этих случаях с ростом температуры растворимость газов увеличивается.
Растворимость газов в воде подчиняется закону Генри-Дальтона: растворимость газа в воде прямо пропорциональна давлению газа над водой.
С повышением температуры воды над ней увеличивается количество пара. При кипении воды над ней находится один водяной пар. Кислорода и углекислого газа над водой почти нет, давление их над водой равно нулю, а значит и растворимость их в воде равна нулю. (Кислород О2 и углекислый газ СО2 при кипении удаляются из воды).
Источник