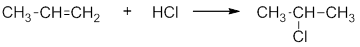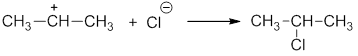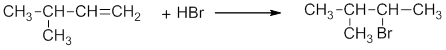- Механизмы реакций в органической химии
- Механизмы разрыва химических связей в органических реакциях
- Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
- Содержание:
- Ионный механизм
- Правило Владимира Васильевича Марковникова
- Радикальный механизм
- 1.4.10 Ионный и радикальный механизмы реакций в органической химии
- Что значит реакции по ионному механизму
- Ионный механизм реакции. Правило Марковникова
Механизмы реакций в органической химии
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии.
Механизмы разрыва химических связей в органических реакциях
| Гомолитический разрыв связи – это такой разрыв химической связи, когда каждый атом получает при разрыве связи по одному электрону из общей электронной пары. |
Образующиеся при этом частицы — это свободные радикалы.
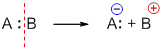
| Свободные радикалы – это частицы, каждая из которых содержит один неспаренный электрон. A:B → A∙ + ∙B Гомолитический разрыв связи характерен для слабо полярных или неполярных связей. Условия протекания радикальных реакций:
Например , взаимодействие метана с хлором протекает по цепному радикальному механизму. То есть реакция протекает как цепь последовательных превращений с участием свободных радикалов. Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат один или несколько неспаренных электронов. Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом. Этапы радикально-цепного процесса: Стадия 1. Инициирование цепи. Под действием кванта света или при нагревании молекула галогена распадается на радикалы: Cl:Cl → Cl⋅ + ⋅Cl Стадия 2. Развитие цепи. Радикалы взаимодействуют с молекулами с образованием новых молекул и радикалов. Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород. При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с молекулой хлора: CH4 + ⋅Cl → CH3⋅ + HCl Стадия 3. Обрыв цепи. При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами. При этом образуются молекулы, т.е. радикальный процесс обрывается. Могут столкнуться разные радикалы, в том числе два метильных радикала:
При гетеролитическом разрыве связи образуются ионы – положительно заряженный катион и отрицательно заряженный анион. A:B → A: – + B +
Гетеролитический (ионный) механизм характерен для полярных и легко поляризуемых связей. Условия протекания ионных реакций:
Присоединение галогеноводородов (гидрогалогенирование). Например, этилен взаимодействует с бромоводородом: Реакция протекают по механизму электрофильного присоединения в несколько стадий. I стадия. Электрофилом является протон Н + в составе бромоводорода. Катион водорода присоединяется к атому углерода при двойной связи и образуется карбокатион . На втором атоме углерода, который потерял электроны π-связи, образуется положительный заряд: II стадия. Карбокатион взаимодействует с анионом Br – : При присоединении галогеноводородов и других полярных молекул к симметричным алкенам образуется одно вещество. Например , при присоединении бромоводорода к этилену образуется только бромэтан. При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Например , при взаимодействии хлороводорода HCl с пропиленом атом водорода присоединяется преимущественно к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. При этом 1-хлорпропан образуется в незначительном количестве: В некоторых случаях присоединение к двойным связям происходит против правила Марковникова. Исключения из правила Марковникова: 1) Если в молекуле присутствует заместитель, который оттягивает на себя электронную плотность двойной связи. Например , при взаимодействии 3-хлорпропена с хлороводородом HCl преимущественно образуется 1,3-дихлорпропан. Атом хлора смещает к себе электронную плотность, поэтому π-электронная плотность двойной связи смещена к менее гидрогенизированному атому углерода: 2) Если в реакционной системе присутствуют свободные радикалы или источники свободных радикалов, то реакция присоединения полярных молекул вида НХ к двойной связи протекает по радикальному механизму против правила Марковникова. Например , при присоединении бромоводорода к пропилену в присутствии пероксидов (H2O2 или R2O2) преимущественно образуется 1-бромпропан: Источник Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химииСодержание:Органическая химия вызывает страх при виде формул из этого раздела, но давайте перестанем бояться и углубимся в изучение взаимодействия веществ. Что же из себя представляют механизмы реакций? Ионный механизмПроисходит разрыв связи, во время которого, общая пара электронов остается у одного атома, что приводит к возникновению заряженных частиц — ионов (катионов и анионов). Будучи гетероциклическим, этот разрыв возможен при ковалентной связи. В ходе получаются:
Типичными представителями ионных реакций отмечают взаимодействия электролитов в растворах, которые знакомы нам с первых шагов познания неорганической химии, реакции присоединения к непредельным углеводородам, дегидрирование спиртов и замещение гидроксильной группы в спиртах. Правило Владимира Васильевича МарковниковаФормулировка гласит следующим образом: при присоединении протонных кислот или воды к несимметричным алкенам или алкинам, атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Проще говоря, атом водорода присоединяется к тому атому углерода, у которого наименьшее количество связей с водородом, рассмотрим это заключение на примере гидрогалогенирования пропена: Но также существуют и исключения из этого правила, когда заместитель при двойной связи оттягивает электронную плотность на себя или при присоединении в присутствии пероксидов Радикальный механизмПроисходит деление общей пары электронов между атомами, приводя к образованию нейтрально заряженных частиц (радикалов), которые имеют неспаренные электроны. Будучи гомолитическим, такой разрыв возможен при малополярной ковалентной связи. Реакции, проходящие по этому механизму, происходят в газовой фазе с огромной скоростью, зачастую сопровождаясь взрывом. Сами радикальные взаимодействия возникают между образовавшимися в ходе взаимодействия нейтрально заряженными частицами и молекулами. Весьма немалое количество органических реакций протекают по радикальному механизму, например: галогенирование алканов, полимеризация этилена и синтез аммиака. Источник 1.4.10 Ионный и радикальный механизмы реакций в органической химииВидеоурок: Классификация реакций: ионные и радикальные реакции Лекция: Ионный и радикальный механизмы реакций в органической химии На предыдущих уроках мы рассматривали различные типы неорганических реакций, классифицируемых по тепловому эффекту, обратимости, изменению степени окисления и др. На данном уроке пойдет речь о типах органических химических реакций, которые классифицируются по механизму разрыва существующих химических связей и образования новых. Выделяют радикальный и ионный механизмы реакций. Если общая электронная пара делится между атомами, образуются радикалы – нейтральные частицы, имеющие неспаренные электроны. Такой разрыв возможен при неполярной или малополярной ковалентной связи, называется радикальным и является гомолитическим: Химические реакции с участием радикалов происходят в газовой фазе при большой скорости. Чаще всего со взрывом. Радикальные реакции проходят между появившимися в ходе реакции радикалами и молекулами. Такие реакции называются цепными. Инициация галогенирования, обычно, происходит под действием облучения: R∙ + Cl-Cl → Cl∙ + R-Cl Радикальными являются большое количество реакций горения органических и неорганических веществ. Сюда можно отнести: синтез воды, аммиака, полимеризацию этилена. Если при разрыве связи общая электронная пара остается у одного атома образуются ионы (катионы и анионы). Такой разрыв возможен при полярной ковалентной связи, называется ионным и является гетероциклическим: В результате такого разрыва образовались:
Ионными являются реакции электролитов в растворе (неорганическая химия). А из органической химии – реакции присоединения к алкенам, окисление, дегидрирование спиртов, замещение спиртовой группы. Возник вопрос по теме? Задавайте его репетитору по химии 👉 Джапарову Тамерлану Источник Что значит реакции по ионному механизму
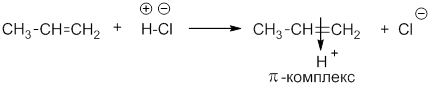
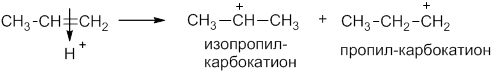
Химия1.5.0. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии Ионный механизм реакции. Правило МарковниковаМеханизмом реакции называют детальное описание химической реакции, которое включает элементарные стадии. При протекании химических реакций в молекулах органических соединений происходит разрыв ковалентных связей. Разрыв ковалентной связи может происходить по гетеролитическому (ионному) или гомолитическому (радикальному) механизмам. В зависимости от этого механизм реакции бывает ионный или радикальный. Ионный разрыв или гетеролиз приводит к образованию катиона и аниона. При этом общая электронная пара остается у одного из образующихся фрагментов: Если заряды в таких частицах находятся на атоме углерода, их называют – карбокатионы и карбанионы, например: Примером ионной реакции может служить присоединение галогеноводородов к алкенам. Рассмотрим реакцию пропилена с хлороводородом: Механизм реакции электрофильного присоединения HCl к алкену На первой стадии происходит распад молекулы хлороводорода на ионы и протон (катион водорода) атакует место повышенной электронной плотности – π-связь пропена. При этом образуется промежуточный π-комплекс: Катион водорода вытягивает электронную пару π-связи и образует ковалентную связь с одним из атомов углерода. Из пропилена может образоваться два катиона: изопропил-карбокатион и пропил-карбокатион: Изопропил-катион более стабилен, чем пропил-катион, благодаря положительному индукционному эффекту двух метильных групп. Далее более устойчивый катион (более долгоживущий) присоединяет анион галогена: Таким образом, основным продуктом реакции является 2-хлорпропан. В 1986 году В.В.Марковников сформулировал правило: при ионном присоединении кислоты к двойной углерод-углеродной связи алкена, водород присоединяется к атому углерода, который имеет большее число атомов водорода (который более гидрогенизирован): Более точно правило Марковникова можно сформулировать так: присоединение протона к алкену происходит с образованием наиболее стабильного карбокатиона. Источник |






 Радикальный механизм
Радикальный механизм