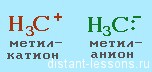- Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
- Содержание:
- Ионный механизм
- Правило Владимира Васильевича Марковникова
- Радикальный механизм
- Механизмы реакций в органической химии
- Механизмы разрыва химических связей в органических реакциях
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Ионный и радикальный механизмы химических реакций органической химии
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
Содержание:
Органическая химия вызывает страх при виде формул из этого раздела, но давайте перестанем бояться и углубимся в изучение взаимодействия веществ.
Что же из себя представляют механизмы реакций?
Это детальное разъяснение процесса перехода субстрата в продукт. В органике выделяются два типа механизмов химических реакций, ионный и радикальный.
Ионный механизм
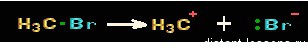
Происходит разрыв связи, во время которого, общая пара электронов остается у одного атома, что приводит к возникновению заряженных частиц — ионов (катионов и анионов). Будучи гетероциклическим, этот разрыв возможен при ковалентной связи.
В ходе получаются:
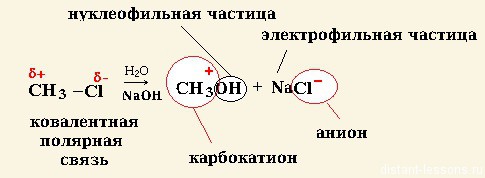
- Нуклеофил – обладающая парой электронов на своем внешнем энергетическом уровне частица, которая образует новые ковалентные связи. Примерами могут послужить: SCN — ,Br — , CN — , Cl — ,I — , OH — и другие анионы и соединения с неподеленной электронной парой.
- Электрофил – обладающая незаполненной на внешнем энергетическом уровне электронную орбиталь частица, являющаяся электронным акцептором. Например: H3O + , CH3CO + , AlCl3,BF3, катионы, карбокатионы, электронодефицитные нейтральные молекулы, а так же молекулы с сильнополяризованной связью.
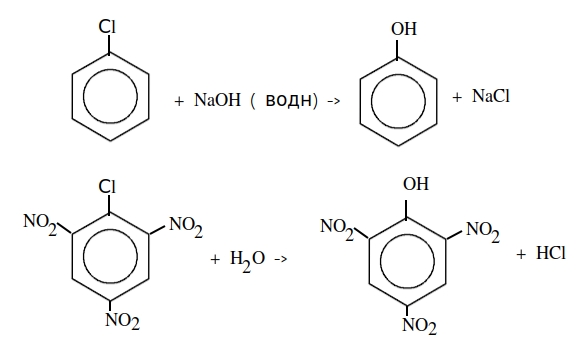
Типичными представителями ионных реакций отмечают взаимодействия электролитов в растворах, которые знакомы нам с первых шагов познания неорганической химии, реакции присоединения к непредельным углеводородам, дегидрирование спиртов и замещение гидроксильной группы в спиртах.
Правило Владимира Васильевича Марковникова
Формулировка гласит следующим образом: при присоединении протонных кислот или воды к несимметричным алкенам или алкинам, атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Проще говоря, атом водорода присоединяется к тому атому углерода, у которого наименьшее количество связей с водородом, рассмотрим это заключение на примере гидрогалогенирования пропена:
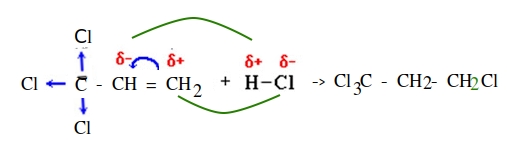
Но также существуют и исключения из этого правила, когда заместитель при двойной связи оттягивает электронную плотность на себя
или при присоединении в присутствии пероксидов
Радикальный механизм
Происходит деление общей пары электронов между атомами, приводя к образованию нейтрально заряженных частиц (радикалов), которые имеют неспаренные электроны. Будучи гомолитическим, такой разрыв возможен при малополярной ковалентной связи.
Реакции, проходящие по этому механизму, происходят в газовой фазе с огромной скоростью, зачастую сопровождаясь взрывом. Сами радикальные взаимодействия возникают между образовавшимися в ходе взаимодействия нейтрально заряженными частицами и молекулами.
Весьма немалое количество органических реакций протекают по радикальному механизму, например: галогенирование алканов, полимеризация этилена и синтез аммиака.
Источник
Механизмы реакций в органической химии
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии.
Механизмы разрыва химических связей в органических реакциях
| Гомолитический разрыв связи – это такой разрыв химической связи, когда каждый атом получает при разрыве связи по одному электрону из общей электронной пары. |
Образующиеся при этом частицы — это свободные радикалы.
| Свободные радикалы – это частицы, каждая из которых содержит один неспаренный электрон. A:B → A∙ + ∙B Гомолитический разрыв связи характерен для слабо полярных или неполярных связей. Условия протекания радикальных реакций:
Например , взаимодействие метана с хлором протекает по цепному радикальному механизму. То есть реакция протекает как цепь последовательных превращений с участием свободных радикалов. Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат один или несколько неспаренных электронов. Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом. Этапы радикально-цепного процесса: Стадия 1. Инициирование цепи. Под действием кванта света или при нагревании молекула галогена распадается на радикалы: Cl:Cl → Cl⋅ + ⋅Cl Стадия 2. Развитие цепи. Радикалы взаимодействуют с молекулами с образованием новых молекул и радикалов. Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород. При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с молекулой хлора: CH4 + ⋅Cl → CH3⋅ + HCl Стадия 3. Обрыв цепи. При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами. При этом образуются молекулы, т.е. радикальный процесс обрывается. Могут столкнуться разные радикалы, в том числе два метильных радикала:
При гетеролитическом разрыве связи образуются ионы – положительно заряженный катион и отрицательно заряженный анион. A:B → A: – + B +
Гетеролитический (ионный) механизм характерен для полярных и легко поляризуемых связей. Условия протекания ионных реакций:
Присоединение галогеноводородов (гидрогалогенирование). Например, этилен взаимодействует с бромоводородом: Реакция протекают по механизму электрофильного присоединения в несколько стадий. I стадия. Электрофилом является протон Н + в составе бромоводорода. Катион водорода присоединяется к атому углерода при двойной связи и образуется карбокатион . На втором атоме углерода, который потерял электроны π-связи, образуется положительный заряд: II стадия. Карбокатион взаимодействует с анионом Br – : При присоединении галогеноводородов и других полярных молекул к симметричным алкенам образуется одно вещество. Например , при присоединении бромоводорода к этилену образуется только бромэтан. При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Например , при взаимодействии хлороводорода HCl с пропиленом атом водорода присоединяется преимущественно к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. При этом 1-хлорпропан образуется в незначительном количестве: В некоторых случаях присоединение к двойным связям происходит против правила Марковникова. Исключения из правила Марковникова: 1) Если в молекуле присутствует заместитель, который оттягивает на себя электронную плотность двойной связи. Например , при взаимодействии 3-хлорпропена с хлороводородом HCl преимущественно образуется 1,3-дихлорпропан. Атом хлора смещает к себе электронную плотность, поэтому π-электронная плотность двойной связи смещена к менее гидрогенизированному атому углерода: 2) Если в реакционной системе присутствуют свободные радикалы или источники свободных радикалов, то реакция присоединения полярных молекул вида НХ к двойной связи протекает по радикальному механизму против правила Марковникова. Например , при присоединении бромоводорода к пропилену в присутствии пероксидов (H2O2 или R2O2) преимущественно образуется 1-бромпропан: Источник Химия, Биология, подготовка к ГИА и ЕГЭИонный и радикальный механизмы | H 2 C=O + HCN -> H2C (CN)(OH) HС≡CH + H2O -> ( Hg 2+ )-> Электрофильные реакции — органическое вещество реагирует с электрофильным реагентом S E Ar — substitution electrophilic reaction Ad E — addition electrophilic reaction | |||
| У аренов: ( образуется промежуточная частица NO 2 + ) C6H6 + CH 3Cl -> C6H5CH 3 + HCl |