Что значит остатки хориальной ткани
а) Лучевая диагностика:
1. Общие сведения:
• Самый четкий диагностический критерий:
о Длительно существующий очаговый выступ поверхности хориона внутрь плодного яйца
• Размер:
о По данным литературы, максимальный диаметр составляет 0,5-3,8 см, объем — 0,04-11,2 мл
о Исход не зависит от размеров
• Морфология:
о Является продолжением поверхности хориальной пластинки
о Края образуют острые углы с поверхностью хориальной пластинки
2. УЗИ при хориальном выпячивании:
• УЗИ в режиме серой шкалы:
о Очаговое выпячивание хориона:
— Эхогенность обычно соответствует эхогенности хориона:
Центральная гипоэхогенная зона в 20% случаев
— В 27% случаев при исследовании в режиме реального времени в центральной зоне виден слабый вихревой эхосигнал
— При допплерографии кровоток не определяется
— Образование стабильно сохраняется в течение всего исследования
о Обычно одиночное, хотя может быть множественным
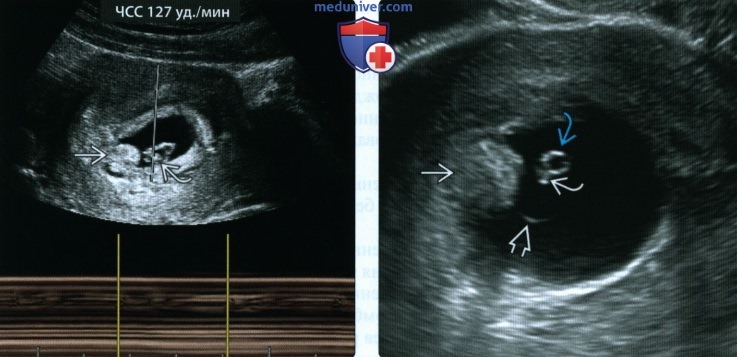
(Справа) При ТВУЗИ видны хориальное выпячивание и эмбрион, размеры которого намного меньше ожидаемых по дате менструации. Подобная ситуация регистрировалась и при более раннем исследовании. Эмбрион окружен расширенным амнионом. Желточный мешок без патологических изменений. Констатирована неразвивающаяся беременность в I триместре с мертвым эмбрионом.
б) Дифференциальная диагностика хориального выпячивания:
1. Неразвивающаяся беременность в I триместре:
• Контур плодного яйца может быть уплощенным или неправильным:
о При хориальном выпячивании плодное яйцо округлое • или овальное
• В случае гибели эмбриона мертвый эмбрион находится внутри амниона, не соприкасаясь с хорионом
2. Аномалия желточного мешка:
• Виден снаружи амниона, в экстраэмбриональной целомической полости, не соприкасается с хорионом
• Желточный мешок дает более отчетливый линейный эхо-сигнал
3. Ретрохориальная гематома:
• Локализуется в децидуальной оболочке или в цитотрофобласте:
о Венозное кровотечение характеризуется низким давлением → гематома серповидной или овальной формы около хориона со стороны миометрия
о Гипоэхогенная
о Хориальное выпячивание округлое, его эхогенность часто соответствует эхогенности хориона
в) Патологоанатомические особенности. Общие сведения:
• Наличие очага округлой формы вероятнее связано с артериальным, а не с венозным кровотечением
• Предполагают, что хориальное выпячивание представляет собой артериальную гематому, возникающую из формирующегося межворсинчатого пространства или хориальной пластинки
(Справа) При ТВУЗИ у пациентки с кровотечением из половых путей видны множественные хориальные выпячивания с гипоэхогенными центрами. Этот случай завершился полным самопроизвольным выкидышем.
г) Клинические особенности:
1. Клиническая картина:
• Наиболее частые субъективные и объективные симптомы:
о Нередко имеет бессимптомное течение
о Может проявляться кровотечением из половых путей
2. Демографические особенности:
• Эпидемиология:
о В обследованной когорте распространенность составила 0,7%:
— Минимальный гестационный возраст на момент диагностики составлял 6,7 нед.
о В ретроспективном исследовании случай-контроль распространенность была 0,15%
3. Естественное течение и прогноз:
• Частота прерывания беременности в когорте пациенток, у которых использовались ВРТ, составляла 50%:
о При выявлении эмбриона с нормальной ЧСС прогноз был более благоприятным (частота жизнеспособных беременностей составляла 80%)
• В последующих исследованиях получены более благоприятные результаты:
о По данным Sana и соавт., частота рождения живого ребенка составляла 62%, при этом в группе пациенток с хориальным выпячиванием эта частота была примерно в 2 раза ниже таковой в контрольной группе
о По данным Arleo и соавт., выполнивших обзор снимков, сделанных в 1 триместре в одной организации/одним исследователем:
— 52 беременности с хориальным выпячиванием → общая частота рождения живого ребенка — 65%
— 41 беременность с живым эмбрионом при каком-либо из исследований → частота рождения живого ребенка -83%:
— 6 беременностей с плодным яйцом с желточным мешком, но без эмбриона → 4 случая рождения живого ребенка
— 8 беременностей только с плодным яйцом → 2 случая рождения живого ребенка
— 3 беременности с плодным яйцом с желточным мешком и эмбрионом без сердечной деятельности → 0 случаев рождения живого ребенка
— 18 нежизнеспособных беременностей (7 анэмбрионий, 11 случаев ранней гибели)
• В первом исследовании серии случаев все беременности, сопровождавшиеся наличием множественных хориальных выпячиваний, были нежизнеспособными
• По ряду изменений, зафиксированных при динамическом наблюдении, можно предположить наличие очаговой гематомы:
о В случае прогрессирования беременности хориальное выпячивание уменьшается, становится гипоэхогенным, в итоге исчезает
• Увеличивающееся хориальное выпячивание связано с повышенным риском прерывания беременности
4. Лечение хориального выпячивания:
• Специфического лечения не существует
• В случае прерывания беременности следует рассмотреть необходимость исследования тканей:
о Имеется четкая взаимосвязь наличия хориального выпячивания с трофобластической болезнью, в частности с частичным пузырным заносом
д) Особенности диагностики. Важно знать:
• Следует иметь точное представление о признаках нормально протекающей беременности на ранних сроках:
о Следует различать хориальное выпячивание и гибель эмбриона
о Следует отличать хориальное выпячивание от аномалий желточного мешка
е) Список использованной литературы:
1. Arleo ЕК et al: Chorionic bump on first-trimester sonography: not necessarily a poor prognostic indicator for pregnancy. J Ultrasound Med. 34(1): 137—42, 2015
2. Sana Y et al: Clinical significance of first-trimester chorionic bumps: a matched case-control study. Ultrasound Obstet Gynecol. 42(5):585-9, 2013
3. Tan S et al: The chorionic bump: Radiologic and pathologic correlation. J Clin Ultrasound. 39(1):35—7, 2011
4. Harris RD et al: The chorionic bump: a first-trimester pregnancy sonographic finding associated with a guarded prognosis. J Ultrasound Med. 25(6):757-63, 2006
Редактор: Искандер Милевски. Дата обновления публикации: 13.9.2021
Источник
Ведение послеабортного периода при использовании медикаментозного метода прерывания беременности на ранних сроках
- КЛЮЧЕВЫЕ СЛОВА: беременность, аборт, аспирация, Мульти-табс Интенсив
Несмотря на распространение контрацепции, частота абортов в России продолжает оставаться высокой, что обусловливает актуальность задачи совершенствования медицинской помощи при аборте. Очевидна необходимость обеспечения качества и безопасности аборта путем внедрения стандартов необходимого объема помощи, включая эффективное консультирование и информирование, психологическую помощь и поддержку, применение современных технологий безопасного аборта, адекватное обезболивание, контрацепцию и реабилитацию [1].
Обеспечение безопасности абортов может быть достигнуто путем замены травматической процедуры кюретажа на технологии и процедуры, рекомендованные Всемирной организацией здравоохранения, такие как мануальная (ручная) вакуумная аспирация в первом триместре, медикаментозное прерывание беременности с помощью антигестагенов.
Основной критерий в оценке эффективности медикаментозного аборта – отсутствие плодного яйца и его элементов в полости матки по результатам ультразвукового исследования. Однако интерпретация данных ультразвуковой картины М-эха после проведения процедуры медикаментозного аборта иногда вызывает затруднения ввиду полимофизма визуализируемых структур. В этой связи медикаментозное прерывание беременности требует более внимательного и длительного наблюдения, чем хирургический аборт.
Результатом воздействия мифепристона на эндометрий является полная десквамация эндометрия и экспульсия плодного яйца [2, 3]. Распознаваемые продукты зачатия выводятся в течение четырех – шести часов после введения простагландина у 60–70% женщин и в течение 24 часов – у 85% женщин. Приблизительно у 95–96% пациенток полный аборт происходит в течение двух – семи дней после приема простагландина [2, 4, 5].
Эффективность применения мифепристона и мизопростола в первом триместре (до девяти недель) высока и составляет 95–99% [1, 6]. Кроме того, по данным многочисленных зарубежных исследований, снижение дозы мифепристона до 200 мг не влияет на эффективность процедуры [2, 7–9].
Мифепристон, вводимый в сочетании с простагландином, не прерывает беременность у 0,5–1% женщин [1, 3, 6]. Неполный аборт дополняется вакуумной аспирацией. В 0,8–1% случаев эту процедуру необходимо выполнять с целью гемостаза для прекращения сильного кровотечения.
Кровотечение различной интенсивности начинается до приема простагландина у 50–60% женщин, у остальных – в течение первых часов после введения простагландина. По результатам французского многоцентрового исследования сообщается, что длительность кровопотери у 90% женщин составила менее 12 дней, в среднем восемь дней [2]. Большинство женщин отмечают, что это кровотечение более обильное, чем менструация, но лечение, как правило, не требуется.
В ходе многоцентровых исследований во Франции и Великобритании эвакуация содержимого матки с целью прекращения кровотечений была сочтена необходимой в 0,4 и 1% случаев соответственно, а переливание крови выполняли в 0,1 и 1% случаев соответственно. Средняя величина кровопотери составила 74 мл (от 14 до 512 мл), среднее снижение концентрации гемоглобина – 0,3 г/дл [10].
Согласно данным отечественных исследований, частота осложнений, требующих инструментальной ревизии полости матки, не превышает 3–5%. К таким осложнениям относятся продолжающаяся беременность, задержка плодного яйца или его элементов в матке при прервавшейся беременности и кровотечение, интенсивность которого соответствует двум прокладкам «макси» в час на протяжении двух часов.
Оценка эффективности медикаментозного аборта проводится на основании сведений об экспульсии плодного яйца (визуальный контроль врачом или самой пациенткой, если аборт произошел в домашних условиях), бимануального обследования и ультрасонографического исследования, выполненного на 12–14-е сутки после приема препаратов. Проведение ультразвукового исследования ранее указанного срока, что практикуют некоторые российские врачи, нецелесообразно, поскольку полость матки опорожняется постепенно в течение двух недель, а ультрасонографическая картина в этот период отличается полиморфизмом. Так, на фоне расширенного М-эха визуализируются множественные гипо- и гиперэхогенные структуры, что может привести к неправильной интерпретации результатов, гипердиагностике неполного аборта и неоправданной инструментальной ревизии полости матки.
Иллюстрацией к вышеизложенному могут служить следующие примеры. Ультрасонограммы пациенток, представленные на рис. 1 и 2, свидетельствуют об отсутствии плодного яйца в полости матки и доказывают эффективность выполненного медикаментозного аборта. Следует учитывать, что наличие в матке по данным ультрасонографии различных эхонегативных и эхопозитивных структур в любом количестве (рис. 1, 2) не является показанием для выскабливания. Присутствие крови в полости матки после медикаментозного аборта у 30% женщин обусловлено недостаточным влиянием простагландина на сократительную активность миометрия, что было показано в экспериментальных исследованиях.
На основании ультрасонограммы, представленной на рис. 3, необходимо констатировать отсутствие эффекта от выполненного медикаментозного аборта, поскольку произошла задержка плодного яйца в полости матки.
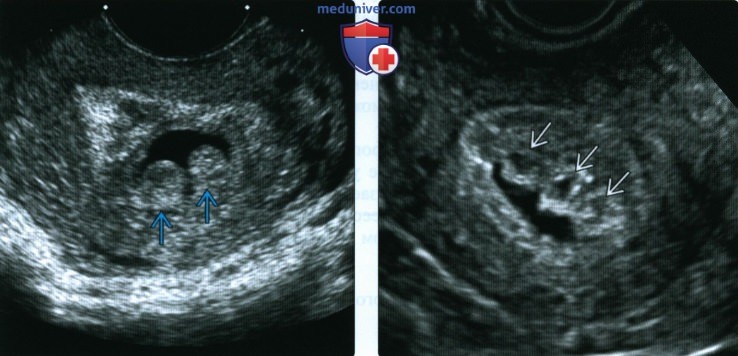
Наличие структур в полости матки, интимно связанных с одной из ее стенок, может свидетельствовать о задержке частей хориальной ткани (рис. 4). Отсутствие выраженного кровотечения или других клинических признаков неполного аборта позволяет врачу выбрать выжидательную тактику с последующим ультразвуковым контролем на пятый – седьмой день очередного менструального цикла.
Кровянистые выделения в течение двух-трех недель допустимы и не являются осложнением, требующим хирургического вмешательства.
При наличии «нечеткой» ультразвуковой картины и отсутствии клинических проявлений неполного аборта (болей внизу живота, повышения температуры тела, интенсивных кровянистых выделений из половых путей, мягкости и болезненности матки при бимануальном обследовании) возможна выжидательная тактика. Она включает профилактику воспалительных осложнений (антибактериальная терапия) и прием повторных доз мизопростола с целью усиления сократительной деятельности матки.
Если показания к хирургическому вмешательству безусловны, то в целях соблюдения принципа безопасности удаление остатков осуществляется методом мануальной вакуумной аспирации с использованием гибких пластиковых канюль. Простота выполнения процедуры мануальной вакуумной аспирации, ее атравматичность позволяют бережно завершить медикаментозный аборт при его недостаточной эффективности. В настоящее время, согласно приказу Министерства здравоохранения и социального развития РФ № 223 от 30 марта 2006 г., кабинеты малой хирургии женских консультаций должны быть укомплектованы инструментарием для мануальной вакуумной аспирации (шприцы, канюли) в необходимом количестве.
Основное преимущество мануальной вакуумной аспирации состоит в атравматичности метода благодаря использованию самого устройства (шприца) и гибких канюль. Содержимое матки собирается в индивидуальный резервуар, что позволяет визуально контролировать удаленные ткани (плодное яйцо, хориальная ткань), в последующем кюретаже матки нет необходимости. Применение мягкой пластиковой канюли практически полностью исключает риск перфорации матки, а отсутствие острых краев отверстий канюли – риск повреждения базального слоя эндометрия. Размер канюли подбирается в соответствии со степенью открытия цервикального канала, при этом не надо расширять шейку матки расширителями Гегара. Риск инфицирования снижается благодаря однократному использованию канюли, а также бесконтактной методике проведения манипуляции, которая не предусматривает выведение канюли из полости матки до окончания процедуры.
После эвакуации содержимого полости матки при осложненном медикаментозном аборте полученный материал фиксируется и направляется на гистологическое исследование в обычном порядке.
Безопасный аборт, по мнению большинства зарубежных авторов, не требует специального восстановительного лечения. Вместе с тем не вызывает сомнений, что у женщин групп риска по нарушению репродуктивной функции послеабортная реабилитация и лечение обоснованы.
Анализ морфометрических показателей эндометрия свидетельствует об ингибирующем действии мифепристона на эндометрий, характеризующимся развитием дегенеративных изменений железистых клеток. Кроме того, при применении этого препарата отмечается активация эндометриальной стромы (пролиферация, васкуляризация, отек). Под влиянием мифепристона также происходит увеличение числа рецепторов эстрогенов, поэтому с целью достижения полноценной секреторной трансформации эндометрия после аборта целесообразно назначить пациенткам прогестагены во второй фазе цикла.
Из-за стресса в организме образуется избыточное количество свободных радикалов, которые вступают в реакцию с липидами и протеинами клетки и вызывают в ней значительные изменения. Учитывая механизм адаптации организма при стрессе, в комплекс послеабортной реабилитации целесообразно включать антистрессовые витамины. Нами была использована следующая схема реабилитации после медикаментозного прерывания беременности: в первые сутки с момента экспульсии плодного яйца применяли препарат Мульти-табс Интенсив по одной таблетке в течение месяца, с 16-го по 25-й день добавляли прием препарата Дюфастон по 10 мг два раза в день (патент № 2005108150/14 от 22.03.2005). Показаниями для назначения препаратов по указанной схеме считали:
изменения срединных маточных структур (размеры полости матки) на контрольных ультрасонограммах (наличие гипоэхогенного содержимого, расширение полости матки, неоднородность и эхогенные включения);
наличие факторов риска нарушений репродуктивной функции (указания на специфические генитальные инфекции в анамнезе, привычное невынашивание, перенесенные ранее операции на придатках, инфекции мочевыводящих путей, иммунодефицитные состояния).
Данную схему реабилитации использовали у 44 женщин после медикаментозного прерывания беременности на раннем сроке. Оценивая состояние эндометрия пациенток при анализе контрольных ультрасонограмм, особое внимание обращали на срединные маточные структуры (размер полости матки, контуры, наличие включений).
У половины пациенток состояние полости матки было нормальным: ее толщина колебалась в пределах 4–7 мм, контуры были ровными, четкими, эндометрий по структуре соответствовал середине цикла или фазе пролиферации. В трети случаев было выявлено расширение полости матки до 10–12 мм (среднее значение 7,0 ± 0,15 мм), отмечалось наличие гипоэхогенных структур, иногда неровность контуров полости матки. У четырех женщин констатировано расширение М-эха до 16–22 мм, полость матки была заполнена множественными гипер- и гипоэхогенными включениями. У двух пациенток визуализировались остатки хориальной ткани, у трех – отдельные признаки эндометрита. Сопоставление полученных ультрасонограмм с клинической картиной течения послеабортного периода не давало оснований для инструментальной ревизии полости матки.
Женщинам была назначена реабилитационная терапия по разработанной схеме, их консервативно наблюдали. У всех пациенток на контрольном ультразвуковом исследовании, проведенном на пятые-шестые сутки от начала очередной менструации, имела место нормальная структура эндометрия, соответствующая ранней фолликулярной фазе менструального цикла. Наблюдение в течение последующих трех-четырех месяцев показало, что у всех женщин восстановился нормальный менструальный цикл.
Таким образом, рациональное ведение женщин после медикаментозного прерывания нежелательной беременности имеет важное значение, поскольку гарантирует в большинстве случаев благоприятный исход. Для улучшения результатов медикаментозного аборта показано применение оральных контрацептивов в цикле прерывания со дня экспульсии плодного яйца или гестагенов с 16-го по 25-й дни в сочетании с витаминами-антиоксидантами. После очередной менструации (на пятый – седьмой день от ее начала) в сомнительных случаях можно провести контрольное ультразвуковое исследование, по данным которого у 99% женщин визуализируется линейный однородный эндометрий, соответствующий фазе менструального цикла.
Источник


