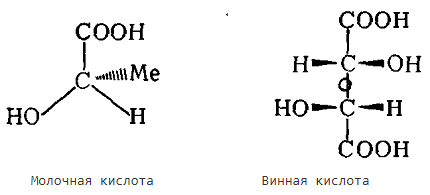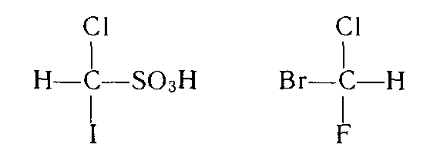Оптически активные вещества
Оптически активные вещества — среды, обладающие естественной оптической активностью. Оптическая активность — это способность среды (кристаллов, растворов, паров вещества) вызывать вращение плоскости поляризации проходящего через неё оптического излучения (света). Метод исследования оптической активности — поляриметрия.
Содержание
Типы оптически активных веществ
Оптически активные вещества подразделяются на 2 типа:
Относящиеся к 1-му из них оптически активны в любом агрегатном состоянии (сахара, камфора, винная кислота), ко 2-му — активны только в кристаллической фазе (кварц, киноварь). У веществ 1-го типа оптическая активность обусловлена асимметричным строением их молекул, 2-го типа — специфической ориентацией молекул (ионов) в элементарных ячейках кристалла (асимметрией поля сил, связывающих частицы в кристаллической решётке).
Кристаллы оптически активных веществ всегда существуют в двух формах — правой и левой; при этом решётка правого кристалла зеркально-симметрична решётке левого и не может быть пространственно совмещена с нею (т. н. энантиоморфные формы). Оптической активности правой и левой форм оптически активных веществ 2-го типа имеют разные знаки (и равны по абсолютной величине при одинаковых внешних условиях), поэтому их называется оптическими антиподами (иногда так называют и кристаллы оптически активных веществ 1-го типа).
Молекулы правого и левого оптически активных веществ 1-го типа являются оптическими изомерами (см. Изомерия, Стереохимия), то есть по своему строению представляют собой зеркальные отражения друг друга. Их можно отличить одну от другой, в то время как частицы оптических антиподов (оптически активные вещества 2-го типа) просто неразличимы (идентичны). Физические и химические свойства чистых оптических изомеров совершенно одинаковы в отсутствие какого-либо асимметричного агента, реагирующего на зеркальную асимметрию молекул. Продукт химической реакции без участия такого агента — всегда смесь оптических изомеров в равных количествах, т. н. рацемат. Физические свойства рацемата и чистых оптических изомеров зачастую различны. Например, температура плавления рацемата несколько ниже, чем чистого изомера. Рацемат разделяют на чистые изомеры либо отбором энантиоморфных кристаллов, либо в химической реакции с участием асимметричного агента — чистого изомера или асимметричного катализатора, либо микробиологически. Последнее свидетельствует о наличии асимметричных агентов в биологических процессах и связано со специфическим и пока не нашедшим удовлетворительного объяснения свойством живой природы строить белки из левых оптических изомеров аминокислот — 19 из 20 жизненно важных аминокислот оптически активны. (Применительно к Оптически активным веществам 1-го типа термины «левый» и «правый» — L и D — условны в том смысле, что не соответствуют непосредственно направлению вращения плоскости поляризации в них, в отличие от этих же терминов — l и d — для Оптически активных веществ 2-го типа или терминов «левовращающий» и «правовращающий».)
Влияние на организм
Физиологическое и биохимическое действие оптических изомеров часто совершенно различно. Например, белки, синтезированные искусственным путём из D-аминокислот, не усваиваются организмом; бактерии сбраживают лишь один из изомеров, не затрагивая другой; L-никотин в несколько раз ядовитее D-никотина. Удивительный феномен преимущественной роли только одной из форм оптических изомеров в биологических процессах может иметь фундаментальное значение для выяснения путей зарождения и эволюции жизни на Земле.
Источник
ОПТИЧЕСКАЯ АКТИВНОСТЬ
ОПТИЧЕСКАЯ АКТИВНОСТЬ, способность в-ва- твердого, жидкого или газа-вращать плоскость поляризации проходящего через него света. Такие в-ва наз. оптически активными. Поворот происходит либо вправо (по часовой стрелке), либо влево (против часовой стрелки), если смотреть навстречу ходу лучей света. Оптической активностью обладают энантиомеры (см. Изомерия), а также энантиоморфные формы кристаллов (см. Энантиоморфизм)ахиральных в-в при хиральном расположении их молекул в кристаллич. решетке (напр., кварц, мочевина). От этой естественной оптической активности хиральных сред отличают наведенную оптическая активность ахиральных в-в, к-рая появляется в них в магн. поле (Фарадея эффект)или при контакте с хиральными молекулами (эффект Пфейфера).
Мера оптической активности-оптич. вращение a, к-рое измеряют при помощи поляриметров, спектрополяриметров и дихрогра-фов. Уд. вращение 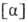
плотн. в-ва (в г/см 3 ), 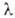
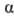
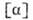
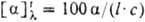
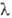
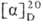
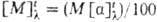
Согласно О. Френелю (1823), оптическая активность среды объясняется различием ее показателей преломления n + и n — для право- и левополяризованных по кругу компонент плоскополяризов. луча света с длиной волны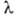
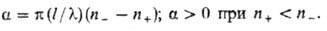
Т. к. величина n связана с электронной поляризуемостью b е молекул среды соотношением (п 2 — 1)/(п 2 + 2) = 4 /з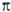
Если в хиральной молекуле связанные с асимметрич. центром группы не имеют полос поглощения в ближней УФ области, то оптическая активность такого соед. мала, как, напр., у вторичных алифатич. спиртов, для к-рых полоса поглощения группы ОН лежит в далекой УФ области (ок. 180 нм). При наличии интенсивных хромофоров (карбонильная группа или арома-тич. заместитель) оптическая активность соединений в видимой области спектра велика. Согласно правилам Л. А. Чугаева, молярное вращение возрастает с приближением оптически активного хромофора к асимметрич. атому углерода, а при неизменном их взаимном расположении остается приблизительно постоянным для всех гомологичных серий соединений. Особенно велика оптическая активность соединений с собственно диссимметричным хромофором, таких, как гелицены (правоспиральный гекса-гелицен имеет 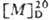
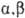
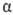
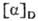
Дж. Брюстер разработал схемы расчета знака и величины молярного вращения соед. с асимметрич. атомом углерода на основе сравнения поляризуемости заместителей при этом атоме и вкладов скошенных конформац. звеньев. Эти схемы применяются для предсказания абс. конфигурации и конформации хиралъных молекул. С этой же целью успешно применяют правило октантов, связывающее структуру молекулы с характером зависимости ее оптической активности от длины волны (с дисперсией оптич. вращения, знаком эффекта Коттона; см. Хироптические методы).
О птическая активность впервые обнаружена Д.Ф. Араго в 1811 (кварц) и Ж. Б. Био в 1815 (природные орг. в-ва).
Лит.: Потапов В. М., Стереохимия, 2 изд., М., 1988, с. 186-99.
Источник
Оптическая активность и хиральность
Вы будете перенаправлены на Автор24
Основные представления об энантиомерии
Оптически активные соединения встречаются среди органических веществ всех классов: алифатических, алициклических, гетероциклических, ароматических.
Энантиомерия (оптическая активность) проявляется в существовании пар оптических антиподов. Оптическую активность всегда связывали с ассиметрией молекулы. Однако существуют вещества, в которых асимметрии нет – оптически активные вещества.
При сравнении молочной и винной кислот видно, что в молочной кислоте есть асимметричный атом углерода и ее молекула лишена элементов симметрии, она асимметрична. В молекуле винной кислоты элементом симметрии является ось второго порядка, которая проходит в центре молекулы. В таком случае винная кислота уже не асимметричная, а хиральная.
Оптическая активность проявляется в результате либо асимметрии, либо хиральности.
Одним из первых связь оптической активности с присутствием асимметричного атома углерода доказал Э.Фишер. Он показал, что активный моноамид замещенной малоновой кислоты будет терять свою активность при превращении в свободную кислоту:
Доказано, что если вещество обладает единственным асимметричным углеродным атомом, то оно также будет обладать оптической активностью.
Например: иодхлорметансульфокислота и (+)-бромфторхлорметан
Готовые работы на аналогичную тему
Для возникновения значительного вращения необходимо, чтобы заместители у асимметричного центра были изомерными:
Показано, что для возникновения оптической активности достаточно:
цис-, транс-изомерии двух заместителей, находящихся у асимметричного атома:
наличие изотопного различия заместителей, находящихся у асимметричного центра.
Типы элементов хиральности
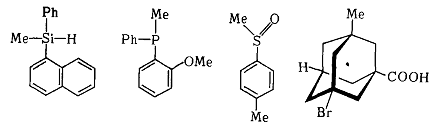
Хиральный центр. Хиральный центр может быть образован, например, ассиметричным атомом углерода в молочной кислоте, атомом кремния, фосфора, серы в соединениях метил-α-нафтилфенилсилане (а), о-анизилметилфенилфосфине (б), метил-n-толилсульфоксиде (в).
В соединениях (б) и (в) заместители вокруг хирального центра располагаются пирамидально. Все эти структуры можно свести к тетраэдрическому строению, если считать свободную электронную пару четвертым заместителем.
В энантиомерах ряда адаманта (г) хиральный центр размещен внутри молекулы, где атом вовсе отсутствует.
Большинство соединений азота в результате инверсии свободной электронной пары не являются хиральными.
Оси хиральности. Наблюдаются в алленах, производных бифенила.
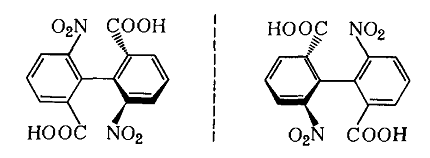
6,6′ — динитробифенилдикарбоновая — 2,2′ кислота является примером атропоизомерии – пространственной изомерии, при которой отсутствует свободное вращение вокруг простой связи:
Плоскость хиральности. Присутствует в металлоценах и соответственно замещенных производных ферроцена.
Например: 2-метилферроценкарбоновая кислота
Спиральность. Характерна для соединений, в которых бензольные ядра могут размещаться в одной плоскости. При наличии шести и более ядер, их размещение в одной плоскости становится невозможным и тогда образуется правая или левая спираль. Спиральность присутствует в нуклеиновых кислотах, белках и др. соединениях.
Например: Гексагелицин, построенный из орто-конденсированных бензольных ядер
Свойства оптических изомеров
Оптические антиподы имеют одинаковое строение. Они состоят из одинаковых атомов или групп атомов, одинаково связанных между собой.
Их химические реакции с неактивными реактивами будут тождественны. С оптически активными реактивами антиподы могут реагировать с различными скоростями.
Оптические антиподы обладают одинаковыми физическими свойствами:
- температура кипения и плавления;
- удельный вес;
- показатели преломления и др.
Оптические антиподы будут отличаться только оптическими свойствами: при прочих равных условиях вращают плоскость поляризации света на одинаковое число градусов, один – вправо, другой – влево.
Кристаллы оптических антиподов могут обладать гемиэдрическими сторонами (натрийаммониевая соль винной кислоты).
Рацемические смеси обладают физическими свойствами, сильно отличающимися от свойств соответствующих оптических антиподов.
Источник