Интерпретация клеточного состава, особенности изменений в клетках при различных патологических процессах
Основу цитологической диагностики составляет изучение клеток, изменений в их расположении и строении. Критерии цитологической диагностики включают анализ клеточного и неклеточного состава: количество клеток, наличие клеток разного типа, их расположение в структурах или разрозненно, вид структур, размер, форма, строение клеток и ядер, наличие или отсутствие клеточного и ядерного полиморфизма и другие параметры. По характеру и степени выраженности отклонения от нормального клеточного состава судят о природе патологического процесса. По признакам, характерным для определенных тканей, судят о тканевой принадлежности опухоли. При этом учитывают фон препарата — элементы крови, бесструктурное вещество, коллоид, жир и др.
Количество клеток в мазке определено прочностью межклеточных связей и обилием стромы. Богатый клеточный состав бывает в низкодифференцированных опухолях, гемато- и лимфосаркоме, нейроэндокринных опухолях. Скудный материал и даже единичные клетки встречают, в частности, при скиррозном и дольковом раке молочной железы.
Расположение клеток. Клетки в мазке могут располагаться разрозненно или в виде структур. Для доброкачественных поражений характерно правильное, упорядоченное расположение клеток, одинаковое расстояние между ними, сходные размеры клеток и ядер, образующих структуру. Для злокачественных новообразований характерны структуры (комплексы, пучки) с неупорядоченным расположением клеток.
Размеры клеток и ядер. Размеры клеток по возможности оценивают в сравнении с размерами нормальных клеток того же типа. Размеры ядер обычно сравнивают с размером эритроцита (в норме достаточно стабильным, примерно 7 мкм). Соотношение размера ядра и цитоплазмы (ядерно-цитоплазматическое соотношение) также весьма различно в разных клетках, и при его оценке учитывают степень отклонения этого параметра от нормальной клетки того же типа.
Фон препарата часто имеет большое диагностическое значение. Фоном могут быть элементы периферической крови или воспаления, связанного с инфекцией, сопровождающего опухолевый и другие процессы, клеточный детрит, межуточное вещество. Фон препарата может иметь диагностическое значение при определении тканевой принадлежности или гистологической формы опухоли.
При реактивных и фоновых поражениях чаще всего увеличено число клеток (гиперплазия, пролиферация), размер ядер и отмечается их более интенсивная окраска (гиперхромия). Хроматин распределен сравнительно равномерно. В некоторых ядрах (особенно характерно для железистого эпителия) увеличен размер ядрышек. При некоторых состояниях изменен размер клеток и наблюдаются особенности окрашивания цитоплазмы.
При пограничном процессе (поражении, близком к злокачественной опухоли) размер ядер увеличен значительно, ядро деформировано, контуры его неровные, ядерная мембрана неравномерно утолщена, встречаются многоядерные клетки. Хроматин распределен неравномерно, чередуются мелкие и крупные участки уплотнения. Образуются множественные мелкие ядрышки, возможно увеличение их размеров. Однако в отличие от злокачественной опухоли в разных клетках изменения оценивают как мономорфные (однотипные).
Изменения в клеточном составе мазка при злокачественной опухоли характеризуются клеточным и ядерным полиморфизмом (различием характеристик разных клеток), образованием структур, отличающихся от нормальных, изменением фона препарата; для многих злокачественных опухолей характерен так называемый опухолевый диатез — реакция соединительной ткани на инвазию (прорастание опухоли).
Если количество материала достаточное, клетки сохранены, хорошо приготовлен и окрашен препарат, то можно без характеристики микроскопической картины формулировать цитологический диагноз с указанием на гистологическую форму опухоли и степень дифференцировки (низкодифференцированная аденокарцинома, плоскоклеточный рак с ороговением, фиброаденома).
Источник
Особенности диагностики нейроэндокринных опухолей
Нейроэндокринные опухоли (НЭО) — это гетерогенная группа новообразований, развивающихся из нейроэндокринных клеток. Такие клетки расположены в различных органах и секретируют биологически активные вещества, эффекты которых обуславливают многообразие клинической картины и трудности диагностики. Прежде чем попасть на прием к онкологу, пациентам зачастую бывают проведены консультации различных специалистов, обращение к которым вызвано симптоматикой новообразования. Ранняя диагностика НЭО в значительной мере зависит от онконастороженности непрофильных клиницистов и, конечно же, от морфологической верификации диагноза — «золотого правила» в онкологии, своеобразной точки отсчета онкологической истории.
Локализация НЭО крайне разнообразна, но чаще всего они обнаруживаются в органах пищеварительной системы (более 50 %): прямая (17,2 %) и тонкая кишка (13,4 %), желудок (6,0 %), поджелудочная железа (6–7 %). НЭО занимают второе место в общей структуре онкологической патологии ЖКТ, уступая лидерские позиции лишь колоректальному раку. Около 27 % случаев НЭО возникают в легких (согласно базе данных Surveillance, Epidemiology, and End Results (SEER) 1975-2016) [1].
Еще недавно обсуждались вопросы включения НЭО в список орфанных заболеваний. Но в настоящее время отмечается увеличение частоты встречаемости этой патологии, в том числе из-за улучшения диагностических возможностей (в частности, распространение гастроскопии, колоноскопии, капсульной эндоскопии).
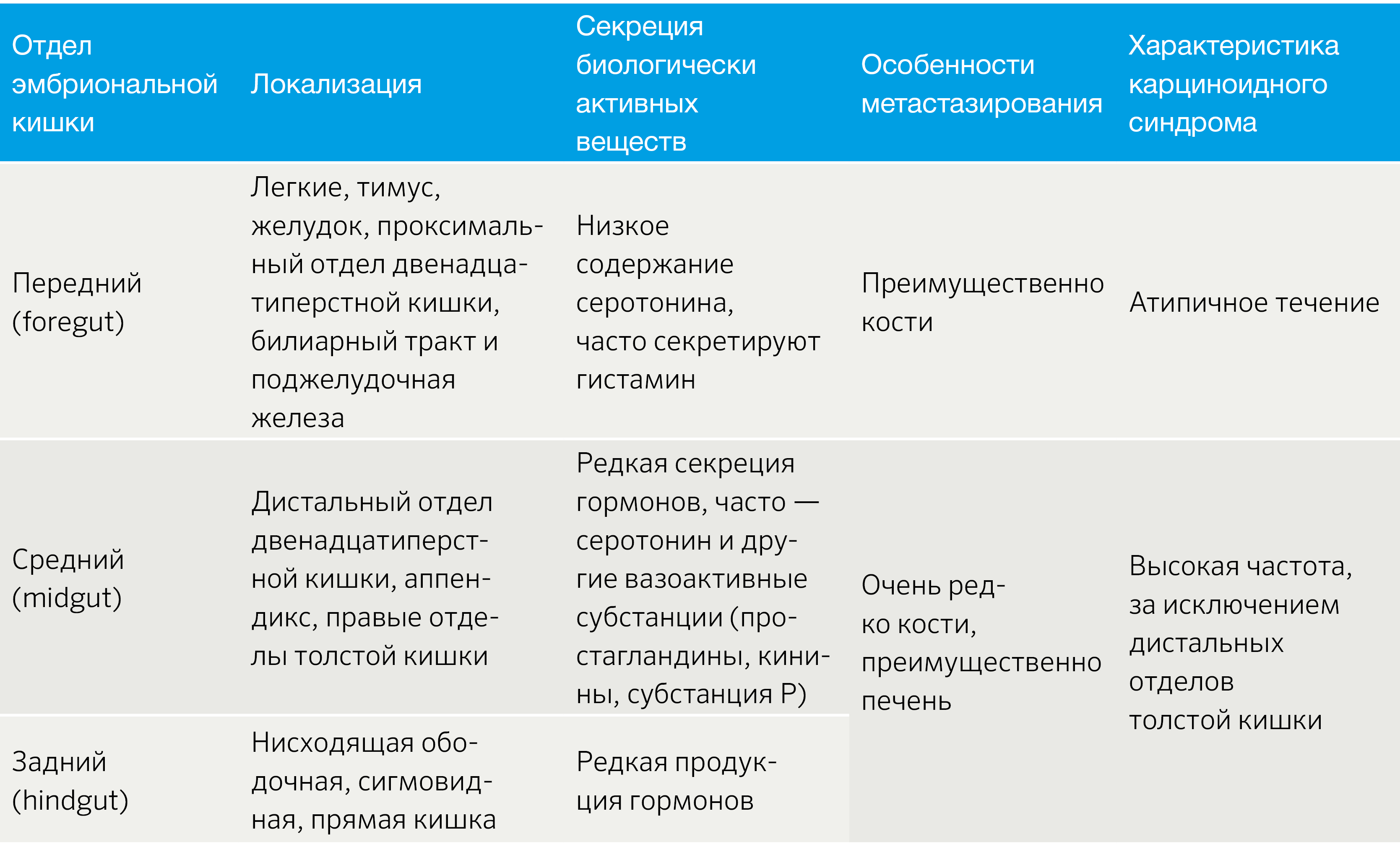
НЭО классифицируют в зависимости от отдела эмбриональной кишечной трубки: из передней, средней и задней кишки (табл. 1) [2].
Табл.1 | Классификация НЭО по эмбриогенезу [2].
Карциноидный синдром — важный клинический признак. В основном, он обусловлен эффектами серотонина, а также брадикинина, гистамина, дофамина и в меньшей степени других биологически активных веществ (БАВ).
Клинические проявления карциноидного синдрома разнообразны. Наиболее часто у пациентов отмечается гиперемия кожи лица, приливы, диарея, боль в животе. У 60 % пациентов отмечают формирование карциноидной болезни сердца, с нарушением работы преимущественно клапанного аппарата правых отделов (стеноз и/или недостаточность легочного и трехстворчатого клапанов). Серьезным осложнением является декомпенсация нарастающей сердечной недостаточности. Морфологическим субстратом служит выраженный диффузный фиброэластоз эндокарда. Возможны появления телеангиоэктазий, одышки, пеллагры, бронхоспазма. Усиливается продукция соединительнотканных компонентов, в частности, коллагена. Это ведет к фиброзированию и стенозу брыжеечных артерий, фиброзирующему стенозу уретры. Ввиду склонности к развитию спаечного процесса в брюшной полости нарастает риск формирования кишечной непроходимости.
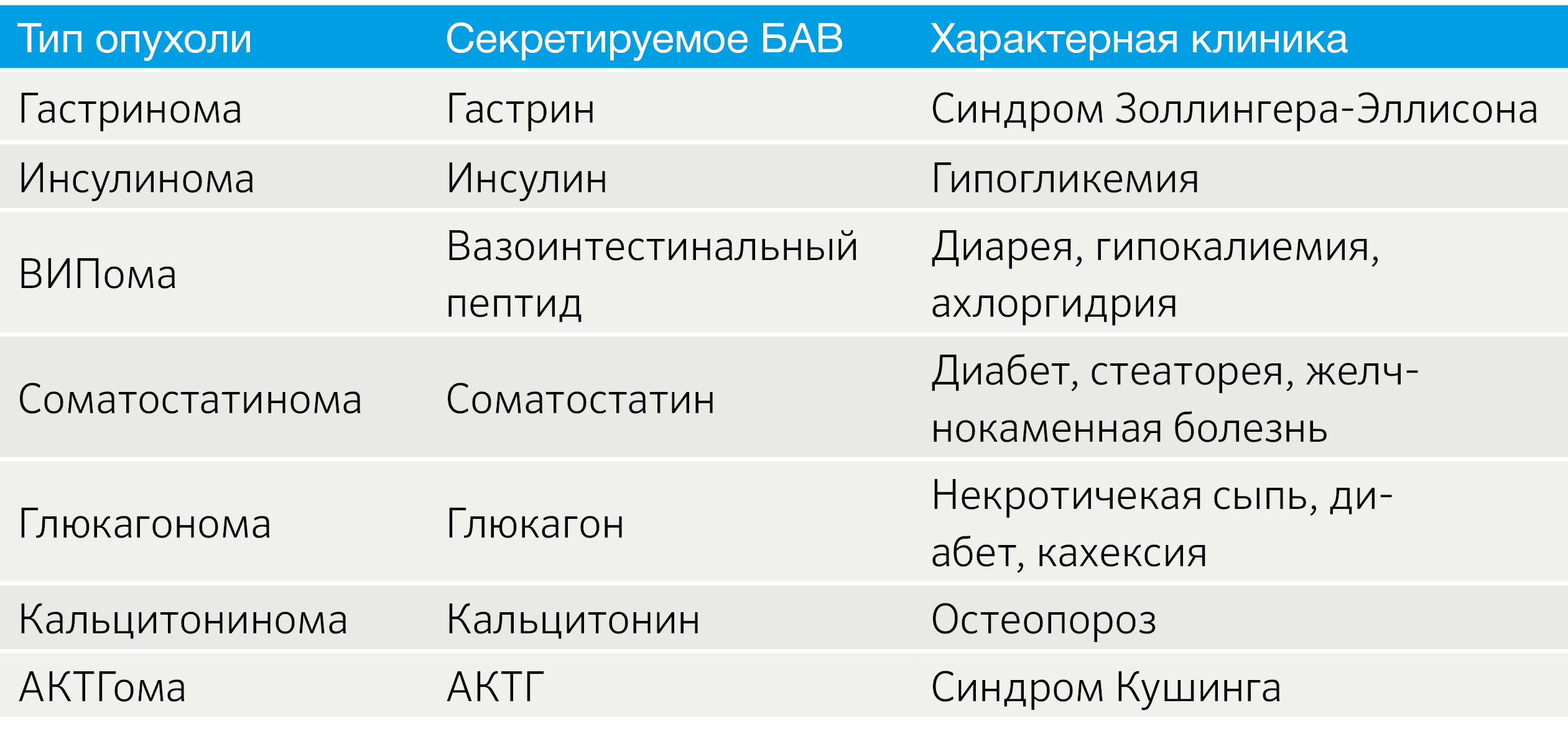
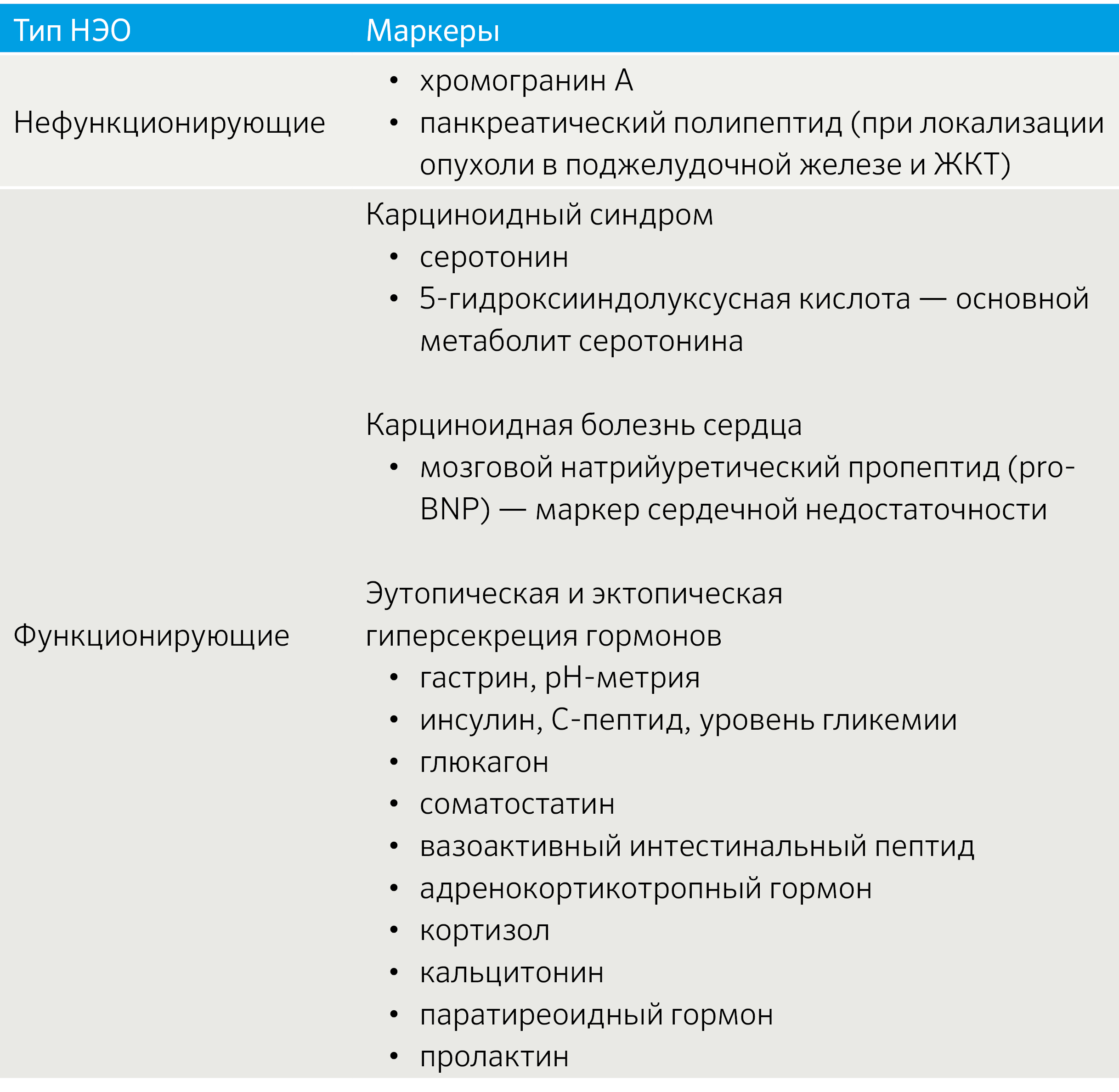
Важным аспектом является функциональный статус опухоли. В зависимости от наличия продукции БАВ выделяют функционирующие (табл. 2) и нефункционирующие новообразования [3].
Табл.2 | Функционирующие НЭО [3].
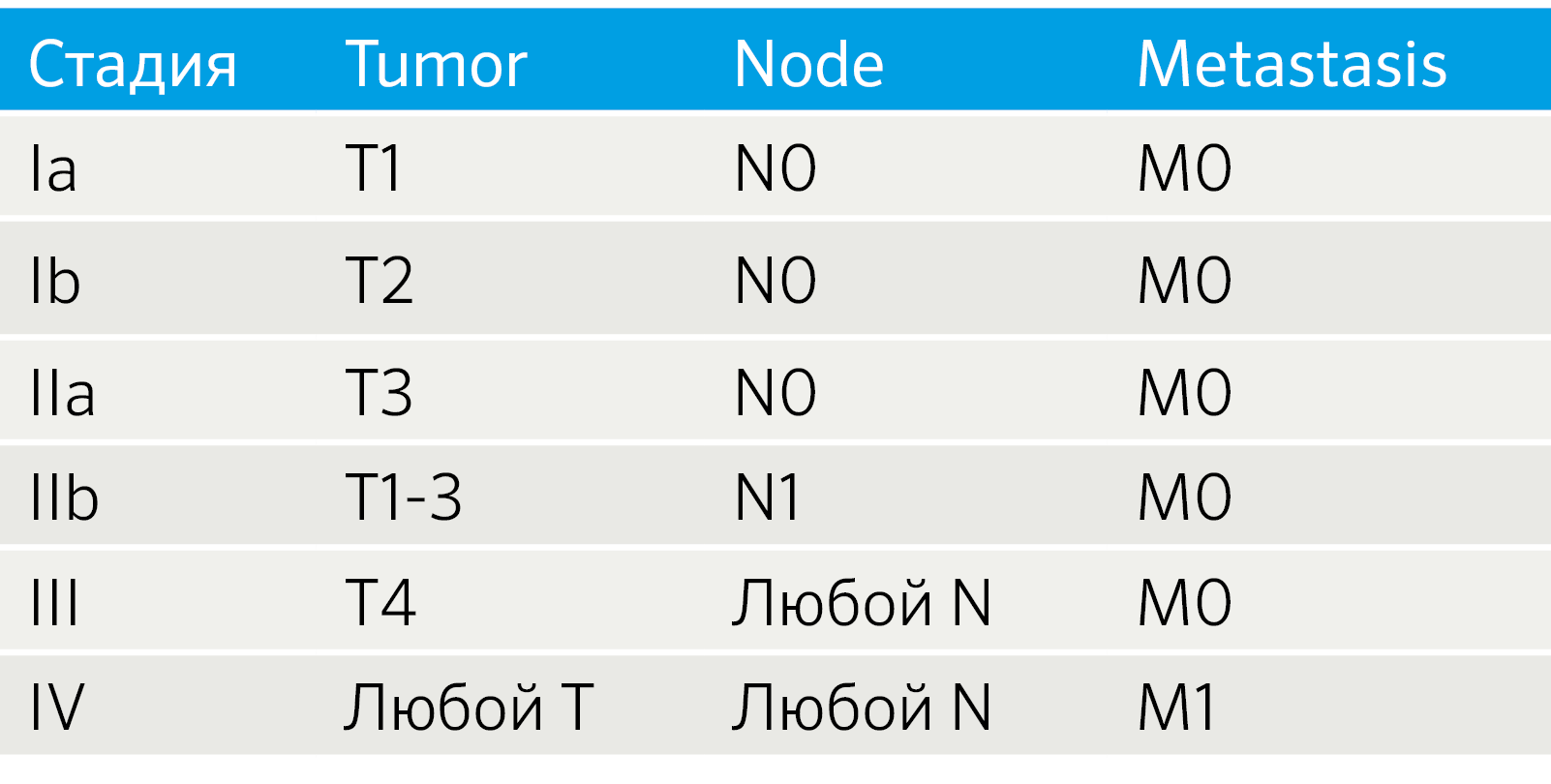
Особенности TNM-классификации определяются локализацией НЭО. НЭО легких стадируются как немелкоклеточный рак легких, для НЭО ЖКТ и поджелудочной железы разработаны рекомендации Европейского общества по изучению НЭО (ENETS) [4]. Также установление стадии TNM для всех анатомических локализаций регламентируется руководством, созданным Американским объединенным комитетом по раковым заболеваниям (the American Joint Committee on Cancer, AJCC) [5, 6]. Так как эти системы не идентичны, возникают вопросы унификации подходов к стадированию. Например, была создана модифицированная система ENETS (mENETS), для диагностики НЭО поджелудочной железы (pNET) (табл. 3) [7].
Табл.3 | Стадирование НЭО поджелудочной железы согласно модифицированной системе ENETS (mENETS) [7].
И вот мы подходим к той черепахе, на которой стоят киты онкологической диагностики. Это, несомненно, гистологическая верификация диагноза. Как и многие опухолевые заболевания, морфологические градации НЭО подвергались различным модификациям, уточнениям, дополнениям. Дискуссии в этой области в итоге привели к созданию 4-ой редакции классификации ВОЗ (2017 год) [8]. Именно она является актуальной на настоящий момент и заключение при проведении патологоанатомическом исследовании должно отвечать введенным в ней понятиям и требованиям.
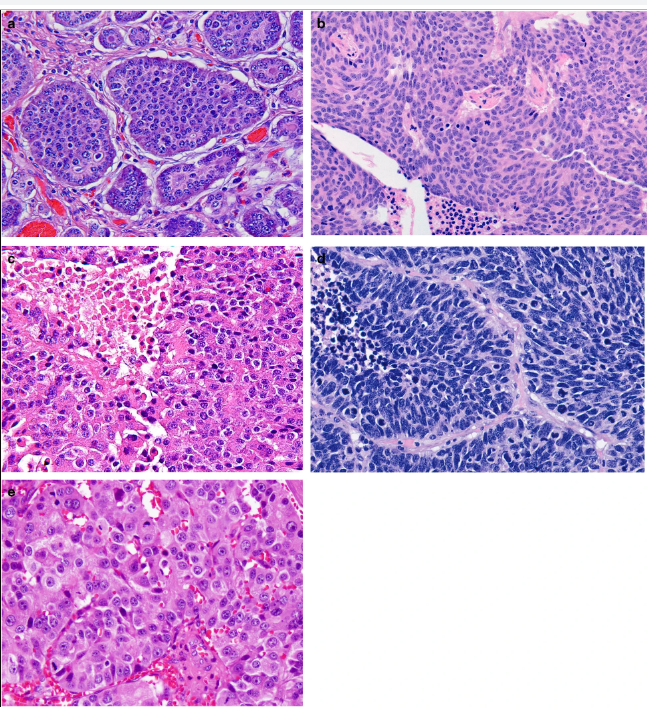
Параметрами морфологической оценки нейроэндокринных новообразований являются: гистологическое строение опухоли, определение сосудистой и периневральной инвазии, митотический индекс. Несмотря на многообразия источников НЭО, морфологическая картина является сходной (рис. 1) [9].
Нейроэндокринное происхождение атипичных клеток доказывает положительная экспрессия так называемых общих нейроэндокринных маркеров. Основные из них это хромогранин А, окрашивающий компоненты нейросекреторных гранул, и пептид синаптофизин, накапливающийся в мелких синаптических везикулах. Также применяется дополнительно установление экспрессии рецепторов соматостатина 2 и 5 типов (SSTR2 и SSTR5). В этом случае возможно определить чувствительность опухолевых клеток к аналогам соматостатина.
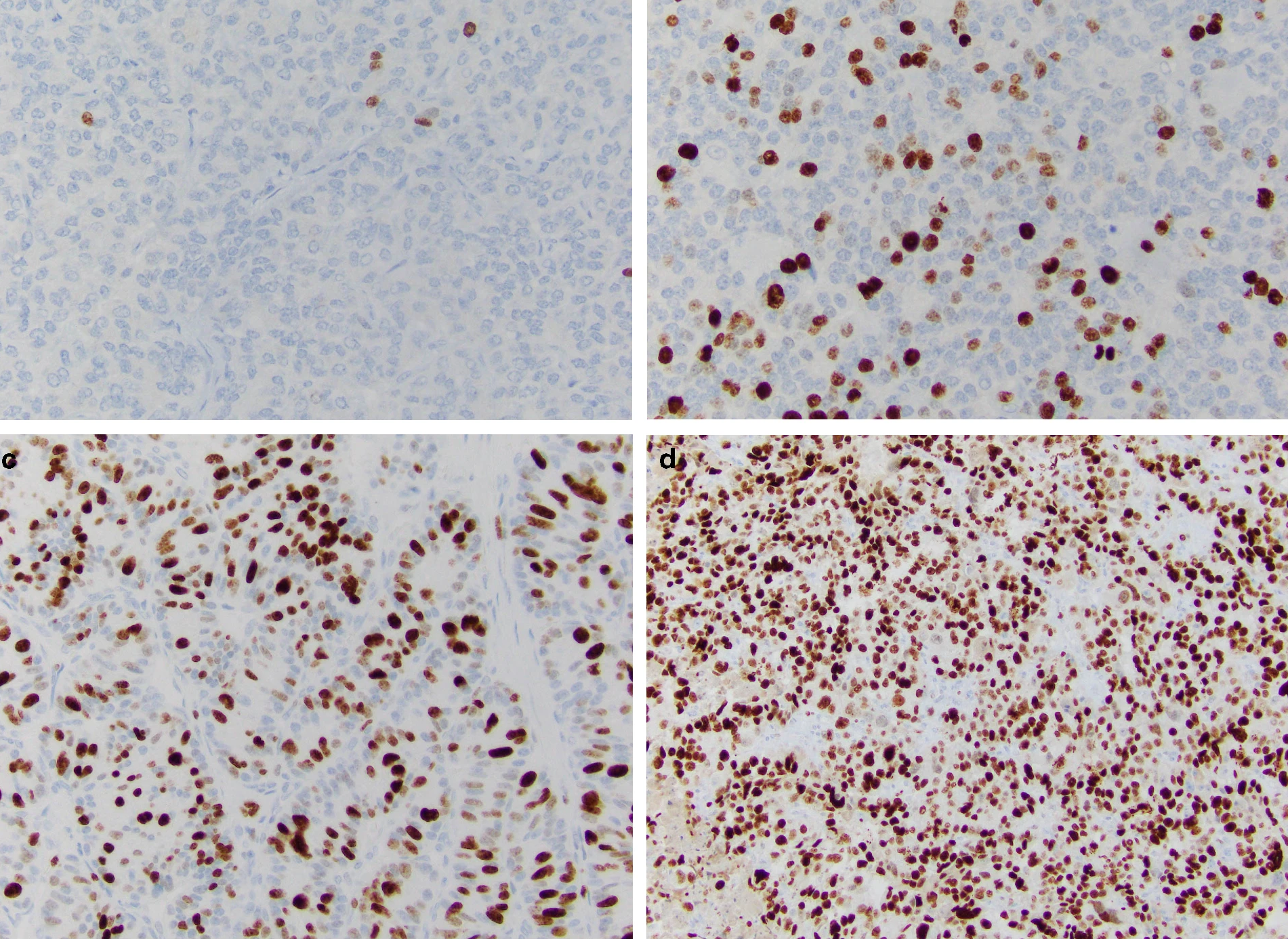
Степень злокачественности НЭО определяют на основании двух основных критериев: уровня дифференцированности опухолевых клеток и их пролиферативной активности. Традиционно выделяют три степени злокачественности (grade): G1, G2, G3. Для НЭО ЖКТ и поджелудочной железы введены понятия высокодифференцированных и низкодифференцированных новообразований (или нейроэндокринного рака (карциномы), НЭР). Высокодифференцированные НЭО объединяют G1 (менее 2 митозов на 10 репрезентативных полей зрения (РПЗ) при большом увеличении микроскопа (х400) и индекс Ki-67 ≤ 2%), G2 (2–20 митозов на 10 РПЗ и индекс Ki-67 3–20 %), G3 (> 20 митозов на 10 РПЗ и индекс Ki-67 > 20 %). Grade 3 опухоли разделяют на мелко- и крупноклеточный рак. Опухоли мелкоклеточного типа построены из однотипных клеток округлой, овальной или вытянутой формы, мелкого размера, со скудной цитоплазмой и нечеткими границами. Ядра имеют характерный вид за счет нежного хроматина и невизуализирующихся ядрышек. Определяются массивные некрозы. Крупноклеточные НЭР образованы, соответственно, клетками крупного или среднего размера, с низким ядерно-цитоплазматическим соотношением, выраженной атипией ядер, содержащих гранулярный хроматин и четкие ядрышки. В опухолевой ткани выявляются мультифокальные некрозы, значительное число митозов [8, 9].
Индекс Ki-67 определяют как средний процент окрашенных ядер при учете 500–2000 злокачественно трансформированных клеток (рис. 2) [9].
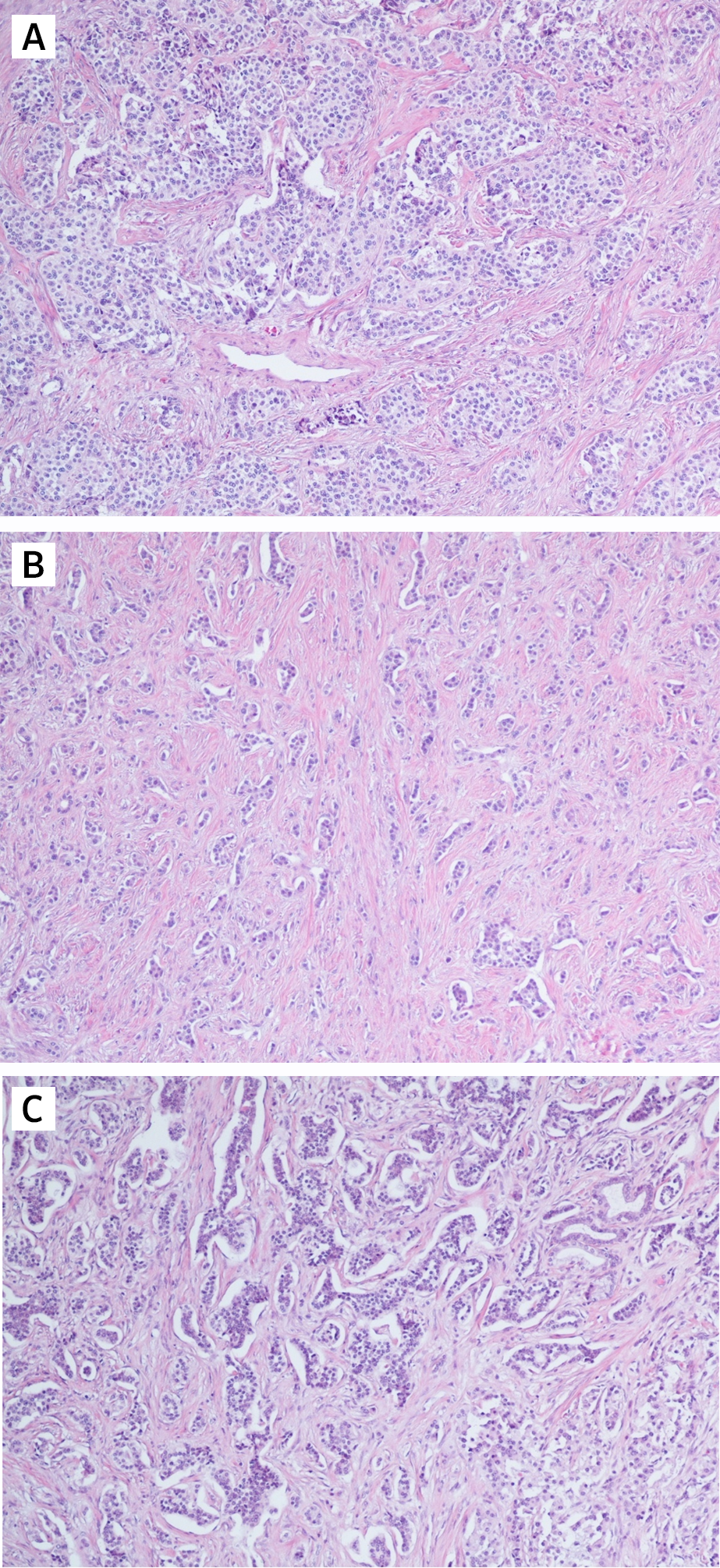
Рассмотрим различия понятий НЭО G3 и НЭР при локализации в поджелудочной железе. Несмотря на высокую степень злокачественности НЭО G3 гистологически имеют органоидную модель строения (рис. 3), отсутствие некрозов [10]. При иммуногистохимическом исследовании опухолевая ткань сохраняет экспрессию общих маркеров нейроэндокринной дифференцировки (диффузно и интенсивно определяется экспрессия синаптофизина, зачастую хромогранина А), а также панкреатические экзокринные или эктопические гормоны. Кроме того, в них отсутствует выраженная экспрессия p53 и утрата экспрессии RB (также определяются иммуногистохимически).
НЭР поджелудочной железы — это опухоли низкой степени дифференцировки и соответственно высокой степени злокачественности. Экспрессия общих маркеров нейроэндокринной дифференцировки атипичными клетками снижается: синаптофизин определяется слабо или диффузно, хромогранин А также слабо или фокально. Экзокринные гормоны отрицательны в таких опухолях [9]. Часто определяется экспрессия р53, белков ремоделирования хроматина DAXX (death-associated protein 6) и ATRX (АТФ-зависимая хеликаза), потеря экспрессии RB (белок ретинобластомы) и ISL1 (энхансер гена инсулина 1) [11].
Ввиду многообразия секретирующего профиля НЭО биохимическая диагностика включает различные маркеры, комбинируемые с учетом клинической картины (табл. 4).
Табл. 4 | Спектр биохимических маркеров НЭО [2].
Методы лучевой диагностики включают «классические» КТ и МРТ с контрастированием. Для оценки метастатического поражения печени возможно проведение УЗИ органов брюшной полости.
Радионуклидная диагностика играет важную роль в топической характеристике НЭО. Она включает методы специфической метаболической визуализации ( 123 I-MIBG), рецепторной визуализации ( 111 In-октреотид, 68 Ga-DOTA-TOС/DOTA-NOC/DOTA-TATE) и неспецифической метаболической визуализации ( 18 F-FDG, 18 F-DOPA).
123 I-метайодбензилгуанидин (MIBG) является аналогом норадреналина (норэпинефрина). Он накапливается в адренергических тканях и опухолях, происходящих из них. Сцинтиграфия с 123 I-MIBG используется для диагностики нейробластомы, феохромоцитомы, параганглиомы, карциноидов бронха и тонкой кишки [12].
Для рецепторной визуализации применяют 111 In (индий)-октеотид. Он выявляет высокодифференцированные нейроэндокринные опухоли, опухоли из клеток островкового аппарата поджелудочной железы (гастринома, глюкагонома, инсулинома). Также для верификации НЭО ЖКТ применяется соматостатин-рецепторная сцинтиграфия, так как большинство из них имеют рецепторы к соматостатину (SSTR) на поверхности опухолевых клеток (чаще 2 и 5 типа).
Выбор радионуклидного метода связан со степенью дифференцировки опухолевых клеток. Первичная диагностика НЭО Grade 1 и 2 проводится путем ПЭТ/КТ с радиофармпрепаратами (РФП), мечеными галлием 68 (является ПЭТ-радионуклидом). Сродство (аффинитет) РФП к конкретному подтипу трансмембранных рецепторов соматостатина определяет выбор диагностического индикатора (ПЭТ-лиганда, представленного различными модификациями DOTA). Например, для визуализации НЭО, экспрессирующих рецепторы подтипов SSTR2a и SSTR2b, применяют 68 Ga-DOTA-TATE (DOTA-Tyr3-октреотад). 68 Ga-DOTA-NOC (DOTA-1-Nal3-октреотид) выявляет подтипы SSTR3 и SSTR5, 68 Ga-DOTA-ТOC (DOTA-Tyr3-октреотид) — рецепторы SSTR5 [13].
При отсутствии возможности проведения данного исследования следует выполнить однофотонную эмиссионную компьютерную томографию (ОФЭКТ)/КТ (гибридный метод визуализации) с соматостатин-рецепторным радиофармпрепаратом.
Для недифференцированных НЭО Grade 3 и НЭР при отрицательных результатах соматостатин-рецепторной сцинтиграфии рекомендуется ПЭТ неспецифическая метаболическая визуализация с использованием других РФП. В частности, ПЭТ/КТ c 18F-фтордезоксиглюкозой (18F-ФДГ), которая неэффективна при высокодифференцированных НЭО [14]. Также рассматривают применение 18F-L–DOPA (дигидроксифенил-аланин) — меченого предшественника допамина, который эффективен для обнаружения медуллярного рака щитовидной железы, НЭО, параганглиомы и феохромоцитомы [15].
Современные классификации НЭО в значительной мере основаны на общей морфологии, которую эти новообразования демонстрируют в различных анатомических участках. Закономерно предположить, что такая структурная схожесть является результатом общей «нейроэндокринной» мультигенной программы, стимулирующей дифференцировку нейроэндокринных клеток. Но схожесть не означает идентичность, и несомненно существующая тканеспецифичность нейроэндокринных клеток диктует характерною индивидуальную гормональную продукцию. Профиль экспрессии БАВ атипичными клетками определяет клиническую картину и прогноз заболевания. Поэтому важно иметь возможность точно определяет источник опухоли. С использованием все расширяющихся диагностических возможностей такой подход становится реальным, формируя персонализацию терапевтических стратегий в нейроэндокринной онкологии.
Источник