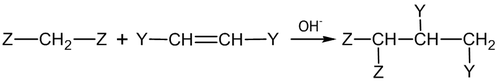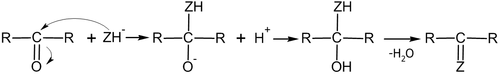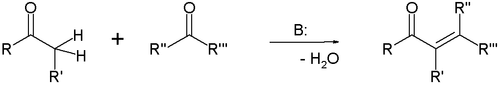- Реакции нуклеофильного присоединения
- Содержание
- Реакции нуклеофильного присоединения по связи углерод-углерод
- Механизм реакций нуклеофильного присоединения по связи углерод-углерод
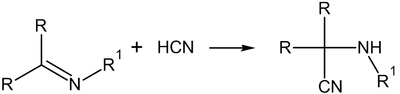
- Реакции нуклеофильного присоединения по связи углерод-гетероатом
- Механизм реакций нуклеофильного присоединения по связи углерод-гетероатом
- Типичные реакции нуклеофильного присоединения по связи C=O
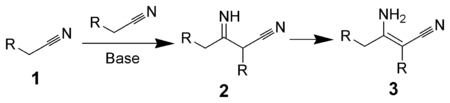
- Типичные реакции нуклеофильного присоединения по связи C=N и С≡N
- Примечания
- Полезное
- Смотреть что такое «Реакции нуклеофильного присоединения» в других словарях:
- Реакции нуклеофильного присоединения к карбонильной группе альдегидов и кетонов
- Механизм реакций нуклеофильного присоединения
- Готовые работы на аналогичную тему
- Влияние заместителей на ход реакции нуклеофильного присоединения к карбонильной группе
- Влияние строения соединений на ход реакции нуклеофильного присоединения к карбонильной группе
Реакции нуклеофильного присоединения
Реакции нуклеофильного присоединения (англ. addition nucleophilic reaction ) — реакции присоединения, в которых атаку на начальной стадии осуществляет нуклеофил — частица, заряженная отрицательно или имеющая свободную электронную пару. На конечной стадии образующийся карбанион подвергается электрофильной атаке.
Несмотря на общность механизма различают реакции присоединения по связи углерод-углерод и углерод-гетероатом.
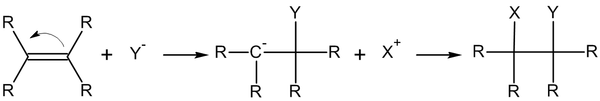
Общий вид реакций присоединения по двойной связи углерод-углерод:
Реакции нуклеофильного присоединения более распространены для тройных, чем для двойных связей [1] .
Содержание
Реакции нуклеофильного присоединения по связи углерод-углерод
Механизм реакций нуклеофильного присоединения по связи углерод-углерод
Нуклеофильное присоединение по кратной связи обычно двухстадийный процесс AdN2 — реакция бимолекулярного нуклеофильного присоединения (англ. addition nucleophilic bimolecular ) [2] :
Нуклеофильное присоединение по связи С=C встречается достаточно редко, и, как правило, если в соединении имеются электроноакцепторные заместители [3] . Наибольшее значение имеет в этом классе реакция Михаэля [4] :
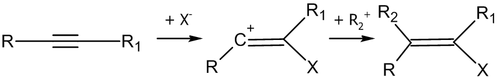
Присоединение по тройной связи аналогично присоединению по связи С=C:
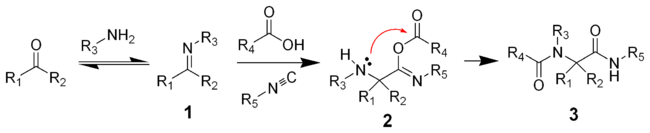
Реакции нуклеофильного присоединения по связи углерод-гетероатом
Механизм реакций нуклеофильного присоединения по связи углерод-гетероатом
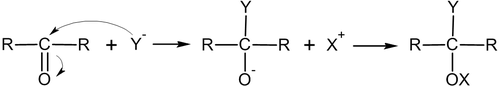
Нуклеофильное присоединение по кратной связи углерод-гетероатом имеет механизм AdN2:
Как правило, лимитирующей стадией процесса является нуклеофильная атака, электрофильное присоединение происходит быстро [1] .
Иногда продукты присоединения вступают в реакцию отщепления, тем самым совокупно давая реакцию замещения:
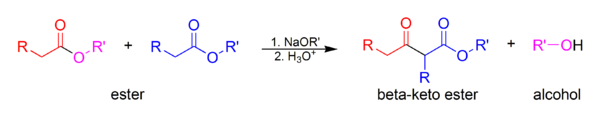
Hуклеофильное присоединение по связи С=O очень распространено, что имеет большое практическое промышленное и лабораторное значение [3] .
Типичные реакции нуклеофильного присоединения по связи C=O
4. Реакция Реформатского.
Типичные реакции нуклеофильного присоединения по связи C=N и С≡N
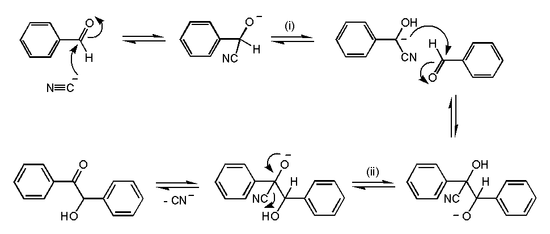
1. Реакция Торпа.
Примечания
- ↑ 12Mарч Дж. Органическая химия, пер. с англ., т. 3, — M.: Мир, 1988
- ↑Сайкс П. Механизмы реакций в органической химии, 4-е изд. / Пер. с англ.,под редакцией В. Ф. Травеня — M.: Химия, 1991 — ISBN 5-7245-0191-0
- ↑ 12 Химическая энциклопедия./ Нуклеофильные реакции. // Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988 год. — Т. 3.
- ↑Ли Дж. Именные реакции. Механизмы органических реакций /Пер. с англ. В. М. Демьянович. — М.:БИНОМ. Лаборатория знаний, 2006 — ISBN 5-94774-368-X
 Химические реакции в органической химии Химические реакции в органической химии | |
|---|---|
| Реакции замещения | Реакции нуклеофильного замещения · Реакции электрофильного замещения · Реакции радикального замещения |
| Реакции присоединения | Реакции нуклеофильного присоединения · Реакции электрофильного присоединения · Реакции радикального присоединения · Реакции синхронного присоединения |
| Реакции элиминирования | Реакции гетеролитического элиминирования · Реакции перициклического элиминирования · Реакции радикального элиминирования |
| Реакции перегруппировки | Нуклеофильные перегруппировки · Электрофильные перегруппировки · Радикальные перегруппировки |
| Реакции окисления и восстановления | Реакции окисления · Реакции восстановления |
| Прочее | Именные реакции в органической химии |
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Реакции нуклеофильного присоединения» в других словарях:
Реакции электрофильного присоединения — (англ. addition electrophilic reaction) реакции присоединения, в которых атаку на начальной стадии осуществляет электрофил частица, заряженная положительно или имеющая дефицит электронов. На конечной стадии образующийся… … Википедия
Реакции радикального присоединения — (англ. addition radical reaction) реакции присоединения, в которых атаку осуществляют свободные радикалы частицы, содержащие один или несколько неспаренных электронов. При этом радикалы могут атаковать как другие радикалы, так и… … Википедия
Реакции синхронного присоединения — реакции присоединения, в которых атака на оба атома кратной связи осуществляется одновременно. Другое название реакций этого типа реакции циклоприсоединения, так как конечным продуктом таких реакций являются циклические субстраты. Существует две… … Википедия
Реакции нуклеофильного замещения — (англ. nucleophilic substitution reaction) реакции замещения, в которых атаку осуществляет нуклеофил реагент, несущий неподеленную электронную пару.[1] Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг. Все … Википедия
Реакции присоединения — (англ. addition reaction) в органической химии так называются химические реакции, в которых одни химические соединения присоединяются к кратным (двойным или тройным) связям другого химического соединения. Присоединение может… … Википедия
Реакции замещения — (англ. substitution reaction) химические реакции, в которых одни функциональные группы, входящие в состав химического соединения, меняются на другие группы. Реакции замещения обозначают английской буквой «S». Общий вид реакций… … Википедия
Реакции электрофильного замещения — (англ. substitution electrophilic reaction) реакции замещения, в которых атаку осуществляет электрофил частица, заряженная положительно или имеющая дефицит электронов. При образовании новой связи уходящая частица электрофуг … Википедия
Реакции радикального замещения — (англ. substitution radical reaction) реакции замещения, в которых атаку осуществляют свободные радикалы частицы, содержащие один или несколько неспаренных электронов. Реакции радикального замещения обозначают SR. Содержание 1… … Википедия
Реакции элиминирования — Элиминирование (от лат. elimino изгоняю) это отщепление от молекулы органического соединения атомов или атомных групп без замены их другими. Реакция элиминирования может проходит в одну стадию (по механизму E2), либо в две стадии … Википедия
ПРИСОЕДИНЕНИЯ РЕАКЦИИ — ПРИСОЕДИНЕНИЯ РЕАКЦИИ, химические реакции, в ходе которых из двух или более веществ образуется новое сложное вещество (см. СЛОЖНОЕ ВЕЩЕСТВО): CaO + CO2 ® CaCO3. Различают гомолитическое (см. ГОМОЛИТИЧЕСКИЕ РЕАКЦИИ) и гетеролитическое (см.… … Энциклопедический словарь
Источник
Реакции нуклеофильного присоединения к карбонильной группе альдегидов и кетонов
Вы будете перенаправлены на Автор24
Двойная связь между атомами углерода и кислорода в карбонильной $C = O$ группе сильно поляризована:
Что обьясняется большим различием в электроотрицательности атомов кислорода и углерода. Следствием высокой полярности карбонильной группы является то, что альдегиды и кетоны обладают большими дипольными моментами. В табл. 1 приведены значения дипольных моментов для четырех самых распространенных карбонильных соединений.
То, что карбонильная группа обладает высокой полярностью определяет ход реакций присоединения разнообразных полярных реагентов по кратной $C = O$ связи. В реакциях присоединения по карбонильной группе ключевой стадией является присоединение нуклеофилов к электронодефицитным атомам углерода. Нуклеофильные агенты атакуют карбонильные атомы углерода по направлению перпендикулярному плоскости двойной связи, при этом атомы углерода изменяют свою гибридизацию с $sp^2$ до $sp^3$ в промежуточных тетраэдрическиз интермедиатах:
Механизм реакций нуклеофильного присоединения
Механизм реакций нуклеофильного присоединения обусловлен полярностью связи $C = O$, которая обеспечивает возникновение электрофильного ($C^<\delta+>$) и основного центров ($:O:$).
Готовые работы на аналогичную тему
Большинство реакций $A_N$ протекает по одной из схем:
В первом случае нуклеофил атакует электрофильный центр ($C^<\delta+>$), в результате чего $\pi$- связь $C = O$ разрывается, а пара электронов, которые образовывали $\pi$- связь, переходит на атом кислорода, на котором возникает полный отрицательный заряд. Карбонильный атом углерода приобретает $sp3$-гидридизованое состояние и образует $\sigma$- связь с нуклеофилом ($C-Nu$). Промежуточное соединение — оксониевий анион — является сильным основанием, поэтому он легко взаимодействует с любой кислотой, даже с $H_2O$, отщепляя от них и присоединяя к себе протон.
Карбонильный атом углерода приобретает $sp3$-гидридизованого состояния и образует Промежуточное соединение — оксониевий анион — есть сильным основанием, поэтому он легко взаимодействует с любой кислотой, даже с $H_2O$, отщепляя от них и присоединяя к себе протон.
По другой схеме механизма $AN$ на первой стадии происходит кислотный катализ — взаимодействие карбонильного атома кислорода с протоном $H^+$ и образования карбкатиона, с полным положительным зарядом на атоме углерода, который переходит в $sp3$-гибридизованое состоянии и на второй стадии подвергается атаке нуклефилом.
Влияние заместителей на ход реакции нуклеофильного присоединения к карбонильной группе
В обоих случаях лимитирующей стадией, определяющей скорость взаимодействия по механизму $AN$ в целом, является присоединение нуклеофила. Поэтому понятно, что характер протекания реакции обусловлен величиной положительным зарядом на карбонильном атоме углерода, который зависит от строения углеводородного радикала и природы заместителей. Электроноакцепторные заместители ($Hal$, $OH$, $NH_2$, $SH$ и т.д.) оттягивают от карбонильного углерода электронную плотность, увеличивая положительный заряд на нем, и облегчают и ускоряют протекание реакций $AN$. Электронодонорные заместители ($C_nH_<2n+1>$), наоборот, за счет положительного индуктивного эффекта ($+I$) смещают электронную плотность в сторону атома углерода $+I$ эффект карбонильной группы на нем уменьшается, а это замедляет ход реакций $AN$. По этой причине кетоны менее реакционноспособные, чем альдегиды, поскольку суммарный электронодонорный эффект двух радикалов в кетонах сильнее по сравнению с одним радикалом в молекуле альдегида.
Влияние строения соединений на ход реакции нуклеофильного присоединения к карбонильной группе
Ароматические оксосоединения тоже проявляют меньшую активность в реакциях нуклеофильного присоединения. Это объясняется $\pi$, $\pi$-сопряжением бензольного кольца с карбонильной группой, в результате чего наблюдается заметное уменьшение частичного положительного заряда на карбонильном атома углерода.
На реакционную способность оксосоединений влияют и стерические факторы: объемные радикалы затрудняют атаку нуклеофилом карбонильного атома углерода и, следовательно, снижают скорость реакции.
Алициклические кетоны проявляют высокую реакционную способность по сравнению с их алифатическими аналогами, что объясняется отсутствием вращения метиленовых групп $CH_2$ вокруг $\sigma$-связей в циклах, то есть меньшими конформационными возможностями.
Подытоживая рассмотренные факторы, можно расположить отдельные типы карбонильных соединений в ряды по их активности в реакциях нуклеофильного присоединения.
Уменьшение реакционной способности в реакциях $AN$:
По длине углеводородного радикала
$H-HC=O$ $>$ $CH_3-CH=O$ $>$ $CH_3-CH_2-CH=O$ $>$ $CH_3-(CH_2)_n-CH=O$
По количеству электроноакцепторных заместителей
$CCl_3-CH=O$ $>$ $CHCl_2=O$ $>$ $CH_2Cl-CH=O$ $>$ $CH_3-CH=O$
По расположению электроноакцепторных заместителей
По природе заместителя
$CH_3-CHCl-CH=O$ $>$ $CH_3-CH_2-CH=O$ $>$ $CH_3-CH(CH_3)-CH=O$
По положению карбонильной группы
По стерическим и конформационным факторам
При наличии ароматичности
Уменьшение реакционной способности в реакциях $A_N$
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 24 02 2021
Источник