- Что такое нейтральный атом? (С примерами)
- Нейтральный атом против иона
- На против На +
- примеров
- кислород
- Молекула — Molecule
- СОДЕРЖАНИЕ
- Молекулярная наука
- История и этимология
- Склеивание
- Ковалентный
- Ионный
- Размер молекулы
- Молекулярные формулы
- Типы химических формул
- Структурная формула
- Молекулярная геометрия
- Молекулярная спектроскопия
- Теоретические аспекты
Что такое нейтральный атом? (С примерами)
нейтральный атом это то, что испытывает недостаток в электрическом заряде из-за компенсации между числом его протонов и электронов. Оба являются электрически заряженными субатомными частицами.
Протоны агломерированы рядом с нейтронами и составляют ядро; в то время как электроны рассеиваются путем определения электронного облака. Когда число протонов в атоме, равное его атомному номеру (Z), равно числу электронов, говорят, что между электрическими зарядами внутри атома есть компенсация.
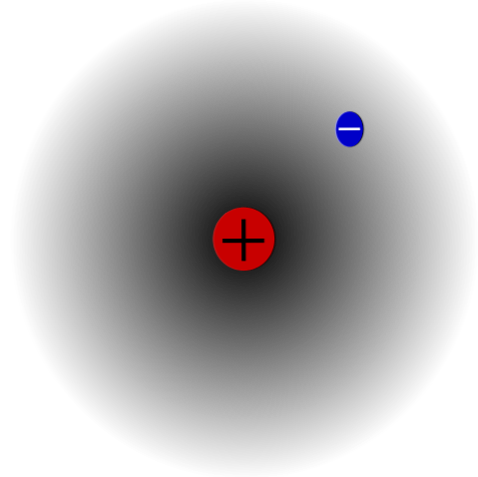
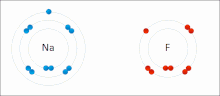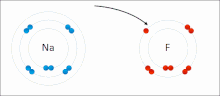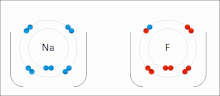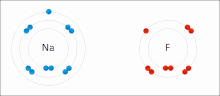
Например, есть атом водорода (верхнее изображение), в котором есть протон и электрон. Протон расположен в центре атома как его ядро, в то время как электрон вращается вокруг окружающего пространства, оставляя области с меньшей электронной плотностью по мере удаления от ядра..
Это нейтральный атом, потому что верно, что Z равно числу электронов (1p = 1e). Если бы атом Н потерял этот единственный протон, атомный радиус уменьшился бы, и заряд протона превалировал бы, превращаясь в катион Н. + (Hydron). С другой стороны, если он получит электрон, то будет два электрона и он станет анионом H — (Гидридные).
- 1 нейтральный атом против иона
- 1,1 Na против Na+
- 2 нейтральные молекулы
- 3 примера
- 3.1 Кислород
- 3.2 Медь
- 3.3 Благородные газы
- 3.4 Металлические сплавы
- 4 Ссылки
Нейтральный атом против иона
На примере нейтрального атома H было установлено, что число протонов равно числу электронов (1p = 1e); ситуация, которая не происходит с ионами, полученными потеря или усиление электрона.
Ионы образуются в результате изменения числа электронов, потому что атом выигрывает их (-) или теряет их (+).
В атоме катиона Н + Валентный заряд одиночного протона преобладает перед полным отсутствием электрона (1p> 0e). Это верно для всех других более тяжелых атомов (np> ne) периодической таблицы.
Хотя наличие положительного заряда может показаться незначительным, оно по диагонали меняет характеристики рассматриваемого элемента.
С другой стороны, в атоме аниона Н — Отрицательный заряд двух электронов преобладает перед одноядерным протоном (1р + и H — они полностью отличаются от H.
На против На +
Более известным примером является металлический натрий. Его нейтральный атом Na с Z = 11 имеет 11 протонов; следовательно, должно быть 11 электронов для компенсации положительных зарядов (11p = 11e).
Натрий, будучи металлическим элементом, обладает высокой электроположительностью, очень легко теряет свои электроны; в этом случае он теряет только одну — свою валентную оболочку (11p> 10e). Таким образом, образуется катион Na + , который электростатически взаимодействует с анионом; как хлорид, Cl — , в соли натрия хлорид, NaCl.
Металлический натрий ядовит и разъедает, в то время как его катион присутствует даже внутри клеток. Это показывает, как свойства элемента могут резко меняться, когда он получает или теряет электроны.
С другой стороны, анион Na — (soduro, гипотетически) не существует; и чтобы быть в состоянии сформироваться, это было бы чрезвычайно реактивно, так как это против химической природы натрия, чтобы получить электроны. На — будет иметь 12 электронов, превосходящих положительный заряд его ядра (11p + , с другой стороны, он имеет атом кислорода с частичным положительным зарядом. Это означает, что в этом многоатомном ионе он теряет электрон, и поэтому его число протонов больше, чем у его электронов..
примеров
кислород
Нейтральный атом кислорода имеет 8 протонов и 8 электронов. Когда он получает два электрона, он образует так называемый оксид аниона, ИЛИ 2- . В нем преобладают отрицательные заряды, имеющие избыток двух электронов (8р + , или медь, Cu 2+ , соответственно.
Катион Cu + имеет на один электрон меньше (29р 2+ потерял два электрона (29p
Источник
Молекула — Molecule
Молекула является электрически нейтральная группа из двух или более атомов , удерживаемых вместе химическими связями . Молекулы отличаются от ионов отсутствием электрического заряда .
В квантовой физике , органической химии и биохимии отличие от ионов опускается, а слово «молекула» часто используется, когда речь идет о многоатомных ионах .
В кинетической теории газов термин « молекула» часто используется для обозначения любой газовой частицы независимо от ее состава. Это нарушает определение, что молекула содержит два или более атомов, поскольку благородные газы являются отдельными атомами.
Молекула может быть гомоядерной , то есть состоять из атомов одного химического элемента , как из двух атомов в молекуле кислорода (O 2 ); или он может быть гетероядерным , химическим соединением, состоящим из более чем одного элемента, как в случае с водой (два атома водорода и один атом кислорода; H 2 O).
Атомы и комплексы, связанные нековалентными взаимодействиями , такими как водородные или ионные связи , обычно не считаются одиночными молекулами.
Молекулы как компоненты материи обычны. Они также составляют большую часть океанов и атмосферы. Большинство органических веществ представляют собой молекулы. Вещества жизни — это молекулы, например белки, аминокислоты, из которых они состоят, нуклеиновые кислоты (ДНК и РНК), сахара, углеводы, жиры и витамины. Питательные минералы обычно не являются молекулами, например сульфатом железа.
Однако большинство известных нам твердых веществ на Земле не состоит из молекул. К ним относятся все минералы, из которых состоит вещество Земли, почва, грязь, песок, глина, галька, камни, валуны, коренные породы , расплавленные недра и ядро Земли . Все они содержат много химических связей, но не состоят из идентифицируемых молекул.
Никакая типичная молекула не может быть определена ни для солей, ни для ковалентных кристаллов , хотя они часто состоят из повторяющихся элементарных ячеек, которые простираются либо в плоскости , например, графена ; или трехмерно, например алмаз , кварц , хлорид натрия . Тема повторяющейся элементарной ячеистой структуры также актуальна для большинства металлов, которые представляют собой конденсированные фазы с металлическими связями . Таким образом, твердые металлы не состоят из молекул.
В стеклах , которые представляют собой твердые тела, которые существуют в стекловидном неупорядоченном состоянии, атомы удерживаются вместе химическими связями без присутствия какой-либо определяемой молекулы или какой-либо регулярности повторяющейся элементарной ячеистой структуры, которая характерна для солей, ковалентных кристаллов и металлы.
СОДЕРЖАНИЕ
Молекулярная наука
Наука о молекулах называется молекулярной химией или молекулярной физикой , в зависимости от того, находится ли в центре внимания химия или физика. Молекулярная химия имеет дело с законами, управляющими взаимодействием между молекулами, которое приводит к образованию и разрыву химических связей , в то время как молекулярная физика имеет дело с законами, регулирующими их структуру и свойства. Однако на практике это различие нечеткое. В молекулярных науках молекула состоит из стабильной системы ( связанного состояния ), состоящей из двух или более атомов . Многоатомные ионы иногда можно рассматривать как электрически заряженные молекулы. Термин нестабильная молекула используется для очень реактивных частиц, то есть короткоживущих ансамблей ( резонансов ) электронов и ядер , таких как радикалы , молекулярные ионы , ридберговские молекулы , переходные состояния , ван-дер-ваальсовы комплексы или системы сталкивающихся атомов, как в Конденсат Бозе – Эйнштейна .
История и этимология
Согласно Merriam-Webster и Интернет-этимологическому словарю , слово «молекула» происходит от латинского « моль » или малая единица массы.
- Молекула (1794) — «чрезвычайно мелкие частицы», от французской Молекулы (1678), из Нью — латинскоймолекулы , уменьшительная от латинского моль «масса, барьерного». Сначала смутное значение; Мода на это слово (использовавшееся до конца 18 века только в латинской форме) восходит к философии Декарта .
Определение молекулы эволюционировало по мере расширения знаний о структуре молекул. Ранние определения были менее точными, определяя молекулы как мельчайшие частицы чистых химических веществ, которые все еще сохраняют свой состав и химические свойства. Это определение часто не работает, поскольку многие вещества в обычном опыте, такие как горные породы , соли и металлы , состоят из больших кристаллических сетей из химически связанных атомов или ионов , но не состоят из дискретных молекул.
Склеивание
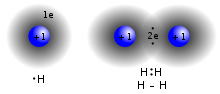
Молекулы удерживаются вместе либо ковалентной связью, либо ионной связью . Некоторые типы неметаллических элементов существуют только в виде молекул в окружающей среде. Например, водород существует только в виде молекулы водорода. Молекула соединения состоит из двух или более элементов. Молекула гомоядерной выполнена из двух или более атомов одного элемента.
В то время как некоторые люди говорят, что металлический кристалл можно рассматривать как одну гигантскую молекулу, удерживаемую металлическими связями , другие указывают, что металлы действуют совсем иначе, чем молекулы.
Ковалентный
Ковалентная связь — это химическая связь, которая включает обмен электронными парами между атомами . Эти электронные пары называются общими парами или связующими парами , а стабильный баланс сил притяжения и отталкивания между атомами, когда они разделяют электроны, называется ковалентной связью .
Ионный
Ионная связь — это тип химической связи, которая включает электростатическое притяжение между противоположно заряженными ионами и является первичным взаимодействием, происходящим в ионных соединениях . Ионы — это атомы, потерявшие один или несколько электронов (называемые катионами ), и атомы, которые приобрели один или несколько электронов (называемые анионами ). Этот перенос электронов называется электровалентностью в отличие от ковалентности . В простейшем случае катион представляет собой атом металла, а анион — атом неметалла , но эти ионы могут иметь более сложную природу, например, молекулярные ионы, такие как NH 4 + или SO 4 2– .
При нормальных температурах и давлениях ионная связь в основном создает твердые тела (или иногда жидкости) без отдельных идентифицируемых молекул, но испарение / сублимация таких материалов действительно производит небольшие отдельные молекулы, в которых электроны все еще переносятся достаточно полно, чтобы связи считались ионными, а не ковалентными. .
Размер молекулы
Большинство молекул слишком малы, чтобы их можно было увидеть невооруженным глазом, хотя молекулы многих полимеров могут достигать макроскопических размеров, включая биополимеры, такие как ДНК . Молекулы, обычно используемые в качестве строительных блоков для органического синтеза, имеют размер от нескольких ангстрем (Å) до нескольких десятков Å, или около одной миллиардной метра. Одиночные молекулы обычно нельзя наблюдать с помощью света (как отмечалось выше), но небольшие молекулы и даже очертания отдельных атомов в некоторых случаях можно проследить с помощью атомно-силового микроскопа . Некоторые из самых больших молекул — это макромолекулы или супермолекулы .
Самая маленькая молекула — двухатомный водород (H 2 ) с длиной связи 0,74 Å.
Эффективный радиус молекулы — это размер молекулы в растворе. Таблица для селективной проницаемости различных веществ содержит примеры.
Молекулярные формулы
Типы химических формул
В химической формуле молекулы используется одна строка символов химических элементов , чисел, а иногда и других символов, таких как круглые скобки, тире, скобки и знаки плюс (+) и минус (-). Они ограничены одной типографской строкой символов, которая может включать подстрочные и надстрочные индексы.
Эмпирическая формула соединения — это очень простой тип химической формулы. Это простейшее целочисленное соотношение составляющих его химических элементов . Например, вода всегда состоят из соотношении 2: 1 водорода к кислородным атомам, и этанол (этиловый спирт) всегда состоит из углерода , водорода и кислорода в соотношении 2: 1: 6. Однако это не определяет однозначно вид молекулы — диметиловый эфир имеет такие же соотношения, как, например, этанол. Молекулы с одинаковыми атомами в разном расположении называются изомерами . Также углеводы, например, имеют одинаковое соотношение (углерод: водород: кислород = 1: 2: 1) (и, следовательно, ту же эмпирическую формулу), но разное общее количество атомов в молекуле.
Молекулярная формула отражает точное число атомов, составляющих молекулу и так характеризует различные молекулы. Однако разные изомеры могут иметь одинаковый атомный состав, будучи разными молекулами.
Эмпирическая формула часто совпадает с молекулярной формулой, но не всегда. Например, молекула ацетилена имеет молекулярную формулу C 2 H 2 , но простейшее целочисленное соотношение элементов — CH.
Молекулярная масса может быть вычислена по химической формуле и выражается в обычных атомных единицах массы равна 1/12 массы нейтрального углерода-12 ( 12 С изотопом ) атом. Для твердых тел в сети термин « формульная единица» используется в стехиометрических расчетах.
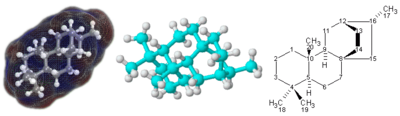
Структурная формула
Для молекул со сложной трехмерной структурой, особенно с атомами, связанными с четырьмя различными заместителями, простой молекулярной формулы или даже полуструктурной химической формулы может быть недостаточно, чтобы полностью определить молекулу. В этом случае может потребоваться формула графического типа, называемая структурной формулой . Структурные формулы, в свою очередь, могут быть представлены с одномерным химическим названием, но такая химическая номенклатура требует множества слов и терминов, которые не являются частью химических формул.
Молекулярная геометрия
Молекулы имеют фиксированную равновесную геометрию — длину связей и углы, вокруг которых они непрерывно колеблются посредством колебательных и вращательных движений. Чистое вещество состоит из молекул с одинаковой средней геометрической структурой. Химическая формула и структура молекулы — два важных фактора, которые определяют ее свойства, особенно ее реакционную способность . Изомеры имеют общую химическую формулу, но обычно имеют очень разные свойства из-за разной структуры. Стереоизомеры , особый тип изомеров, могут иметь очень похожие физико-химические свойства и в то же время различную биохимическую активность.
Молекулярная спектроскопия
Молекулярная спектроскопия изучает отклик ( спектр ) молекул, взаимодействующих с зондирующими сигналами известной энергии (или частоты , согласно формуле Планка ). Молекулы имеют квантованные уровни энергии, которые можно анализировать, обнаруживая энергообмен молекулы через поглощение или излучение . Спектроскопия обычно не относится к дифракционным исследованиям, в которых частицы, такие как нейтроны , электроны или рентгеновские лучи высокой энергии, взаимодействуют с регулярным расположением молекул (как в кристалле).
Микроволновая спектроскопия обычно измеряет изменения во вращении молекул и может использоваться для идентификации молекул в космическом пространстве. Инфракрасная спектроскопия измеряет колебания молекул, включая движения растяжения, изгиба или скручивания. Он обычно используется для определения типов связей или функциональных групп в молекулах. Изменения в расположении электронов приводят к появлению линий поглощения или излучения в ультрафиолетовом, видимом или ближнем инфракрасном свете, а также к цвету. Спектроскопия ядерного резонанса измеряет окружение конкретных ядер в молекуле и может быть использована для характеристики количества атомов в различных положениях в молекуле.
Теоретические аспекты
Изучение молекул методами молекулярной физики и теоретической химии в значительной степени основано на квантовой механике и важно для понимания химической связи . Простейшей из молекул является ионная молекула водорода H 2 + , а самой простой из всех химических связей является одноэлектронная связь . H 2 + состоит из двух положительно заряженных протонов и одного отрицательно заряженного электрона , что означает, что уравнение Шредингера для системы может быть решено более легко из-за отсутствия электрон-электронного отталкивания. С развитием быстрых цифровых компьютеров приблизительные решения для более сложных молекул стали возможными и являются одним из основных аспектов вычислительной химии .
Пытаясь строго определить, достаточно ли стабильно расположение атомов, чтобы его можно было рассматривать в качестве молекулы, IUPAC предполагает, что оно «должно соответствовать углублению на поверхности потенциальной энергии, которое является достаточно глубоким, чтобы удерживать хотя бы одно колебательное состояние». Это определение не зависит от характера взаимодействия между атомами, а только от силы взаимодействия. В самом деле, он включает в себя слабо связанные видов , которые не будут традиционно считаться молекулами, такими как гелием димером , He 2 , который имеет одну колебательного связанное состояние и так свободно связан , что только вероятно, будет наблюдаться при очень низких температурах.
Является ли расположение атомов достаточно стабильным, чтобы его можно было рассматривать как молекулу, по сути является рабочим определением. Следовательно, с философской точки зрения молекула не является фундаментальной сущностью (в отличие, например, от элементарной частицы ); скорее, концепция молекулы — это способ химика сделать полезное заявление о силе взаимодействий на атомном уровне в мире, который мы наблюдаем.
Источник