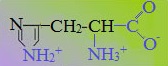- Классификация аминокислот по полярности радикалов
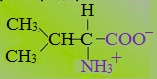
- Аминокислоты с неполярными радикалами
- Что значит неполярный радикал
- I. Классификация по взаимному положения функциональных групп
- II. Классификация по строению бокового радикала (функциональным группам)
- III. Классификация по полярности бокового радикала (по Ленинджеру)
- IV. Классификация по кислотно-основным свойствам
- V. По числу функциональных групп
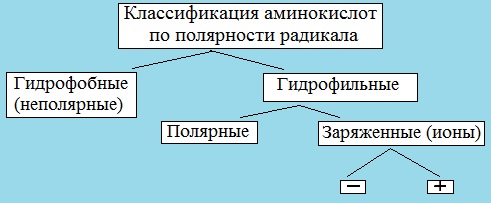
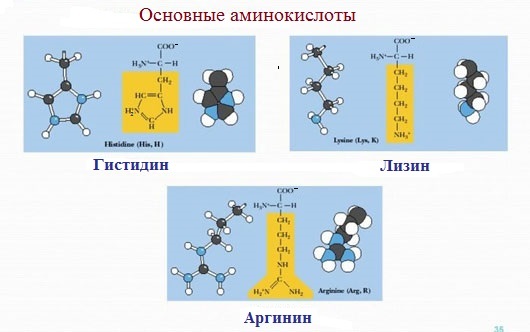
Классификация аминокислот по полярности радикалов
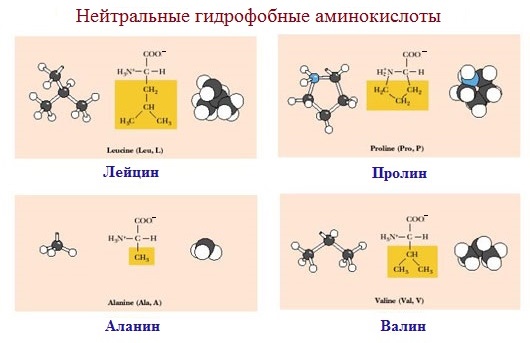
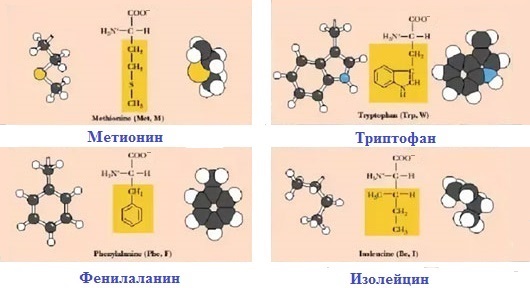
1. Неполярные аминокислоты (аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин). Эти аминокислоты гидрофобны. Имеют незаряженный радикал. При сближении в пространстве радикалы этих аминокислот обеспечивают гидрофобное взаимодействие.
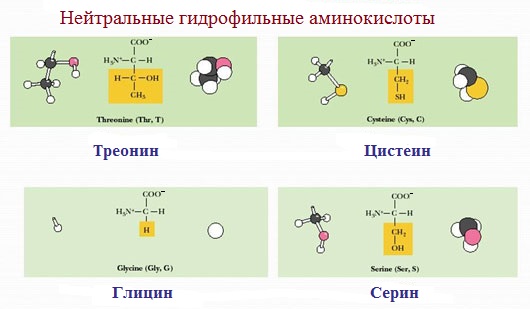
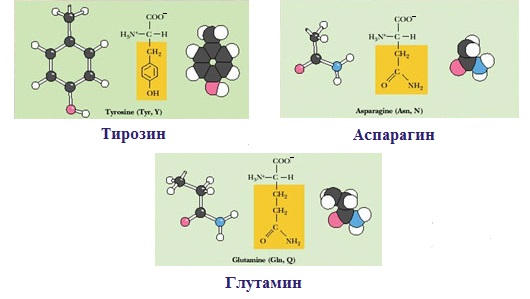
2. Полярные, гидрофильные, незаряженные аминокислоты (глицин, треонин, цистеин, тирозин, серин, аспарагин, глутамин). Содержат такие полярные функциональные группы как гидроксильная, сульфгидрильная и амидогруппа. При сближении в пространстве радикалы этих аминокислот образуют водородные связи. Связанные дисульфидной связью два остатка цистеина называют цистином.
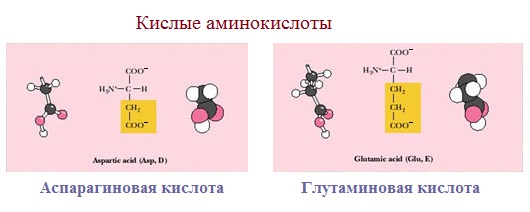
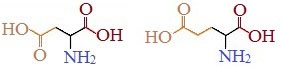
3. Кислые аминокислоты (отрицательно заряженные аминокислоты) имеют отрицательный заряд (аспарагиновая и глутаминовая кислоты) при рН 7,0
4. Основные аминокислоты (положительно заряженные аминокислоты) имеют положительный заряд при рН 7,0.
Радикалы аминокислот 3 и 4 групп участвуют в образовании ионных связей.
Аминокислоты классифицируются на заменимые и незаменимые (эссенциальные).
1. Незаменимые (эссенциальные) аминокислоты не могут синтезироваться в организме и должны поступать с пищей. Они необходимы для обеспечения и поддержания роста: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин (шесть аминокислот 1-й группы, одна – второй и три – четвертой).
2. Заменимые аминокислоты. Организм может синтезировать около 10 аминокислот для обеспечения биологических потребностей, поэтому поступление их с пищей не обязательно (аланин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин, тирозин).
Аминокислоты, связанные пептидной связью, образуют полипептидную цепь и каждая аминокислота в ней называется аминокислотный остаток. В полипептиде выделяют N-конец (терминальная альфа-аминогруппа) и С-конец (терминальная альфа-карбоксильная группа). Большинство природных полипептидных цепей, содержащих от 50 до 2000 аминокислотных остатков, называют белками (протеинами). Полипептидные цепи меньшей длины называют олигопептидами или просто пептидами. В некоторых белках полипептидные цепи связываются поперечными дисульфидными связями, образованными окислением двух остатков цистеина. Внеклеточные белки часто содержат дисульфидные связи, а внутриклеточные белки часто утрачивают их. В некоторых белках образуются поперечные связи при взаимодействии радикалов других аминокислотных остатков (коллаген, фибрин).
Источник
Аминокислоты с неполярными радикалами



К неполярным (гидрофобным) относят радикалы, имеющие алифатические (открытые) углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается.
2. Аминокислоты с полярными незаряженными радикалами
Радикалы этих аминокислот лучше, чем гидрофобные радикалы, растворяются в воде, так как в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят серии, треонин и тирозин, имеющие гидроксильные (-ОН) группы, аспарагин и глутамин, содержащие амидные (-NH2) группы, и цистеин с его тиольной (-SH) группой, кроме этого глицин, R группа которого (-Н), слишком мала, чтобы компенсировать сильную полярность α-аминогруппы и α-карбоксильной группы
3. Аминокислоты с полярными отрицательно заряженными радикалами
Кэтой группе относятся аспарагиновая и глутаминовая кислоты, имеющие в радикале дополнительную кислотную (карбоксильную группу), при рН около 7,0 диссоциирующую с образованием СОО — и Н + . Следовательно., радикалы данных аминокислот — анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом.
4. Аминокислоты с полярными положительно заряженными радикалами
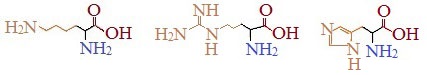
Дополнительную положительно заряженную группу в радикале имеют лизин и аргинин. У лизина вторая аминогруппа, а у аргинина положительный заряд приобретает гуанидиновая группа. Гистидин содержит слабо ионизированную имидазольную группу. При физиологических колебаниях значений рН (от 6,9 до 7,4) эти аминокислоты заряжены либо нейтрально, либо положительно.
в нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд. Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд, а аминокислоты, содержащие основные функциональные группы, — положительный заряд
Источник
Что значит неполярный радикал
Аминокислоты классифицируют по следующим структурным признакам.
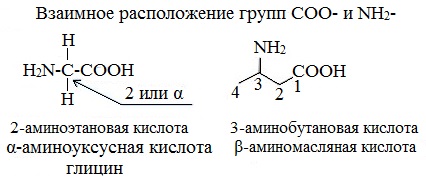
I. Классификация по взаимному положения функциональных групп
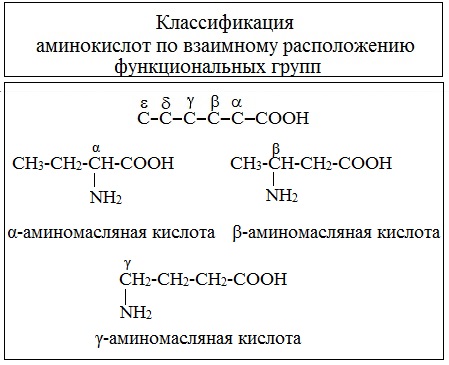
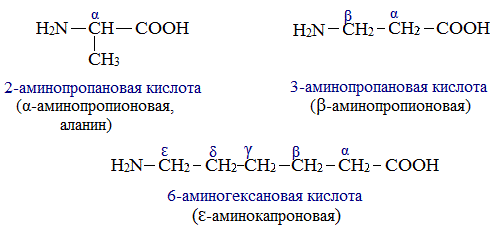
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)
Алифатические аминокислоты
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин.
Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты: триптофан, гистидин, пролин.
Иминокислоты: пролин.
III. Классификация по полярности бокового радикала (по Ленинджеру)
Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота:
— алифатические: аланин, валин, лейцин, изолейцин
— ароматические: фенилаланин, триптофан.
2. Полярные незаряженные
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
— полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
— амидную группу: глутамин, аспарагин
— и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
3. Заряженные отрицательно при рН-7 (кислые)
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.
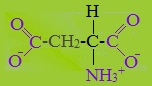
Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
4. Заряженные положительно при рН-7 (основные)
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.
В ионизированном виде они имеют суммарный положительный заряд:
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV. Классификация по кислотно-основным свойствам
В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных групп
Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:

Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.
Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
Источник