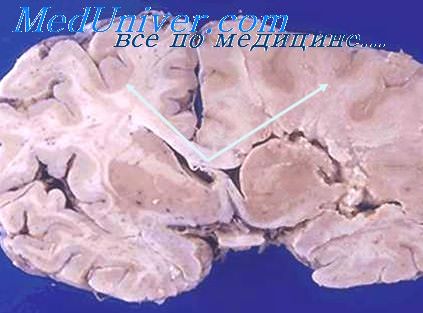
Что значит некроз мозга
Наряду с травматическими кровоизлияниями обнаруживают функциональные изменения сосудов. В первые минуты после травмы отмечают паралитическое расширение крупных, а затем мелких вен и венул (просветы их расширены, стенка равномерно истончена, адвентиций слабо контурируется, в просвете кровь). Такое острое венозное полнокровие выражено повсеместно и сохраняется долгое время.
У некоторых крупных вен в первые часы находят иногда небольшие перивенозные геморрагии или плазморрагии в виде полулуний. Крупные артерии (радиальные, их ветви) реагируют на травму спастическим состоянием (сосуд сжат, диаметр просвета уже толщины стенки, интима и эластическая мембрана складчатого, фестончатого вида, ядра эндотелия набухшие, располагаются подобно частоколу, на вершине складок уплощены, стенка сосуда отходит от мозговой ткани с образованием периваскулярной щели).
Степень изменений убывает в глубь мозговой ткани. Через несколько часов или к концу четвертых суток в этих сосудах начинает преобладать полнокровие, которое, однако, не достигает значительной степени, диапедезные геморрагии редки.
В мелких артериях и артериолах преобладают изменения по типу дистонии. Через 2—3 ч, иногда позднее она характеризуется змеевидной извитостью сосуда, чередованием в нем сужений и колбообразных расширений, набуханием эндотелия; местами имеется плазматическое пропитывание стенки, агрегация эритроцитов, наличие тромбов. Эти изменения больше выражены вблизи очага ушиба и имеют более широкое распространение, чем артериальный спазм.
Возникновение паралитического полнокровия происходит поэтапно и бывает хорошо выражено к началу 2-х суток.
В этом периоде иногда находят небольшие очажки ишемического некроза, которые соответствуют бассейну спазмированного сосуда. В таких очажках вследствие острого повышения проницаемости сосудистой стенки возникают диапедезные кровоизлияния. Мозговая ткань пропитывается кровью. Признаком длительного спастического состояния мелкой артерии может служить появление через 6—8 ч н позднее кольцевидных геморрагии, которые, однако, непостоянны.
Под микроскопом они имеют своеобразную картину: в центре обычно располагается мелкая артерия или артериола с плохо различимым просветом и измененной стенкой вследствие пропитывания ее плазмой (дольше сохраняются пикноморфные ядра эндотелия). Вокруг сосуда отмечают пояс коагуляционного некроза мозговой ткани, кнаружи от него — пояс гиперплазии макроглии. Эти изменения окружены кольцевидным экстравазатом.
Во внутреннем его слое эритроциты плотно прилежат друг к другу и находятся в различной степени гемолиза, в наружном слое они лучше сохранены, лежат рыхло, местами инфильтрируют мозговую ткань.
К 12—24 ч просвет артерий и артериол расширен, стенка местами в состоянии плазматического пропитывания, ядра эндотелия уплощены. Вокруг таких сосудов наблюдают так называемые истинные диапедезные кровоизлияния — типичный периваскулярный экстравазат из неизмененных эритроцитов, четко отграниченный глиально-сосудистой мембраной. Через 1—2 сут экстравазаты утрачивают четкость контуров вследствие разрушения мембраны и проникновения крови в мозговую ткань.
Отмечают явления гемолиза, появляются зерна бурого пигмента, нити фибрина, расплавление мозговой ткани с образованием лакун из гомогенной массы; некротизируется стенка сосуда. Примерно в эти сроки близко расположенные экстравазаты сливаются, и в дальнейшем в них отмечают признаки трансформации крови. Слиянию экстравазатов способствуют ишемический некроз, отек мозговой ткани, а также некробиотические изменения стенок сосудов.
Источник
Говорина Е.В., Щербенко О.И.. Российский научный центр рентгенорадиологии МЗ России (г. Москва).
Анализ мировой литературы показывает, что лучевая терапия остается обязательным компонентом лечебного комплекса при большинстве опухолей ЦНС, поскольку она позволяет девитализировать остатки опухоли после нерадикальной операции, и может быть самостоятельным методом при неоперабельных новообразованиях. В то же время, отсутствие значимых различий в радиочувствительности большинства новообразований ЦНС и самой ткани мозга, которая неизбежно подвергается облучению, при подведении канцероцидных доз радиации создает реальную угрозу развития лучевых повреждений.
Целью настоящего анализа литературы было изучение информации касающейся патогенеза и риска развития лучевых повреждений ткани головного мозга, факторов влияющих на развитие таких повреждений, методов дифференциальной диагностики повреждений от возобновления роста опухоли и вариантов лечения таких осложнений.
Наибольшее число публикаций посвящено изменениям нейро-физиологических параметров у больных получавших облучение головного мозга.
В работах многих авторов (1,2,3,4,5,6,7,8,9,10,11,12,13), сравнивавших состояние интеллекта у детей больных опухолями мозга получавших ЛТ и не получавших ее, отмечено, что после облучения как у детей так и взрослых с высокой частотой снижались показатели интеллектуальных возможностей в виде ухудшения долговременной памяти, внимания и зрительно-пространственного восприятия, нарушения процессов узнавания визуальных образов, быстрой утомляемости и истощаемости при эмоциональных и умственных нагрузках. Наблюдалось также учащение проявлений депрессии и жалоб на слабость. Отмечено также, что при облучении левого полушария чаще страдает память, а правого – распознавание образов (5). Эти изменения были более выраженными у больных получавших лучевую терапию в возрасте до 7 лет (2) и старше 50 лет (9). По данным авторов работы (11), из 25 больных облучавшихся по поводу глиомы мозга, у 40% показатели интеллекта сохранялись в норме, у 28% имелись умеренные нарушения и у 32% нарушения были тяжелыми.
Хотя, по мнению авторов публикации (14), вклад облучения в нарушение функции мозга невелик и эти нарушения в большей мере связаны с влиянием опухоли и хирургического вмешательства, морфологические изменениями, выявляемые у больных получавших облучение головного мозга значительны. Так в работах (15,16) у больных, подвергавшихся лучевой терапии по поводу опухоли мозга, признаки атрофии мозга выявлялись как при компьютерной томографии, так и при оценке объема спинно-мозговой жидкости как критерия атрофии ткани мозга. При этом указанные признаки начинали проявляться уже через 2-3 месяца после облучения. Роль облучения в развитии атрофии мозга показана в работе (16), в которой сравнивалась частота выявления атрофии у 23 больных глиомой получавших лучевую терапию и у 17 не получавших. В первой группе атрофия мозга выявлена в 61% случаев, а во второй только у 6%. Вероятность развития атрофии мозга возрастает после проведения повторного облучения. Так в работе (17) описано 6 случаев подострой атрофии, которая выражалась расстройством сознания и непроизвольными движениями, а на компьютерных томограммах констатировалось расширение желудочков и борозд, а также повышение интенсивности сигнала.
Патогенез развития лучевых повреждений мозга связывается с процессами демиэлинизации , в основе которой лежит повреждение сосудов (18,19,20,21,22,23), приводящее к нарушению кровоснабжения и повышению проницаемости сосудистой стенки. Так при гистологическом исследовании мозга троих умерших от лучевого некроза мозга (24) обнаруживался некроз белого вещества, разрушение осевых цилиндров, в сосудах гипертрофия эндотелия. При этом серое вещество, как правило, не имеет микроскопически определяемых повреждений, а изменения белого вещества преимущественно расположены вдоль глубоких перфорирующих артерий (24). В другой работе (20), основанной на результатах аутопсий 34 детей умерших после облучения головного мозга или всего объема ЦНС в дозе 40 Гр , выявлена демиэлинизация нервных волокон, в 4-х пролиферация эндотелия с закупоркой сосудов и развитием ишемических инсультов, в 6 очаговые некрозы коры. Демиэлинизация и очаговые некрозы чаще развивались через 9 месяцев и достигали максимума через год после облучения. В более поздние сроки (через 5 лет) выявлялись кальцификаты . Сами атрофические изменения могут прогрессировать в течение трех лет, после чего наступает их стабилизация (25). Повреждение сосудов отражается и в снижении кровотока соответственно зоне облучения, при этом степень снижения кровотока коррелирует с объемом облучавшихся тканей (26).Повреждение сосудов может приводить к ускорению процессов развития атеросклероза сосудов мозга (27).
Распространенность и глубина морфологических изменений мозга после облучения зависит не только от возраста, но и от условий лучевой терапии – размеров зоны облучения, величины фракций и суммарной дозы облучения. Чем больше размеры зоны облучения и больше разовая и суммарная доза, тем чаще
наблюдаются симптомы лучевых повреждений мозга (28,29). Особенно высока вероятность повреждений при облучении опухоли дозой 60 Гр в условиях использования разовых фракций 1,8-2 Гр. Увеличение ежедневной дозы облучения или применение варианта ускоренного фракционирования приводит к возрастанию риска повреждения (30,31), в то время как дробление дневной дозы на две фракции по 1-1,1 Гр уменьшает риск лучевого повреждения мозга даже после облучения в больших дозах. Так в публикации (29) облучение больных 70 опухолью носоглотки в режиме мультифракционирования (по 1,2 Гр х 2 раза в день) до суммарной дозы 80 Гр не привело к развитию некроза височных долей мозга ни у одного из больных, в то время как облучение в режиме ускоренного фракционирования (по 1,6 Гр х 2 раза в день до суммарной дозы 68,4-76,4 Гр привело к развитию такого осложнения у трех из 11 больных (27%).
Вероятность развития лучевых повреждений мозга возрастает и при сочетании лучевой терапии с химиотерапией. Авторы работы (33)сообщили, что из 148 больных глиомой получивших химиолучевое лечение (сочетание лучевой терапии и химиотерапии карбоплатином ) при последующем динамическом наблюдении у 20 выявлен некроз ткани мозга, у 16 сочетание некроза с рецидивом опухоли, у двоих некроз черепно-мозговых нервов. Описан даже случай развития тяжелой миэлопатии у 5-летнего ребенка после краниоспинального облучения в дозе 24 Гр в сочетании с интратекальной химотерапия метотрексатом и цитарабином (31). Особенно токсично для ткани мозга сочетание внутриартериальной химиотерапии и облучения (32).
Сроки развития некроза мозга зависят от величины суммарной дозы. Так в работе (34), авторы которой проследили судьбу 106 больных при суммарной дозе эквивалентной 70 единиц ВДФ некроз развивается через 40-60 месяцев, а при дозе 100 ед. – через 10-20 месяцев.
Клинические проявления лучевого повреждения головного мозга обычно симулируют продолженный рост опухоли и дифференциальная диагностика в таких случаях чрезвычайно важна, поскольку необоснованное назначение повторной цитотоксической терапии только усугубляет тяжесть нарушений. В этих условиях на первый план выступают инструментальные методы диагностики – компьютерная, магнитно-резонансная и позитронно-эмиссионная томография, радиоизотопные исследования. Возможности компьютерной томографии для дифференциальной диагностики ограничены в связи с сопутствующим зоне некроза перифокальным отеком, часто в сочетании с остатком опухоли. Тем не менее, на КТ без контрастного усиления выявляется зона сниженной плотности ткани не накапливающая контраст и без масс-эффекта (25,35,36,37).
Возможности магнитно-резонансной томографии (МРТ) в дифференциальной диагностике продолженного роста опухоли от лучевых повреждений несколько шире, чем КТ. При этом зона патологических изменений на МРТ обычно больше, чем на КТ. В режиме Т 2 изменения на МРТ выглядят как зона усиления сигнала (38). При трактовке данных МРТ и КТ необходимо учитывать время развития симптоматики и локализацию выявленных изменений. Если продолженный рост опухоли возникает обычно через 4-8 месяцев после окончания лучевой терапии, то лучевой некроз, как правило, развивается в более поздние сроки.
Более информативна в дифференциальной диагностике этих состояний позитронно-эмиссионная томография (ПЭТ), которая позволяет определить зоны повышенного метаболизма, соответствующие активной опухоли, и зоны отсутствия метаболизма, отражающие участки некротических изменений (32,39). По данным авторов работы (40), в которой сопоставлены данные ПЭТ и стереотаксической биопсии, чувствительность ПЭТ составила 43% и специфичность 100%. При этом ложно-положительные результаты в основном получены при объеме пораженной зоны более 10 куб .с м и ложно-отрицательные при объеме менее 6 куб.см..
Имеются отдельные сообщения об эффективности использования для дифференциальной диагностики магнитно-резонансной спектроскопии (41) и однофотонной сцинтиграфиии с меченым технецием-99м гексаметилпропилен амином (42).
Лечение лучевых повреждений мозга представляет трудную и часто неразрешимую задачу. Его успех в существенной мере зависит от локализации и распространенности зоны некроза. При ограниченном некрозе хороший результат удается получить при хирургическом удалении пораженного участка мозга (43, 44). В качестве консервативного лечения рекомендуется применение кортикостероидных препаратов и антикоагулянтов на фоне симптоматической терапии. Применение гипербарической оксигенации в некоторых случаях позволяет получить положительный эффект. Так в работе (45) сообщается, что после проведения 30 сеансов ГБО у 7 больных получено: у одного значительное улучшение мыслительных функций и у 6 -некоторое улучшение. По мнению авторов работы (46), если при лучевых повреждениях костей и мягких тканей ГБО весьма эффективно, то ее эффективность при повреждениях ткани мозга нуждается в подтверждении.
Подводя итог данному обзору, можно сделать некоторые выводы:
1. Отсутствие значимой разницы в радиочувствительности наиболее часто встречающихся опухолей мозга и окружающих тканей делает опасность лучевых повреждений при подведении радикальных доз радиации вполне реальной и их тяжесть может быть сопоставима с симптомами самой опухоли. Риск развития повреждений возрастает с увеличением разовых и суммарных доз облучения, облучаемого объема, при применении режимов облучения с ускоренным фракционированием, при сочетании лучевой и химиотерапии.
2. В дифференциальной диагностике лучевых повреждений от продолженного роста опухоли необходимо учитывать сроки возобновления симптомов поражения мозга, локализацию определяемого очага, результаты КТ, МРТ и ПЭТ. Однако ни один из перечисленных методов не позволяет с полной уверенностью проводить дифференциальную диагностику.
3. Радикальное лечение лучевых повреждений мозга может выражаться в удалении измененного участка. В качестве консервативных мер можно рекомендовать применение кортикостероидов, антикоагулянтов и гипербарической оксигенации , которые не всегда дают положительный результат.
4. Прецизионное планирование лучевой терапии с максимальным щажением здоровых тканей позволит уменьшить риск лучевых повреждений мозга.
Список литературы:
1. Moore B.D., Ater J.L., Copeland D.R.,et al .
Improved neuropsychological outcome in children with brain tumors diagnosed during infancy and treated without cranial irradiation.
J Child Neurol . -1992.-v.7.-N3,-p.281-290
2. Radcliffe J., Bunin G.R., Sutton L.N. , ,et al.
Cognitive deficits in long-term survivors of childhood medulloblastoma and other noncortical tumors: age-dependent effects of whole brain radiation.
Int J Dev Neurosci ,- 1994.-v.12.-N4,-p.327-334
3. Davies E., Clarke C., Hopkins A. ,et al.
Malignant cerebral glioma —I: Survival, disability, and morbidity after radiotherapy.
4. Merchant T.E., Kiehna E.N., Miles M.A., et al.
Acute effects of irradiation on cognition: changes in attention on a computerized continuous performance test during radiotherapy in pediatric patients with localized primary brain tumors.
Int J Radiat Oncol Biol Phys ,-2002.-v.153.-N5,-p.1271-1275
5. Armstrong C.L., Corn B.W., Ruffer J.E., et.al .
Radiotherapeutic effects on brain function: double dissociation of memory systems.
Neuropsychiatry Neuropsychol Behav Neurol ,- 2000.-v.13.-N2,-p.101-111.
6. Abayomi O., Chun M.S., Kelly K.,et al.
Cerebral calcification and learning disabilities following cranial irradiation for medulloblastoma .
J Nat. Med Assoc,- 1990.-v.82.-N12,-p.833-836.
7.Klein M., Heimans J.J., Aaronson N.K., et al.
Effect of radiotherapy and other treatment-related factors on mid-term to long-term cognitive sequelae in low-grade gliomas : a comparative study.
8.Taphoorn M.J., Schiphorst A.K., Snoek F.J., et al.
Cognitive functions and quality of life in patients with low-grade gliomas : the impact of radiotherapy.
Ann Neurol ,-1994.-v.36.-N1,-p.48-54.
9. Surma-aho O., Niemela M., Vilkki J.,et al.
Adverse long-term effects of brain radiotherapy in adult low-grade glioma patients.
Neurology,- 2001.-v. 22;56.-N10,-p.1285-1290.
10.Sichez N., Chatellier G., Poisson M.,et al.
Supratentorial gliomas : neuropsychological study of long-term survivors.
Rev Neurol (Paris),- 1996.-v.152.-N4,-p.261-266.
11. Takeda N., Tanaka R., Ibuchi Y., et al.
Progressive mental deterioration after radiotherapy in adult patients with brain tumors.
Gan No Rinsho,-1989.-v.35.-N11,-p.1330-1338.
12. Scheibel R.S., Meyers C.A. , Levin V.A. ,et al.
Cognitive dysfunction following surgery for intracerebral glioma : influence of histopathology, lesion location, and treatment.
13. Armstrong C.L., Hunter J.V., Ledakis G.E.,et al.
Late cognitive and radiographic changes related to radiotherapy: initial prospective findings.
14. Postma T.J, Klein M., Verstappen C.C., et al.
Radiotherapy-induced cerebral abnormalities in patients with low-grade glioma .
15.Asai A., Matsutani M., Takakura K.,et al.
Subacute brain atrophy induced by radiation therapy of malignant brain tumors.
Gan No Rinsho .- 1987.-v.33,-N7,-p.753-761
16. Asai A., Matsutani M., Kohno T., et al.
Subacute brain atrophy after radiation therapy for malignant brain tumor
17. Burger P.C., Mahley M.S. Jr., Dudka L.,et al.
The morphologic effects of radiation administered therapeutically for intracranial gliomas : a postmortem study of 25 cases.
18. Satran R., Lapham L.W., Kido D.R.,et al.
Late cerebral radionecrosis after conventional irradiation of cerebral tumors.
Rev Neurol , Paris.- 1984.-v.140,-N4,-p.249-255
19. Yoshii Y., Takano S., Tsurushima H., Hyodo A.,et al.
Normal brain damage after radiotherapy of brain tumours
Clin Oncol — 1991.- v.3.-N5,-p.278-282
20. Oi S., Kokunai T., Ijichi A., Matsumoto S., et al.
Radiation-induced brain damage in children—histological analysis of sequential tissue changes in 34 autopsy cases.
Neurol Med Chir (Tokyo) ,-1990.-v.30.-N1,-p.36-42
21.Mitomo M., Kawai R., Miura T., et al.
Radiation necrosis of the brain and radiation-induced cerebrovasculopathy .
Acta Radiol Suppl ,-1986.-v.369,-p.227-230.
22. Llena J.F., Cespedes G., Hirano A., et al.
Vascular alterations in delayed radiation necrosis of the brain. An electron microscopical study.
Arch Pathol Lab Med ,-1976.-v.100.-N10,-p.531-534.
23.Matsumura H., Ross E.R.,et al.
Delayed cerebral radionecrosis following treatment of carcinoma of the scalp: clinicopathologic and ultrastructural study.
Surg Neurol ,-1979.-v.12.-N3,-p.193-204.
24. Martins A.N., Johnston J.S., Henry J.M.,et al.
Delayed radiation necrosis of the brain.
J Neurosurg ,- 1977.-v.47.-N3,-p.336-345
25. Watne K., Hager B., Heier M., ,et al.
Reversible oedema and necrosis after irradiation of the brain. Diagnostic procedures and clinical manifestations.
Acta Oncol ,- 1990.-v.29.-N7,-p.891-895.
26. Sakai N., Nakatani K., Shirakami S., et al.
Delayed effects of radiation of patients with germ-cell tumor, with special to cerebral blood flow.
No To Shinkei ,- 1990.-v.42.-N2,-p.161-166.
27 .Werner M.H., Burger P.C., Heinz E.R.,et al.
Intracranial atherosclerosis following radiotherapy.
Radiation injury of the normal brain tissue after external radiotherapy of brain tumor.
Gan No Rinsho .- 1990 .-v.36,-N13,-p.2289-98
29. Safdari H., Fuentes J.M., Dubois J.B., et al.
Radiation necrosis of the brain: time of onset and incidence related to total dose and fractionation of radiation.
30. Brada M., Sharpe G., Rajan B.,et al.
Modifying radical radiotherapy in high grade gliomas ; shortening the treatment time through acceleration.
Int J Radiat Oncol Biol Phys,-1999.-v.15.-N2,-p.287-292.
31. Jen Y.M., Hsu W.L., Chen C.Y. et al.
Different risks of symptomatic brain necrosis in NPS patients treated with different altered fractionated radiotherapy techniques.
Int. J. Radiat . Oncol . Biol. Phys. 2001, Vol. 51, N2, p. 344-348
32. Di Chiro G., Oldfield E., Wright D.C.,et al.
Cerebral necrosis after radiotherapy and/or intraarterial chemotherapy for brain tumors: PET and neuropathologic studies.
Am J Roentgenol ,-1988 .-v.150.-N1,-p.189-197
33. Kumar A.J., Leeds N.E., Fuller G.H. et al.
Malignant gliomas : MR imaging spectrum of radiation therapy and chemotherapy-induced necrosis of the brain after treatment.
Radiology, 2000, Vol.217, N2, p.377-384.
34. Watne K., Hager B., Heier M.,et al.
Reversible oedema and necrosis after irradiation of the brain. Diagnostic procedures and clinical manifestations.
Acta Oncol ,- 1990.-v.29.-N7,-p.891-895.
35.Ebner F., Hormann M., Golles M., et al.
Late radiation-induced necrosis of the brain—a follow-up study using computerized tomography. Strahlenther Onkol ,- 1987.-v.163.-N5,-p.301-304.
Radiation necrosis of the brain: correlation between patterns on computed tomography and dose of radiation.
J Comput Assist Tomogr ,- 1979.-v.3.-N2,-p.241-249 .
37.Shibata S., Jinnouchi T., Mori K.,et al.
Delayed cerebral radionecrosis associated with brain edema.
No Shinkei Geka ,- 1988.-v.16.-N4,-p.377-382.
38.Packer R.J., Zimmerman R.A., Bilaniuk L.T.,et al.
Magnetic resonance imaging in the evaluation of treatment-related central nervous system damage.
39.Ogawa T., Uemura K., Kanno I., et al.
Delayed radiation necrosis of brain evaluated positron emission tomography.
Tohoku J Exp Med,- 1988.-v.155.-N3,-p.247-260
40. Thompson T.P., Lunsford L.D., Kondziolka D.
Distinquishing recurrent tumor and radiation necrosis with positron emission tomography versus stereotactic biopsy.
Stereotact . Funct . Neurosurg . 1999, Vol. 73, N1-4, p.9-14.
41. Schlemmer H.P., Bachert P., Henze M.,et al.
Differentiation of radiation necrosis from tumor progression using
proton magnetic resonance spectroscopy.
42. Dadparvar S., Hussian R., Koffler J.P. et al.
The role of Tc-99m HMPA functional brain imaging in detection of cerebral radionecrosis .
Cancer, 2000, Vol. 6, N6, p.381-387.
43.Fujii T., Misumi S., Shibasaki T., Tamura M., et al.
Treatment of delayed brain injury after pituitary irradiation.
No Shinkei Geka ,- 1988.-v.16.-N3,-p.241-247
44. Ciaudo-Lacroix C., Lapresle J.
Pseudo- tumoral form of delayed radionecrosis of the brain.
Ann Med Interne — 1985.-v.136.-N2,-p.137-141.
45. Hulshof M.C., Stark N.M., van der Kleij A.,et al.
Hyperbaric oxygen therapy for cognitive disorders after irradiation of the brain.
46.Feldmeier J.J., Hampson N.B.,et al.
A systematic review of the literature reporting the application of
hyperbaric oxygen prevention and treatment of delayed radiation
injuries: an evidence based approach.
Undersea Hyperb Med,-2002.-v.29.-N1,-p.24-30.
Источник