Что значит наивные пациенты
Двойные режимы терапии ВИЧ в 2018 году
Двадцать лет антиретровирусная терапия представляла из себя три слагаемых: два нуклеозидных ингибитора обратной транскриптазы и третий препарат из другого терапевтического класса. Попытки создать двойной режим осуществлялись, например, на базе Калетры, но не хватало вирусологической эффективности. Слишком хорошо циркулировали мутации устойчивости, а значит, часто наблюдалась первичная устойчивость. Плюс, где-то возникали коммерческие противоречия.
В исследовании GARDEL изучали режим из Калетры (усиленный ритонавиром лопинавир) и ламивудина, PROGRESS – Калетра и ралтегравир, ANDES – усиленный дарунавир и ламивудин, RADAR, NEAT и ACTG5256 – усиленный дарунавир и ралтегравир, SPARTAN – усиленный атазанавир и ралтегравир, MODERN – усиленный дарунавир и маравирок, VEMAN – Калетра и маравирок.
Часть исследований были относительно успешны, часть показали провал изучаемого режима. Ближе всех к успеху, пожалуй, была комбинация Калетры и ламивудина, но исследования начались слишком поздно, и препарат успел морально устареть. Кроме этого, необходимость двукратного приема и ряд других аспектов – все это остановило производителя от попыток вывести данный двойной режим на рынок в середине этого десятилетия.
Почти в два раза больше исследований различных двойных режимов было начато для пациентов с уже подавленной вирусной нагрузкой: SPARE, HARNESS, MARCH, GUSTA, DUAL GESIDA, FABIANI, OLE, ATLAS-M, MOBIDIP, LAMIDOL, PROBE, LATTE 1-2, SWORD 1-2, Dat’AIDS. Но преимущественно они повторяют те режимы, о которых мы говорили выше.
Однако впервые эффективные и безопасные двойные режимы позволил создать именно долутегравир — представитель класса ингибиторов интегразы ВИЧ. Он был одобрен регулятором США в 2013 году. Вирусологические параметры и высокий порог устойчивости к мутациям впечатлили научное сообщество, а производитель запустил ряд клинических исследований (SWORD-1 и SWORD-2), где ViiV Healthcare изучали эффективность долутегравира в сочетании с рилпивирином, а также исследования PADDLE и ACTG5353, где изучали долутегравир в паре с ламивудином.
Двойной режим с рилпивирином исследовали у пациентов, которые уже достигли подавления вируса на других режимах терапии – данный подход позволял быстрее выйти на рынок. Так и произошло – исследования SWORD показали, что режим имеет право на жизнь, и в ноябре 2017 года в США был одобрен препарат Juluca (долутегравир+рилпивирин) для использования у тех, кто достиг вирусной нагрузки менее 50 копий РНК ВИЧ в мл, и такая нагрузка наблюдалась не менее полугода — при условии, что ранее не было вирусологических провалов на других режимах терапии.
На конференции AIDS 2018 в июле этого года были представлены данные исследований долутегравира в сочетании с ламивудином у наивных пациентов. 48 недель исследований GEMINI показали, что режим не уступает тройному у наивных пациентов даже с высокой (более 100 тысяч копий в мл РНК ВИЧ) вирусной нагрузкой. Компания ViiV Healthcare в середине сентября подала заявку на регистрацию комбинированного препарата для нового двойного режима в ЕС, а в октябре запланирована подача NDA регулятору в США. Это означает, что в ЕС и США мы увидим первый двойной режим в одной таблетке для приема один раз в день уже в 2019 году.
После одобрения нового комбинированного препарата и режима терапии в течение года он будет без сомнений включен в ключевые региональные руководства – DHHS и EACS. Интрига лишь в том, получит ли новый режим сразу статус предпочтительного для начала терапии или же дебютирует как альтернативный режим.
Обновлено: в руководство EACS 10.0 (ноябрь 2019) двойной режим долутегравир + ламивудин вошел как предпочительный. В редакции руководства DHHS от 10 июля 2019 года данный режим рассматриватеся пока как режим для особых клинических ситуаций, когда применение тройного режима субоптимально или невозможно.
В середине августа этого года ViiV Healthcare обнародовала данные 48 недель исследования ATLAS, где изучается инъекционная пролонгированная форма двойного режима каботегравир + рилпивирин. Каботегравир – новый перспективный ингибитор интегразы ВИЧ, который ожидается и в таблетированной форме.
Пролонгированная форма с рилпивирином предполагает одну инъекцию один раз в месяц, но у пациентов, которые уже достигли вирусной супрессии и сохраняют ее не менее полугода. Параллельно с исследованием ATLAS проводится исследование FLAIR, где уже наивные пациенты через полгода приема в таблетках долутегравира / абакавира / ламивудина (Triumeq) переходят на инъекционные пролонгированные формы двойного режима.
Если смотреть широко, то двойные режимы на базе долутегравира в большинстве случаев уже позволяют или будут позволять в ближайшем будущем уйти от применения тенофовира (абакавир довольно ограниченно используется в развитых странах) или тенофовира алафенамида (TAF).
Так ли это необходимо?
Аргумент с уменьшением стоимости двойной терапии не очень работает в случае комбинированных современных препаратов. Снижение нефротоксичности и влияния на плотность костной ткани актуально в случае отказа от тенофовира, но вот в случае TAF выгоды тут ускользающе малы. Впрочем, пациентское сообщество встречает новые двойные режимы терапии крайне позитивно, реакция совсем не такая, как была на исследованиях Калетры и ламивудина несколько лет назад, что воспринималось тогда активистами как попытка сэкономить на стоимости лечения в ущерб эффективности.
Каковы бы ни были выгоды от новых двойных режимов, но два препарата – не три, а психологические аспекты отношения к принимаемой терапии – это действительно важно.
- Rossetti B, Montagnani F, De Luca A. Current and emerging two-drug approaches for HIV-1 therapy in ART-naïve and ART-experienced, virologically suppressed patients. Expert Opin Pharmacother. 2018 May;19(7):713-738. PMID: 29676935.
- Soriano V, Fernandez-Montero JV, Benitez-Gutierrez L. и др. Dual antiretroviral therapy for HIV infection. Expert Opin Drug Saf. 2017 Aug;16(8):923-932.PMID: 28621159.
Источник
Данная страница не существует!
Услуги инфекционной клиники
Диагностика, профилактика и лечение
Фиброэластометрия и УЗ-диагностика молочных желез, щитовидной железы, мошонки, брюшной полости
Биохимия. Анализ крови: общий, клинический. Анализы на витамины, микроэлементы и электролиты. Анализ на ВИЧ-инфекцию, вирусные гепатиты, бактерии, грибки и паразиты
Максимально точное определение выраженности фиброза печени неинвазивным методом при помощи аппарата FibroScan 502 TOUCH
Гинеколог в H-Сlinic решает широчайший спектр задач в области женского здоровья. Это специалист, которому вы можете полностью доверять
Дерматовенерология в H-Сlinic — это самые современные и эффективные алгоритмы диагностики и лечения заболеваний, передающихся половым путем, грибковых и вирусных поражений, а также удаление доброкачественных невусов, бородавок, кондилом и папиллом
Возможности вакцинопрофилактики гораздо шире Национального календаря прививок. H-Clinic предлагает разработку плана вакцинации и современные высококачественные вакцины в наличии
Терапевт в H-Сlinic эффективно решает задачи по лечению заболеваний, которые зачастую могут становиться большой проблемой при наличии хронического инфекционного заболевания
Врач-кардиолог H-Сlinic проведет комплексную диагностику сердечно-сосудистой системы и при необходимости назначит эффективное терапию. Сердечно-сосудистые проблемы при инфекционных заболеваниях, требуют специфичных подходов, которые мы в состоянии обеспечить
Наша цель — новое качество вашей жизни. Мы используем современные диагностические алгоритмы и строго следуем наиболее эффективным протоколам лечения.
Общая терапия, Инфекционные заболевания, Гастроэнтерология, Дерматовенерология, Гинекология, Вакцинация, УЗИ и фиброэластометрия, Кардиология, Неврология
Биохимия, Общий/клинический анализ крови, Витамины и микроэлементы/электролиты крови, ВИЧ-инфекция, Вирусные гепатиты, Другие инфекции, бактерии, грибки и паразиты, Комплексы и пакеты анализов со скидкой
В наличии и под заказ качественные бюджетные решения и препараты лидеров рынка лечения инфекционных болезней. Аптека H-Clinic готова гибко реагировать на запросы наших клиентов. Мы поможем с оперативным поиском препаратов, которые обычно отсутствуют в сетях.
Источник
Что значит наивные пациенты
Цель: определить эффективность двойной анти-В-клеточной терапии у пациентов с активной системной красной волчанкой (СКВ).
Методы: наблюдались три пациента с достоверной СКВ, которые получали ритуксимаб (РТМ) в дозе 500–1000 мг, через три месяца после окончания инфузий РТМ назначался белимумаб (БЛМ) из расчета 10 мг/кг один раз в месяц, всего восемь инфузий. Срок наблюдения – один год. Исходно и затем каждые три месяца проводилась оценка эффективности и переносимости терапии, концентрация аутоантител, комплемента и субпопуляций В-лимфоцитов.
Результаты: на фоне двойной анти-В-клеточной терапии наблюдалось значительное клиническое улучшение, не отмечалось признаков рецидива СКВ за весь период наблюдения, достигнута нормализация уровня лабораторных маркеров активности заболевания (концентрация антител к нативной (н) ДНК, С3,С4 компонентов комплемента), а также стойкая деплеция аутореактивных В-лимфоцитов, в частности плазматических клеток. У всех пациентов удалось снизить дозу глюкокортикоидов (ГК) до 7,5 мг/сутки в пересчете на преднизолон ко второму месяцу после завершения терапии.
Заключение: двойная анти-В-клеточная терапия является новым перспективным методом лечения активной СКВ. Применение такой схемы способствует быстрому подавлению активности заболевания и длительному сохранению полученного эффекта, уменьшению риска развития тяжелых необратимых органных повреждений за счет снижения дозы ГК до минимальной.
В течение нескольких десятилетий основным методом лечения СКВ оставалось назначение глюкокортикоидов (ГК) и цитостатиков (ЦТ). Применение комбинированной терапии ГК и ЦТ способствовало уменьшению частоты рецидивов, увеличению продолжительности жизни и значительному снижению ранней и поздней летальности [1]. Однако, несмотря на изменение характера течения СКВ и улучшение жизненного прогноза, назначение массивных доз ГК для купирования обострения и многолетнее применение средних доз с целью поддержания низкой активности привело к нарастанию числа необратимых органных повреждений и значительному снижению качества жизни больных [2, 3]. В 2014 году группой ведущих ревматологов мира была сформулирована концепция современной терапии СКВ, целью которой является не только увеличение продолжительности жизни, но и достижение ремиссии/минимальной активности, предотвращение развития необратимых органных повреждений, улучшение качества жизни, миниминизация дозы ГК, а при возможности их полная отмена [4, 5]. В связи с этим заманчивые перспективы «стероидозамещения» открывает эра генно-инженерных биологических препаратов (ГИБП). Первым ГИБП, с успехом применяемым в лечении СКВ, является Ритуксимаб (РТМ), назначение которого при высокой активности, поражении центральной нервной системы (ЦНС) и наличием нефрита оказалось высоко эффективным и мало токсичным [6, 7]. В 2010 году после завершения клинических исследований комиссией по пищевым продуктам и лекарственным препаратам (FDA США) был зарегистрирован Белимумаб (БЛМ) – первый ГИБП, разработанный для лечения СКВ [8]. Результаты клинических исследований и данные применения БЛМ в реальной клинической практике позволяют рекомендовать этот препарат для лечения больных СКВ с высокой и средней степенью активности, с преимущественным поражением суставов, кожи, слизистых и серозных оболочек, с высокой иммунологической активностью. Терапия БЛМ обеспечивает не только подавление активности, но и стойкую ремиссию или низкую активность, а также возможность максимального снижения ежедневной дозы и даже отмены ГК [9, 10, 11].
Таким образом, важным элементом в совершенствовании терапии СКВ является разработка наиболее эффективных методов лечения, ориентированных не только на продление жизни больных, но и улучшение ее качества, восстановление активности и работоспособности пациента. Для выполнения поставленных задач существуют два пути – создание новых таргетных препаратов и формирование принципиально новых схем терапии. Такая схема может включать последовательное применение двух ГИБП – быстрое снижение активности СКВ с помощью РТМ с последующим назначением БЛМ с целью поддержания эффекта и достижения ремиссии.
Перспективы такого лечения могут быть раскрыты благодаря детальному изучению механизмов действия препаратов и особенностей патогенетических факторов (субпопуляций В-лимфоцитов, BLyS), на которые ориентирован каждый ГИБП. Так, известно, что у больных СКВ после применения РТМ, как правило, развивается деплеция B-лимфоцитов (CD20) с последующим существенным повышением в сыворотке крови концентрации BlyS (BAFF) – основной мишени для БЛМ [12]. В недавно опубликованной работе L. M. Carter и соавт. [13] установлено, что после терапии РТМ наблюдается повышение уровня BAFF, полученные данные служат теоретическим обоснованием для проведения двойной анти-В-клеточной терапии у больных СКВ.
Мы представляем описание случаев комбинированной анти-В-клеточной терапии у трех пациенток с СКВ высокой степени активности, которые наблюдались в клинике ФГБНУ НИИР им. В. А. Насоновой. На первом этапе в качестве индукционной терапии назначался РТМ 1000 мг с последующим (через три месяца) переходом на поддерживающее лечение БЛМ по стандартной схеме 10 мг/кг один раз в месяц, в течение восьми месяцев. Срок наблюдения составил один год. При поступлении и на каждом визите оценивалась активность СКВ по SLEDAI-2K по следующему принципу: нет активности (SLEDAI 0 баллов), низкая (SLEDAI 1–5 баллов), средняя (SLEDAI 6–10 баллов), высокая (SLEDAI 11–19 баллов) и очень высокая активность (SLEDAI более 20 баллов), определялся индекс повреждения SLICC (ИП SLICC). Исходно и затем каждые три месяца всем пациенткам проводилось стандартное исследование общего анализа мочи, крови, иммунологических маркеров СКВ (антинуклеарного фактора (АНФ), антител (ат) к нДНК, С3 иС4 компонентов комплемента), а также специфическое исследование субпопуляций В-лимфоцитов в лаборатории иммунологии и молекулярной биологии ревматических заболеваний ФГБНУ НИИР им. В. А. Насоновой. Субпопуляции В-клеток определялись методом многоцветной проточной цитофлуорометрии с использованием панели моноклональных антител к поверхностным мембранным маркерам В-лимфоцитов. Оценку результатов четырехцветного окрашивания В-лимфоцитов проводили на проточном цитофлуориметре Beckman Coulter NAVIOS (Beckman Coulter, США). Для каждого анализа подсчитано 50 000 событий. B-клеточные популяции идентифицировали c помощью программного обеспечения CXP (Beckman Coulter, США). При гейтировании по горизонтальной и вертикальной осям определяли процентное содержание лимфоцитов (CD45+) и В-клеток (CD19+), а на основании экспрессии поверхностных мембранных маркеров IgD, CD20, CD27, CD38, CD10 и CD138 проводили количественное измерение субпопуляций В-клеток (табл. 1) [14].
Таблица 1. Молекулярные маркеры субпопуляций В-лимфоцитов
| Субпопуляции В-лимфоцитов | Молекулярные маркеры | Норма, % | Норма, Х10 9 /л |
| В-лимфоциты CD 19+ | CD19+ | 8,7 [3,4–14,3] | 0,2 (0,1–0,3) |
| Наивные (зрелые) В-лимфоциты | CD19+CD27-IgD+ | 64,5 [51,0–78,9] | 0,1 [0,03–0,2] |
| В-клетки памяти | CD19+CD27+ | 2,2 [0,6–4,7] | 0,004 (0,0004–0,01) |
| «Непереключенные» В-клетки памяти | CD19+CD27+IgD+ | 8,4 [2,1–27,9] | 0,01 [0,003–0,06] |
| «Переключенные» В-клетки памяти | CD19+CD27+IgD- | 13,6 [4,3–27,1] | 0,02 [0,01–0,1] |
| Плазматические клетки | CD19+CD38+ | 0,1 [0,003–0,2] | 0,0001 [0–0,0003] |
| Плазмобласты | CD19+СD38+++IgD-CD27+CD20- | 0,2 [0,1–0,7] | 0,0003 [0,0001–0,001] |
| Транзиторные В-клетки | CD19+IgD+CD10+CD38++CD27- | 0,07 [0–0,2] | 0,0001 [0–0,0005] |
| Двойные негативные В-клетки | CD19+CD27-IgD- | 13,7 [3,7–29,8] | 0,02 [0,01–0,1] |
Пациентка Ф, 20 лет, поступила в клинику ФГБНУ НИИР им. В. А.Насоновой с диагнозом: «СКВ хронического (по началу) течения, высокой степени активности (SLEDAI2K-1) 6 баллов, с поражением кожи (эритематозные высыпания, эритема Гатчинсона), слизистых (множественное язвенное поражение слизистой мягкого, твердого неба, щек, губ, энантема, хейлит), генерализованный кожный и дигитальный васкулит (оскольчатые геморрагии, яркие ладонные, подошвенные капилляриты, синдром Рейно), полисерозиты (экссудативный перикардит, плеврит), иммунологические нарушения (ат к нДНК, снижение уровня С3, С4 компонентов комплемента), АНФ (+).ИП SLICC/ACR -1 (плевральный фиброз); синдром Шегрена, паренхиматозный паротит, выраженной стадии».
Сопутствующее заболевание: хронический пиелонефрит.
Заболела в 2011 году (в возрасте 16 лет), когда появились боли в суставах кистей, коленных, локтевых суставах, лихорадка до 39С, лимфаденопатия, что послужило поводом для госпитализации. При обследовании выявлена эритема в зоне бабочки, ладонные и подошвенные капилляриты, лимфаденопатия, экссудативный перикардит; ат к нДНК > 45 МЕ/мл (норма 0–20 МЕ/мл), АНФ (+), антитела к Ro (aт-Ro) > 600 Ед/мл (норма 0–25 Ед/мл), уровень антител к циклическому цитруллинированному пептиду (АЦЦП) в пределах нормы, гемоглобин (Нв) 102 г/л, С-реактивный белок (СРБ) 53 мг/л (норма 0–5 мг/л), ревматоидный фактор (РФ) 586 МЕ/мл (норма 0–15 МЕ/мл), госпитализирована в ревматологическое отделение НЦЗД РАМН в июле 2011года. Проводилось лечение: преднизолон 50 мг/сутки,пульс-терапия метипредом (суммарно 4,0 г), интраглобин 25 г, микофенолата мофетил (ММ) 2 г/сутки. На фоне терапии нормализовалась температура, уменьшилась выраженность артралгий, перикардита, проявлений капилляритов. После выписки дозу преднизолона постепенно снизила до 10 мг/сутки, продолжала прием ММ 2 г/сутки. В дальнейшем состояние оставалось удовлетворительным, жалоб не предъявляла.
Для уточнения диагноза в феврале 2013 года впервые консультирована в ФГБНУ НИИР им В. А. Насоновой, диагноз СКВ подтвержден, выявлен сопутствующий синдром Шегрена (паренхиматозный паротит, выраженной стадии). В анализах: АНФ 1/640 h+sp, С4 0,09 г/л (норма 0,1–0,4 г/л), С3 0,96 г/л (норма 0,9–1,8 г/л) aт-Ro > 200 Ед/мл, антитела к La (aт-La) 53.3 Ед/мл(норма 0–25 Ед/мл), РФ 44,9 МЕ/мл, криоглобулины 2+, ат к нДНК > 300 МЕ/мл, СРБ 300 МЕ/мл, РФ 68,7 МЕ/мл, АНФ 1/1280 h+sp), артралии, субфебрилитет, анемия. Обсуждался вопрос о присоединении к лечению ГИБП, однако наличие обострения хронического пиелонефрита (лейкоцитурия, бактериурия) не позволило провести такую терапию. Пациентка выписана с рекомендациями – продолжить прием преднизолона 10 мг/сутки, ММ 1500 мг/сутки, ГХ 400 мг/сутки. В связи с неэффективностью терапии ММ (по амбулаторной карте), препарат был отменен, к лечению добавлен азатиоприн 150 мг/сутки, который больная принимала в течение четырех месяцев (на фоне приема препарата развивается пятнисто-папулезная сыпь, что послужило поводом для отмены). В это же время впервые в общем анализе мочи (ОАМ) обнаружен белок 0,7г/л –1,7 г/л; лейкоцитурия 4–8 п/з, от госпитализации пациентка отказалась.
В августе 2014 года – появление эритематозных высыпаний в области декольте, спины, плеч, энантемы твердого и мягкого неба, что послужило поводом для повторного обращения в ФГБНУ НИИР им. В. А. Насоновой. Доза преднизолона увеличена с 10 до 30 мг/сутки, ГХ 200 мг/сутки, возобновлен прием ММ 2000 мг/сутки, назначен лозап 25 мг/сутки. В связи с высокой клинической и иммунологической активностью вновь обсуждался вопрос о назначении ГИБП, но терапия была отложена в связи с обострением хронического пиелонефрита. Однак, в связи с сохраняющейся высокой активностью СКВ после курса антибактериальной терапии и полного купирования симптомов мочевой инфекции, проведены пять сеансов плазмафереза с синхронным введением после каждой процедуры солумедрола (500–500–250–250–250 мг соответственно), с кратковременным эффектом. Несмотря на проведение активной терапии (преднизолон 30 мг/сутки, ГХ 200 мг/сутки, ММ 2000 мг/сутки), прогрессировал генерализованный кожный и дигитальный васкулит (с поражением кожи лица, декольте, спины, плеч, ушей, стоп, ладоней), с образованием в области пальцев изъязвлений. Пациентка госпитализирована в клинику ФГБНУ НИИР им. В. А. Насоновой. При обследовании отмечена высокая иммунологическая активность АНФ 1/640, ат к нДНК 36,3 МЕ/мл, гипокломплементемия, В-лимфоциты –14,4%, повышение процентного и абсолютного количества наивных В-клеток (69% – 0,2 Х 10 9 /л), двойных негативных В-лимфоцитов памяти (40,4% – 0,1 абс. кол-во), в меньшей степени плазматических клеток (11,3% – 0,03 абс. кол-во). Общая активность заболевания по SLEDAI-2K-16 баллов, в связи с чем 31 октября 2014 года инициирована терапия РТМ 1000 мг с премедикацией солумедролом 125 мг и последующим назначением дексаметазона 36 мг (суммарно 144 мг) и циклофосфана (ЦФ) 800–400–200мг (суммарно 1400 мг) в течение четырех дней с перерывом в один – два дня. На фоне проводимой терапии достигнута полная деплеция В-лимфоцитов. Значительно уменьшены явления васкулита.
С декабря 2014 года по апрель 2015 года доза преднизолона снижена с ПЗ с 25 мг до 15 мг в сутки, ежемесячно получала инфузии ЦФ в дозах 400–600 мг. Активность заболевания не нарастала, однако полностью купировать симптомы СКВ не удавалось: васкулит, эритематозные высыпания в области лица, живота, спины, энантемы слизистых и иммунологические изменения сохранялись (АНФ 1/640 h+sp, С3-0,41 г/л, С4-0,058 г/л, криопреципитины+3), SLEDAI-2K-14 баллов.
С января 2015 года (через три месяца после введения РТМ) на фоне терапии преднизолоном 15мг/сутки и ежемесячных инфузий ЦФ по 400–600 мг инициирована терапия БЛМ по стандартной схеме с премедикацией солумедролом (250 мг за инфузию). К девятому месяцу наблюдалась репопуляция В-лимфоцитов преимущественно за счет «переключенных» (55,9% – 0,002 x10 9 /л) и двойных негативных В-клеток памяти (11,8% – 0,0005 x10 9 /л), наивных В-лимфоцитов (29,4% – 0,001 x10 9 /л), а к девнадцатому месяцу также возросла доля «непереключенных» В-клеток памяти (28% – 0,003 x10 9 /л). Количество плазматических клеток оставалось на низком уровне. К двенадцатому месяцу наблюдения после курса комбинированной анти-В-клеточной терапии у пациентки наблюдается медикаментозная клиническая ремиссия СКВ, SLEDAI-2K-2 балла (за счет низкого уровня С3 компонента комплемента). Пациентка продолжает получать преднизолон в дозе 7,5 мг/сутки, лечение ЦФ и БЛМ прекращено (рис. 1, 2, 3, 4).
Пациентка С, 16 лет, поступила в клинику ФГБНУ НИИР им. В. А. Насоновой с диагнозом: «СКВ острого (по началу) течения». В анамнезе: поражение кожи (эритематозные высыпания), суставов (полиартрит, артралгии), гематологические нарушения (изолированная положительная проба Кумбса), иммунологические нарушения (ат к нДНК, снижение уровня С3, С4 компонентов комплемента), АНФ (+). Высокая ативность по SLEDAI 2 К-10 баллов. ИП SLICC/ACR – 0.
С 2012 года стали беспокоить боли в суставах кистей, лучезапястных, плечевых, коленных, голеностопных суставах, в течение трех предшествующих лет – явления фотодерматита. В октябре 2014 года появился мигрирующий артрит мелких суставов кистей, крупных суставов, стойкие эритематозные высыпания в области лица и декольте.
В ноябре 2014 года госпитализирована в клинику ФГБНУ НИИР им. В. А. Насоновой, при обследовании ат к нДНК >300 МЕ/мл, АНФ 1/640h, С3 – 0,37 г/л, С 4 – 0,022 г/л (содержание криопреципитинов , ат-Ro, ат-La, антител к кардиолипину (аКЛ) IgG/IgM, В2 гликопротеину (аB2-ГП) IgG/IgM – в пределах нормы), положительная проба Кумбса (+1, тепловые антитела). Данных за поражение почек, ЦНС, наличия васкулита – не получено. Установлен диагноз СКВ, назначен метипред 12 мг в сутки, ГХ 200 мг в сутки. При определении субпопуляций В-клеток отмечено высокое процентное и абсолютное содержание общей популяции В-лимфоцитов за счет наивных В-лимфоцитов (87,4% – 0,64 x10 9 /л), плазматических клеток (14% – 0,1 x10 9 /л), двойных негативных В-лимфоцитов памяти (9,6% – 0,07 x10 9 /л). В связи с высокой активностью заболевания, нежеланием пациентки принимать цитостатические препараты и увеличивать дозы ГК, инициирована терапия РТМ 500 мг с премедикацией солумедролом 250 мг к третьему месяцу наблюдения. На фоне терапии удалось полностью купировать клинические проявления заболевания, достигнута полная деплеция В-лимфоцитов, SLEDAI-2K 4 балла за счет сохранения минимальной иммунологической активности.
Для того чтобы обеспечить возможность дальнейшего снижения дозы ГК, в апреле 2015 года к лечению был добавлен БЛМ по стандартной схеме, всего выполнено восемь инфузий. К июню 2015 года доза метипреда снижена до 4 мг в сутки. К двенадцатому месяцу наблюдения после курса комбинированной анти В-клеточной терапии у пациентки сохранялась медикаментозная ремиссия, SLEDAI-2K-2 балла (за счет сниженного уровня С3 компонента комплемента – 0,88г/л). Пациентка продолжает получать метипред 4 мг/сутки. К шестому месяцу наблюдалась репопуляция В-лимфоцитов преимущественно за счет «переключенных» (61,9% – 0,007 x10 9 /л), наивных В-лимфоцитов (28,6% – 0,003 x10 9 /л). К девятому месяцу сохранялись высокие значения наивных В-клеток (54% – 0,006 x10 9 /л), а к двенадцатому месяцу возросло количество «непереключенных» (28,1% – 0,003 x10 9 /л) и «двойных негативных» (18,8% – 0,002×10 9 /л) В-клеток памяти с одновременным снижением доли «переключенных» В-лимфоцитов памяти (9,4% – 0,001 x10 9 /л). Количество плазматических клеток оставалось на низком уровне (рис. 1–4).
Пациентка Л, 20 лет, поступила в клинику ФГБНУ НИИР им. В. А. Насоновой с диагнозом: «СКВ, хронического (по началу) течения, поражение кожи («бабочка», эритематозные высыпания, фотосенсибилизация, ливедо), слизистых (хейлит, энантема неба), суставов (артрит), серозных оболочек, иммунологические нарушения (ат к нДНК, снижение уровня С3 компонента комплемента АНФ+)». В анамнезе: конституциональные нарушения (субфебрильная температура, лимфаденопатия) средней степени активности ( SLEDAI 2К-8 баллов). Медикаментозный синдром Иценко-Кушинга. ИП SLICC/ACR = 1 (ангиопатия сетчатки).
Пациентка болеет с марта 2007 года – фотосенсибилизация, «эритема-бабочка», сыпь на плечах, артрит межфаланговых суставов кистей, голеностопных суставов, ливедо нижних конечностей, субфебрилитет, повышенные уровни ат к нДНК, АНФ, ат-Ro, ат-Lа. Установлен диагноз СКВ (без поражения почек, ЦНС). С 2007 года находится на постоянной глюкокортикоидной терапии с максимальной дозой преднизолона 60 мг/сутки, минимальной 15 мг/сутки. При снижении дозы преднизолона до 15 мг/сутки отмечалось обострение кожных проявлений СКВ, гингивит, лимфаденопатия. В качестве базисной терапии получала ГХ 400 мг/сутки (с февраля 2012 года по настоящее время), азатиоприн (январь 2008 года – 50–100 мг/сутки, декабрь 2011 – февраль 2012 года – 50 мг/сутки, с января по декабрь 2013 года – 150 мг/сутки) с недостаточным эффектом, ММ 2г/сутки (январь 2014 года, с 09.04. по 06.2014 года) с недостаточным эффектом, метотрексат 10 мг/неделю (09.14 –01.2015 года) (на фоне лечения отмечалось повышение уровня печеночных ферментов). В 2011 году проводилась пульс-терапия метипредом 1750 мг суммарно. Несмотря на проводимое лечение, наблюдались ежегодные обострения СКВ с преимущественным поражением кожи, суставов, слизистых полости рта. С 2012 года высыпания стали носить полиморфный характер: от мелкопапулезной до крупной сливающейся эритемы с образованием кольцевидных элементов (в области лица, декольте, живота, спины, на руках), что требовало увеличения дозы ГК до 30–60 мг в сутки (в пересчете на преднизолон) в сочетании с различными ЦТ. На фоне приема высоких доз ГК (более 30 мг/сутки) удавалось купировать кожные проявления СКВ.
С 2012 года наблюдается в ФГБНУ НИИР им. В. А. Насоновой. Последнее обострение – с марта 2014 года, когда после перенесенной острой респираторной вирусной инфекции ОРВИ вновь появились эритематозные высыпания >18% площади поверхности тела, энантема полости рта, ливедо нижних конечностей, артрит, периодически лихорадка до 38,5С, отмечались гематологические нарушения (лейкопения). В анализах: ат к нДНК >300 МЕ/мл, АНФ 1/640h+sp, С3 – 0,42 г/л, С4 – 0,06 г/л, ат Ro > 200 Ед/мл, ат La > 200 Ед/мл, СРБ 2,7 мг/л, аКЛ IgG/IgM и волчаночный антикоагулянт в пределах нормы. С учетом длительности приема высоких доз ГК, отсутствием возможности уменьшения дозы ниже 15 мг/сутки, недостаточным эффектом ЦТ и высоким риском развития необратимых органных повреждений у пациентки молодого возраста, в апреле 2014 года решено начать терапию БЛМ из расчета 10 мг на кг массы тела (всего проведено семь инфузий). На фоне терапии клинические проявления СКВ полностью купировать не удавалось: сохранялись и рецидивировали высыпания, регистрировались эпизоды лихорадки, энантемы полости рта, ат к нДНК 42 МЕ/мл, АНФ 1/640, С3 0,59 г/л, С4 0,1 г/л. Продолжала прием метипреда 12 мг/сутки, к терапии добавлен метотрексат (в связи с увеличением содержания печеночных ферментов более чем в три раза выше нормы препарат отменен в январе 2015 года).
В декабре 2014 года в связи с сохраняющейся активностью СКВ и неэффективностью ранее проводимого лечения, было решено инициировать терапию РТМ 1000 мг с последующим продолжением терапии БЛМ по стандартной схеме. При обследовании отмечено невысокое процентное и абсолютное содержание общей популяции В-лимфоцитов (4,4%), наивных В-лимфоцитов (21,1% – 0,64 x10 9 /л), «переключенных» (30,5% – 0,03 x10 9 /л), двойных негативных В-лимфоцитов памяти (44,2% – 0,05 x10 9 /л). Через двенадцать месяцев после начала комбинированной анти-В-клеточной терапии наблюдалось снижение иммунологической активности (уменьшение количества ат к нДНК до 13.9 МЕ/мл, увеличение концентрации С3, С4 компонентов комплемента), нормализация гематологических показателей, достигнута частичная деплеция В-лимфоцитов, уменьшение выраженности высыпаний и энантемы неба. У пациентки сохраняется незначительная активность СКВ SLEDAI-2K. 6 баллов за счет высыпаний, энантемы и сниженного уровня С3 компонета комплемента (С3 – 0,81 г/л), снижена доза ГК с 3 таб/сутки до 1,5 таб/сутки. Обострений СКВ за год наблюдения не отмечалось (рис. 1 – 4).
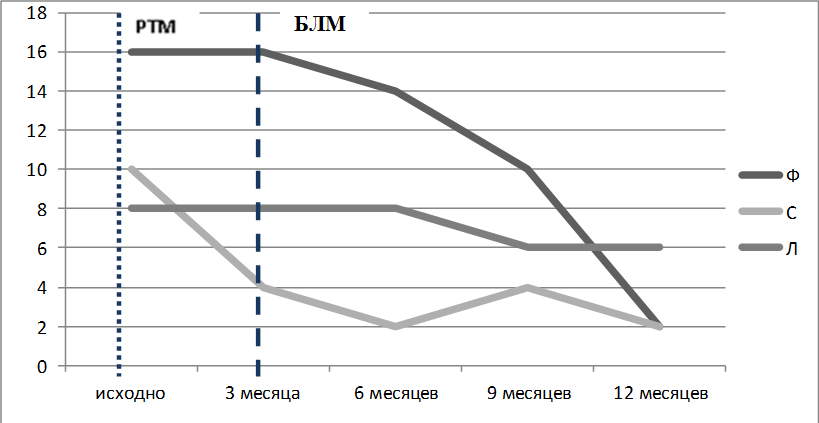
Рисунок 1. Динамика активности СКВ по индексу SLEDAI-2K пациенток Ф, С и Л Короткая пунктирная линия – введение РТМ, длинная пунктирная линия – начало лечения БЛМ
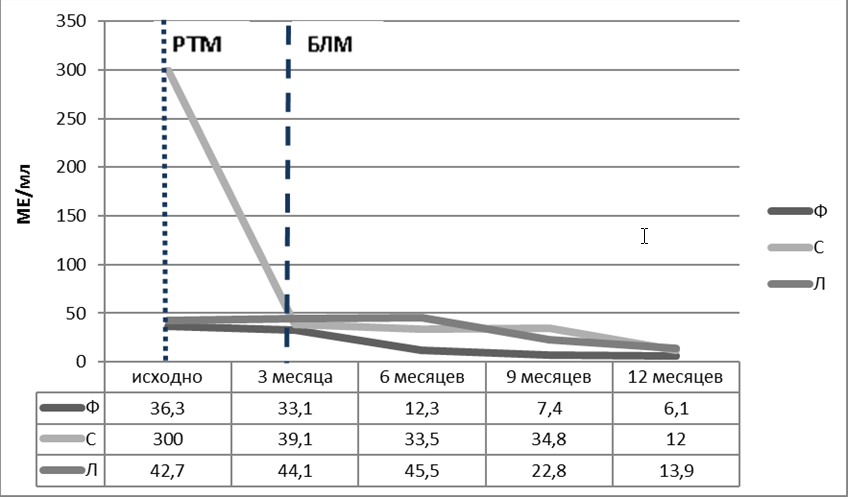
Рисунок 2. Динамика концентрации ат к нДНК в сыворотке крови у пациенток Ф, С и Л Короткая пунктирная линия – введение РТМ, длинная пунктирная линия – начало лечения БЛМРисунок 1. Динамика активности СКВ по индексу SLEDAI-2K пациенток Ф, С и Л Короткая пунктирная линия – введение РТМ, длинная пунктирная линия – начало лечения БЛМ
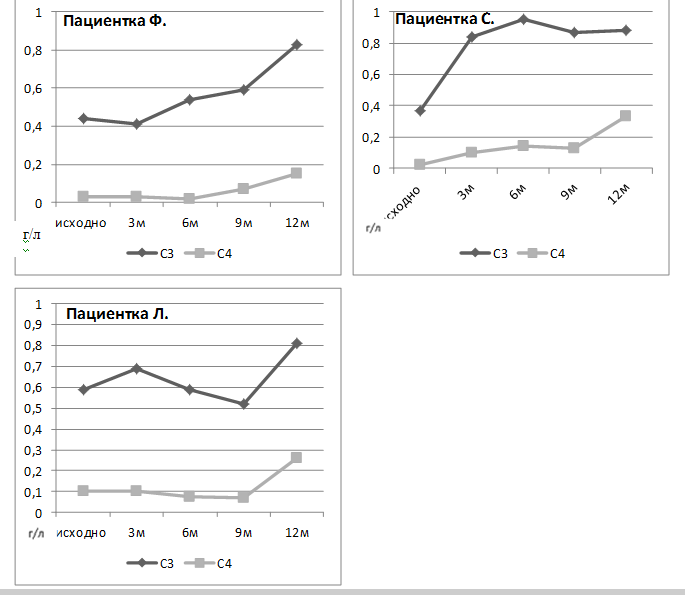
Рисунок 3. Динамика концентрации С3 и С4 компонентов комплемента пациенток Ф, С и Л на фоне двойной анти-В-клеточной терапии
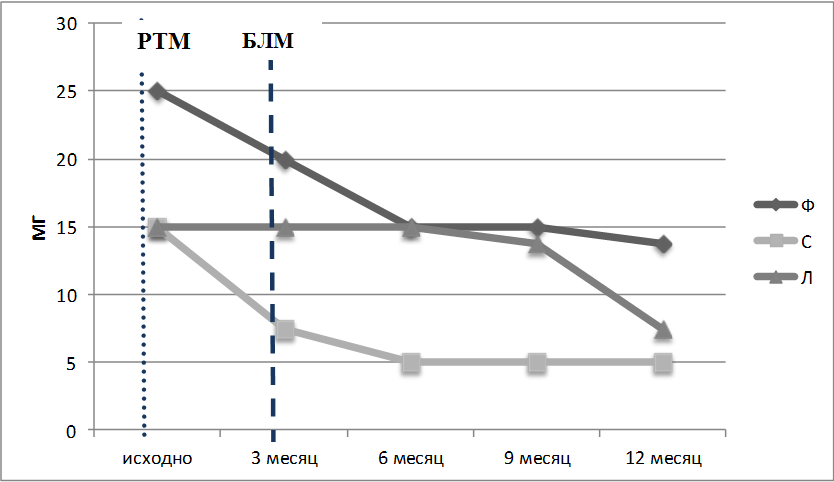
Рисунок 4. Лечение ГК в пересчете на преднизолон за год наблюдения. Короткая пунктирная линия – введение РТМ, длинная пунктирная линия – начало лечения БЛМ
Динамика субпопуляций В-лимфоцитов под влиянием двойной анти-В-клеточной терапии
Изначально количество наивных В-лимфоцитов и субпопуляций короткоживущих плазматических клеток было значительно выше у пациентки С, с дебютом СКВ, которая ранее не получала ГК, цитостатики и ГИБП. Одновременно с этим выявлялась высокая иммунологическая активность. Однако тяжелых органных поражений у данной пациентки не было.
Процентное распределение базальных уровней субпопуляций В-лимфоцитов, в целом, было одинаковым у пациенток Ф и С без предшествующей терапии ГИБП (рис. 5). К третьему месяцу у этих больных достигнута полная деплеция В клеток с последующем их восстановлением через шесть и девять месяцев, преимущественно за счет наивных В-клеток, «переключенных» и «двойных негативных» В-лимфоцитов памяти. А к двенадцатому месяцу помимо вышеперечисленных изменений отмечено увеличение числа «непереключенных» В-лимфоцитов памяти. Количество плазматических клеток в течение всего года наблюдения оставалось низким. Раннее восстановление В-лимфоцитов после полной деплеции (через шесть месяцев) отмечено у пациентки С с высоким базальным числом аутореактивных В-клеток. Уровень восстановленных В-лимфоцитов через год после начала наблюдения не достигал исходных значений (рис. 6, 7).
У пациентки Л базальная популяция В-лимфоцитов была ниже, что обусловлено проведением до включения больной в наблюдение годичного курса лечения БЛМ, на фоне которого отмечалась положительная динамика лабораторных показателей без улучшения клинической картины. Несмотря на снижение числа В-клеток, полной их деплеции после одного курса РТМ достигнуть не удалось. Примечательно, что несмотря на проведение активной терапии, на протяжении двенадцати месяцев наблюдения сохранялись эритематозные высыпания и энантема слизистой рта, однако на фоне лечения отмечено уменьшение выраженности симптомов, а также полная нормализация клинических и иммунологических показателей крови.
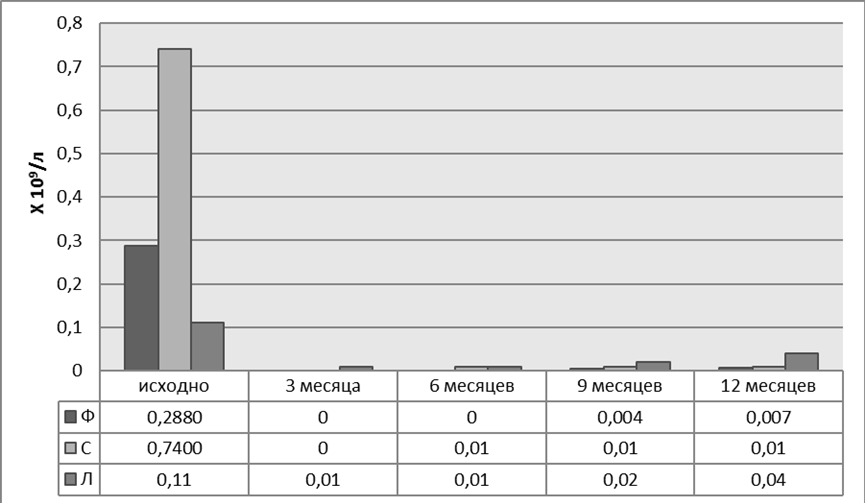
Рисунок 5. Динамика CD 19+ В-лимфоцитов пациенток Ф, С и Л на фоне терапии ГИБП
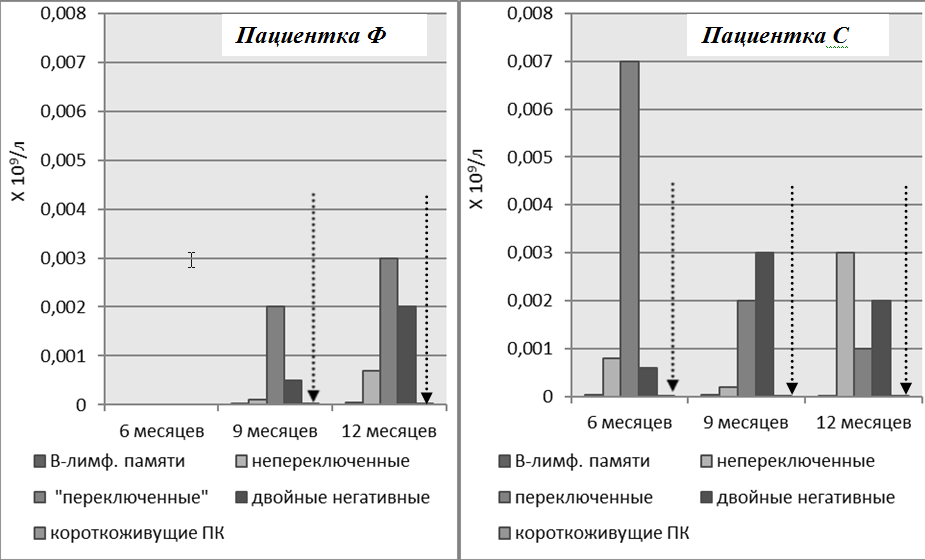
Рисунок 6. Динамика В-лимфоцитов памяти и короткоживущих плазматических клеток через 6–12 месяцев после начала терапии. Пациенты Ф и С. Уровень плазматических клеток после начала репопуляции оставался низким на фоне терапии (обозначен пунктирными стрелками)
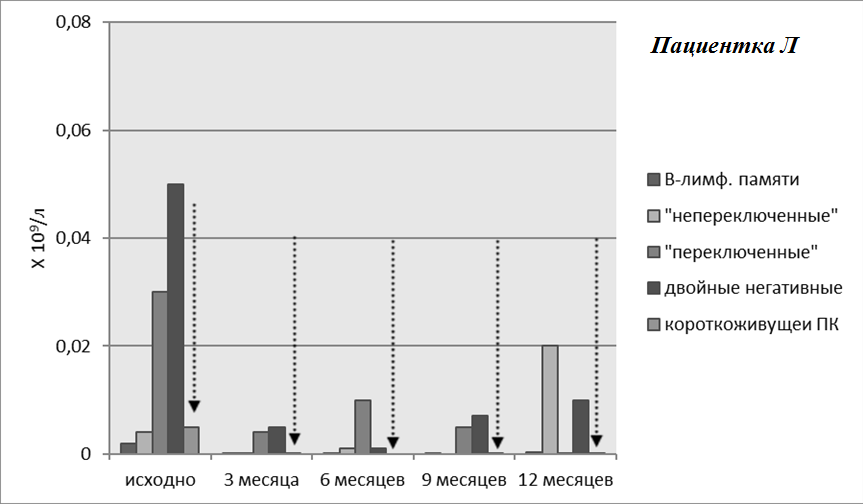
Рисунок 7. Динамика В-лимфоцитов памяти и плазматических клеток на фоне терапии ГИБП. Пациентка Л. Уровень плазматических клеток после курса РТМ оставался низким на фоне терапии (обозначен пунктирными стрелками)
Обсуждение и заключение
Механизмы действия РТМ и БЛМ различны и направлены на подавление определенных субпопуляций В-лимфоцитов. К РТМ чувствительны преимущественно наивные В-клетки и В-клетки памяти, имеющие на своей поверхности мембранные CD20 антигены. Эффективность такой терапии с иммунологической точки зрения оценивается по уровню и длительности В-клеточной деплеции [15]. Ряд исследований позволили выявить особенности течения заболевания, которые ассоциировались с динамикой уровней субпопуляций В-лимфоцитов. Так было высказано предположение, что раннее восстановление чила В-клеток наблюдается у пациентов с изначально высоким их количеством [16], а репопуляция до определенных уровней отдельных субпопуляций В-лимфоцитов, в частности В-клеток памяти и плазматических клеток, коррелирует с ранним обострением СКВ [17]. Предиктором выраженного снижения концентрации антител к нДНК и увеличения концентрации С3 компонента комплемента у таких пациентов является отсутствие антител к RNP, Sm, Ro, La [18]. Примечательно, что у пациентов, получавших РТМ, одновременно с деплецией В-лимфоцитов через три – четыре месяца в плазме наблюдается существенное увеличение уровня BlyS [19].
БЛМ, блокируя BlyS, воздействует на транзиторные, наивные В-клетки и плазматические клетки, что в свою очередь приводит к подавлению характерной для СКВ В-клеточной гиперреактивности, в частности синтеза аутоантител [20]. Кроме того, блокада BLyS может приводить к снижению выживаемости В-клеток в ростковых центрах лимфоидных органов, дифференцировки В-клеток памяти в аутоантитело-продуцирующие клетки и синтеза провоспалительных цитокинов. Также хочется подчеркнуть, что лечение высокими дозами ГК способствует нормализации уровня BLyS в сыворотке крови. Попытки снижения дозы препарата у части больных могут приводить к рецидиву СКВ за счет увеличения концентрации BlyS. Назначение ингибиторов BlyS позволяет постепенно снизить дозу ГК с минимальным риском обострения заболевания [21].
Таким образом, перекрывающие и дополняющие друг друга механизмы действия РТМ и БЛМ могут способствовать более эффективному подавлению аутореактивных В-клеток, снижению выработки широкого спектра аутоантител, длительному поддержанию достигнутого эффекта.
Поскольку оба ГИБП тем или иным образом направлены на подавление аутореактивных В-лимфоцитов, лечение с последовательным применением РТМ и БЛМ названы двойной анти-В-клеточной терапией.
О предполагаемой эффективности двойной анти-В-клеточной терапии сообщают WeiYu Lin и соавт. [22], которые в экспериментах на (NZB/NZW)F1 мышах после лечения отмечали лучший эффект по сравнению с монотерапией. На основании проведенных исследований высказано предположение, что такая терапия обеспечивает значительное улучшение течения и выживаемости при СКВ за счет наиболее эффективной деплеции тканевых и циркулирующих аутореактивных В-клеток, включая В-клетки маргинальной зоны, плазмобласты и плазматические клетки, что способствует снижению выработки аутоантител и уменьшению инфильтрации почек активированными Т-клетками.
Теоретические предпосылки возможности комбинации РТМ и БЛМ при СКВ уже находят свое применение в реальной клинической практике. Так, Kraaij T и Huizinga TW [23] представили два клинических случая, где пациентам с явлениями люпус-нефрита (суточная протеинурия 8 и 9,8 г/сутки соответственно) была выполнена инфузия РТМ с последующим назначением БЛМ. На этом фоне было достигнуто уменьшение протеинурии соответственно (0,9 и 1,5 г/сутки), концентрации антител к дс-ДНК, увеличение С3,С4 компонентов комплемента и стойкое снижение количества аутореактивных В-клеток. На протяжении последующих двенадцати месяцев наблюдения сохранялась минимальная активность заболевания (SLEDAI 6-4). В другом исследовании De Vita S. и соавт. [24] продемонстрировали высокую эффективность комбинации последовательных курсов РТМ и БЛМ у больного с синдромом Шегрена, осложненного лимфомой и криоглобулинемическим язвенно-некротическим васкулитом. Стойкая регрессия лимфомы и полное купирование васкулита сохранялось в течение трех с половиной лет наблюдения, отмечено исчезновение криоглобулинов, нормализация уровня РФ, С4 компонента комплемента и BAFF в сыворотке крови. Комбинированная терапия у этой пациентки не сопровождалась неблагоприятными реакциями.
Существующие данные пока не могут полностью отразить преимущества и недостатки такого лечения. Тем полезнее рассматривать каждый случай применения двойной анти-В-клеточной терапии у больных СКВ с различными вариантами течения заболевания.
Несмотря на различия в истории развития, тяжести заболевания, двойная анти-В-клеточная терапия показала высокую эффективность у наших пациентов: наблюдалось улучшение клинической картины, лабораторных маркеров активности СКВ, в частности повышение концентрации С3-, С4-компонентов комплемента, стойкое снижение концентрации антител к нДНК. У больной Ф с проявлениями васкулита наблюдалась инфузионная реакция через сутки после введения РТМ, которая была купирована внутривенным введением ГК. Дальнейшая терапия этой пациентки с применением БЛМ и короткого курса цитостатических препаратов, на фоне уже достигнутой на РТМ деплеции аутореактивных В-лимфоцитов, полностью купировала клинико-лабораторные симптомы СКВ. Переносимость двойной анти-В-клеточной терапии после присоединения БЛМ была удовлетворительной у всех пациенток. В динамике инфузионных реакций не наблюдалось, тяжелых инфекций также не зарегистрировано. В течение года ни у одного больного не было признаков обострения, в результате чего нам удалось снизить дозу ГК у всех пациентов до 1,5 таблетки в сутки к 14–15 месяцу после терапии ГИБП. Уровень восстановленных В-лимфоцитов через год после начала наблюдения не достигал исходных значений. Несмотря на заметное увеличение числа В-лимфоцитов памяти, к 6–9 месяцу после курса лечения РТМ количество плазматических клеток оставалось низким.
На основании полученных результатов можно предположить, что двойная анти-В-клеточная терапия ГИБП:
— обеспечивает значительное снижение активности СКВ;
— снижает риск обострения заболевания;
— способствует быстрому снижению дозы ГК, уменьшая тем самым риск развития необратимых органных повреждений;
— обеспечивает стойкое снижение числа аутореактивных В-лимфоцитов, в частности плазматических клеток, благодаря перекрывающим и дополняющим друг друга механизмам действия РТМ и БЛМ;
— способствует быстрой и стойкой нормализации лабораторных маркеров активности заболевания (концентрации антител к нДНК, С3,С4 компонентов комплемента).
Таким образом, применение одновременно двух ГИБП в лечении пациентов с активной СКВ является новым перспективным методом терапии, способствующим быстрому подавлению обострения заболевания и улучшению качества жизни пациентов.
Исследование не имело спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать.
Декларация о финансовых и других взаимоотношениях
Все авторы принимали участие в разработке концепции статьи и в написании рукописи. Окончательная версия рукописи была одобрена всеми авторами. Авторы не получали гонорар за статью.
Vasoo S., Hughes GRV. Perspectives on the changing face of lupus mortality. Autoimmun Rev. 2004; 3: 415–417.
Андрианова И. Л., Иванова М. М.. Ранний индекс повреждения у больных системной красной волчанкой. Научно-практическая ревматология, 2005; 5:19–22.; [Andrianova I. L., Ivanova M. M. Rannij indeks povrezhdenija u bol’nyh sistemnoj krasnoj volchankoj. Nauchno-prakticheskaja revmatologija, 2005; 5:19–22].
Sutton EJ, Davidson JE, Bruce IN. The systemic lupus international collaborating clinics (SLICC) damage index: a systematic literature review. Semin Arthritis Rheum. 2013 Dec; 43 (3): 352–61 doi:10.1016/j. semarthrit. 2013.05.003.
Van Vollenhoven RF, Mosca M, Bertsias G et al. Treat-to-target in systemic lupus erythematosus: recommendations from an international task force. Ann Rheum Dis. 2014; 73 (6): 958–67 doi: 10.1136/annrheumdis – 2013–205139.
Соловьев С. К., Асеева Е. А., Попкова Т. В. и др. Стратегия лечения системной красной волчанки «до достижения цели» (Treat-to-Target SLE). Pекомендации международной рабочей группы и комментарии российских экспертов. Научно-практическая ревматология. 2015; 53 (1): 9–16 [Solov’ev SK, Aseeva EA, Popkova TV i dr. Strategija lechenija sistemnoj krasnoj volchanki «do dostizhenija celi» (Treat-to-Target SLE). Pekomendacii mezhdunarodnoj rabochej gruppy i kommentarii rossijskih jekspertov. Nauchno-prakticheskaja revmatologija. 2015; 53 (1): 9–16].
L. Lan, F. Han, J. Chen. Efficacy and safety of rituximab therapy for systemic lupus erythematosus: a systematic review and meta-analysis. J Zhejiang Univ Sci B. 2012 September; 13 (9): 731–744; PMID: 22949364.
М. Э. Цанян, С. К. Соловьев, А. А. Новиков, и соавт. Эффективность терапии ритуксимабом у больных рефрактерной к стандартной терапии системной красной волчанкой при длительном динамическом наблюдении. Научно-практическая ревматология, 2014; 52 (2): 159–168 [M. Je. Canjan, S. K. Solov’ev, A. A. Novikov, i soavt., Jeffektiv-nost’ terapii rituksimabom u bol’nyh refrakternoj k standartnoj terapii sistemnoj krasnoj volchankoj pri dlitel’nom dinamicheskom nabljudenii. Nauchno-prakticheskaja revmatologija, 2014; 52 (2): 159–168].
FDA approves Benlysta to treat lupus. [Last accessed on 2011 Mar 28]. Available from: http://www.fda.gov/NewsEvents/Newsroom/Press Announcements/Ucm246489.htm.
Асеева Е. А., Соловьев С. К., Насонов Е. Л. Генно-инженерные биологические препараты в терапии системной красной волчанки. Современная ревматология, 2013, 3, 1–8; [Aseeva E. A., Solov’ev S. K., Nasonov E. L. Genno-inzhenernye bio-logicheskie preparaty v terapii sistemnoj krasnoj volchanki. Sovremennaja revmatologija, 2013, 3, 1–8].
Асеева Е. А., Соловьев С. К., Меснянкина А. А. и др. Опыт применения белимумаба у больных системной красной волчанкой. Научно-практическая ревматология. 2015; 53 (3): 329–335; [Aseeva E. A., Solov’ev S. K., Mesnjankina A. A. i dr. Opyt primenenija belimumaba u bol’nyh sistemnoj krasnoj volchankoj. Nauchno-prakticheskaja revmatologija. 2015; 53 (3): 329–335].
Ginzler E.,Wallace D., Merill J. Disease Control and safety of Belimumab plus standard therapy over 7 years in patients with systemic lupus erythematosus. The J.of Rheumatology, 2014, 41:2, 300–9.
Lavie F., Miceli-Richard C., Ittah M, et al., Increase of B cell-activating factor of the TNF family (BAFF) after rituximab treatment: insights into a new regulating system of BAFF production. Ann Rheum Dis. 2007; 66 (5): 700–3.
L. M. Carter, D. A. Isenberg, M. R. Ehrenstein. Elevated Serum BAFF Levels Are Associated With Rising Anti-Double-Stranded DNA Antibody Levels and Disease Flare Following B Cell Depletion Therapy in Systemic Lupus Erythematosus. Arthritis & Rheumatism 2013; 65 (10): 2672–2679 DOI: 10.1002/art. 38074.
Супоницкая Е. В., Алексанкин А. П., Александрова Е. Н. и др. Определение субпопуляций В-лимфоцитов периферической крови методом проточной цитофлуорометрии у здоровых лиц и больных ревматическими заболеваниями. Клиническая лабораторная диагностика, 2015, 60 (6), 30–33; [Suponickaja E. V., Aleksankin A. P., Aleksandrova E. N. i dr. Opredelenie sub-populjacij V-limfocitov perifericheskoj krovi metodom protochnoj citofluorometrii u zdorovyh lic i bol’nyh revmaticheskimi zabolevanijami. Klinicheskaja laboratornaja dia-gnostika, 2015, 60 (6), 30–33].
Александрова Е. Н., Новиков А. А., Соловьев С. К. и др. В-клетки при аутоиммунных ревматических заболеваниях. Насонов Е. Л. – редактор. Анти-В-клеточная терапия в ревматологии: фокус на ритуксимаб. Москва; ИМА-ПРЕСС 2012; с. 8–45; [Alexandrova E. N., Novikov A. A., Soloviev S. K. et al. V-kletki pri auto-immunnyh revmatiche-skih zabolevanijah. Nasonov E.L. – redaktor. Anti-V-kletochnaja terapija v revmatologii: fokus na rituksimab. Moskva; IMA-PRESS 2012; с. 8–45].
Vallerskog T, Gunnarsson I, Widhe M, et al.Treatment with rituximab affects both the cellular and the humoral arm of the immune system in patients with SLE. Clin Immunol. 2007; 122: 62–74. Epub 2006 Oct 13.
Vital EM, Dass S, Buch MH, et al. B Cell Biomarkers of Rituximab Responses in Systemic Lupus Erythematosus. Arthritis Rheum. 2011; 63: 3038–3047. DOI: 10.1177/0961203309350752.
Tew GW, Rabbee N, Wolslegel K. Baseline autoantibody profiles predict normalization of complement and anti-dsDNA autoantibody levels following rituximab treatment in systemic lupus erythematosus. Lupus 2010; 19: 146–57. DOI: 10.1177/0961203309350752. Epub: 2009 Nov 27.
Vallerskog T, Heimbürger M, Gunnarsson I, et al. Differential effects on BAFF and APRIL levels in rituximab-treated patients with systemic lupus erythematosus and rheumatoid arthritis. Arthritis Res Ther. 2006; 8: 167.
Bekar KW, Owen T, Dunn R, et al. Prolonged effects of short-term anti-CD20 B cell depletion therapy in m И Jacobi AM, Huang W, Wang T, et al. Effect of long-term belimumab treatment on B cells in systemic lupus erythematosus: extension of a phase II, double-blind, placebo-controlled, dose-ranging study. Arthritis Rheum. 2010; 62 (1): 201–10. DOI: 10.1002/art. 27189.
Насонов Е. Л., Решетняк Т. М., Денисов Л. Н., Соловьев С. К., и др. Белимумаб: прогресс в лечении системной красной волчанки. Научно-практическая ревматология 2012; 54 (5): 13–19; [E. L. Nasonov, T. M. Reshetnjak, S. K. Soloviev. Belimumab: progress v lechenii sistemnoj krasnoj volchanki. Nauchno-prakticheskaja revmatologija 2012; 54(5): 13–19].
WeiYu Lin, Seshasayee D, Lee WP, et al. Dual B Cell Immunotherapy Is Superior to Individual Anti-CD20 Depletion or BAFF Blockade in Murine Models of Spontaneous or Accelerated Lupus. Arthritis Rheum. 2015; 67 (1): 215–224. DOI: 10.1002/art. 38907.
Kraaij T, Huizinga TW, Rabelink TJ, et al. Belimumab after rituximab as maintenance therapy in lupus nephritis. Rheumatology. 2014; 53: 2122–2124. DOI: 10.1093/rheumatology/keu369. Epub 2014 Sep. 8.
De Vita S., Quartuccio L., Salvin S et al. Sequential therapy with belimumab followed by rituximab in Sjögren’s syndrome associated with B-cell lymphoproliferation and overexpression of BAFF: evidence for long-term efficacy. Clin Exp Rheumatol. 2014; 32 (4): 490–4.
Источник