- Мутации гена EGFR
- Роль рецептора EGFR и мутаций гена EGFR в патогенезе немелкоклеточного рака легкого
- Что такое EGFR?
- Зачем определять статус мутации гена EGFR?
- Какие биоматериалы могут быть отправлены на EGFR-тестирование?
- О Программе тестирования мутаций гена EGFR у пациентов с немелкоклеточным раком легкого
- Каким пациентам необходимо молекулярно-генетическое тестирование на наличие мутации гена EGFR?
- Генетика и онкология: главные вопросы
Мутации гена EGFR
Роль рецептора EGFR и мутаций гена EGFR в патогенезе немелкоклеточного рака легкого
Многочисленные биологические исследования выявили повышенную активность рецептора EGFR и каскада, запускающегося при активации этого рецептора, у больных немелкоклеточным раком легкого.
Что такое EGFR?
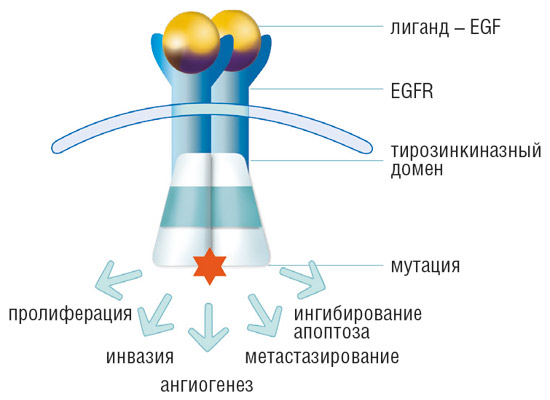
- EGFR – трансмембранный рецептор, активирующийся при связывании с эпидермальным фактором роста, трансформирующим фактором роста-α, амфирегулином.
- При активации EGFR внутри клетки запускается каскад биохимических реакций, приводящих к повышению пролиферации малигнизированных (опухолевых) клеток, росту опухоли, стимуляции процессов инвазии, патологического ангиогенеза и метастазирования.
- Рецептор EGFR кодируется геном EGFR.
В ряде опухолей обнаруживаются аномальные рецепторы эпидермального фактора роста, что обусловлено наличием мутации в соответствующем гене. В клетках с мутацией происходит активация сигнального пути EGFR, что, в свою очередь, инициирует процессы злокачественной трансформации в большинстве опухолей. Сигнальные пути контролируют процессы пролиферации, апоптоза – одного из механизмов клеточной гибели, утраты способности клеток к дифференцировке, процессы ангиогенеза и метастазирования.
Зачем определять статус мутации гена EGFR?
Тест на мутацию гена EGFR предназначен для отбора больных местно-распространенным или метастатическим немелкоклеточным раком легкого на терапию низкомолекулярными ингибиторами EGFR (ингибиторами тирозинкиназы).
Наличие мутаций гена EGFR позволяет выделить группу пациентов с наибольшей вероятностью выраженного ответа на терапию ингибиторами тирозинкиназы (гефитиниб).
Известны активирующие мутации гена EGFR, связанные с чувствительностью либо устойчивостью к ингибиторам тирозинкиназы. Подавляющее большинство мутаций, связанных с чувствительностью (
90%), – это делеции в 19 экзоне (Del19) или замена L858R в 21 экзоне. Опухоли с мутациями Del19 или L858R наиболее чувствительны к терапии ингибиторами тирозинкиназы EGFR. Прочие мутации, связанные с чувствительностью (G719X, L861Q, S768I и некоторые другие), составляют в сумме
5% мутантных случаев.
Инсерции 20 экзона связаны с устойчивостью к ингибиторам тирозинкиназы и составляют
3% опухолей с мутациями. Еще одна мутация, связанная с устойчивостью, – T790M. Частота выявления этой мутации после проведения химиотерапии ингибиторами тирозинкиназы составляет примерно 50%, однако в 1-3% случаев мутация может возникать de novo. Мутация T790M в гене EGFR является наиболее частой причиной возникновения резистентности к проводимой таргетной терапии. Своевременное выявление этой мутации позволяет выяснить причину резистентности и принять решение о смене терапии у пациента. Поэтому для назначения эффективной таргетной терапии всем больным немелкоклеточным раком легкого необходим анализ как на наличие мутаций чувствительности, так и на наличие/отсутствие мутаций устойчивости к ингибиторам тирозинкиназы.
Определение статуса мутации гена EGFR и персонализированный подход к выбору терапии, основанный на результатах молекулярно-генетического тестирования, позволят сделать лечение немелкоклеточного рака легкого более эффективным и приблизиться к международным тенденциям клинической практики.
Какие биоматериалы могут быть отправлены на EGFR-тестирование?
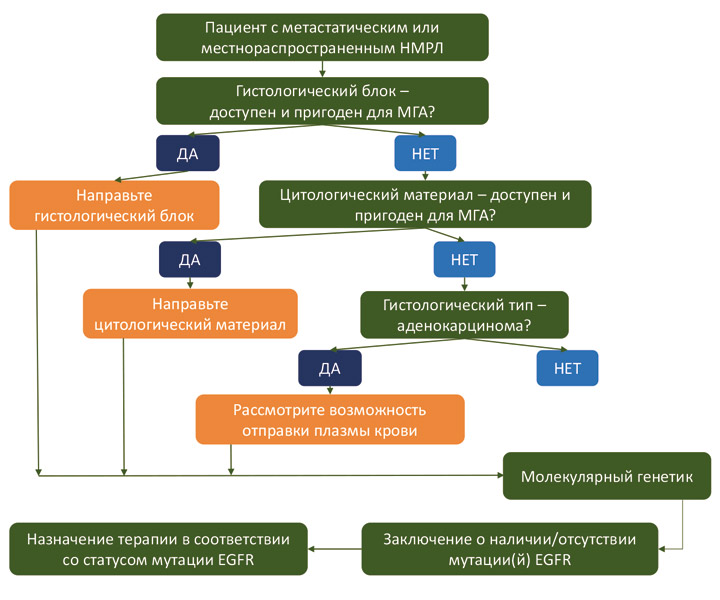
Анализ можно выполнить с использованием гистологического материала, цитологического материала или образца плазмы крови. Предпочтительна отправка гистологического материала, так как именно в этом случае достигается максимальная чувствительность анализа. Результативность тестирования по цитологическому материалу сопоставима с результатами, полученными для гистологических блоков. Если у пациента есть цитологический материал, то (в отсутствие гистологического) он представляет собой приемлемую альтернативу для EGFR-тестирования. В случаях, когда у пациента с аденокарциномой легкого отсутствует материал опухоли, следует рассмотреть возможность отправки плазмы крови на EGFR-тест. Несмотря на относительно низкую чувствительность и высокую трудоемкость анализа по плазме крови, он может быть единственной опцией для пациентов, чей опухолевый материал (гистологический или цитологический) утрачен или полностью израсходован на другие исследования.
Алгоритм выбора биоматериала для выполнения EGFR-тестирования приведен на схеме ниже:
Видеоинструкция по получению плазмы крови для EGFR-тестирования:
О Программе тестирования мутаций гена EGFR у пациентов с немелкоклеточным раком легкого
- Тестирование в рамках Программы проводится на всей территории страны.
- Отправка материала и тестирование проводится бесплатно для врачей и пациентов.
Каким пациентам необходимо молекулярно-генетическое тестирование на наличие мутации гена EGFR?
Пациентам с распространенным (местно-распространенным или метастатическим) немелкоклеточным раком лёгкого (в частности: аденокарцинома легкого, крупноклеточный рак, плоскоклеточный и аденоплоскоклеточный рак и др.).
Благодарим ООО «АстраЗенека Фармасьютикалз» за спонсорскую поддержку тестирования.
- Reck M, Clint L. Lung Cancer. 2009 Jan; 63(1): 1-9.
- Lynch T, Bell DW. Sordella Retal. N Engl J Med. 2004 May 20; 350(21): 2129-3.
- Herbst RS, Hyemach JV, Lippman SM. N Engl J Med. 2008 Sep 25; 359(13): 1367-80.
- Gazdar AF, Shigematsu H, Herz J, Minna JD. Trends Mol Med. 2004 Oct; 10(10): 481-6.
- Mok T, et al. N Engl J Med 2009; 361: 947-957.
- Han J, et al. J Clin Oncol 2012; 30: 1122-1228.
- Maemondo M, et al. N Engl J Med 2010; 362: 2380-2388.
- Mitsudomi T, et al. Lancet Oncol 2010; 11: 121-128.
- Zhou C et al. Lancet Oncol 2011; 12: 735-742.
- Rosell R, et al. Lancet Oncol 2012; 13: 239-246.
- Gridelli C, et al. J Clinical Oncol 2012; 30: 3002-3011.
- Wu Y, et al. Lancet Oncol 2014; 15: 213-222.
- Sequist L, et al. J Clin Oncol 2013; 31: 3327-3334.
- Haratani K, Hayashi H, Tanaka T, et al. Ann Oncol 2017; 28(7): 1532-1539.
Войти
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Источник
Генетика и онкология: главные вопросы
Александр Олегович Иванцов, доктор медицинских наук
— Александр Олегович, что такое мутация? Как возникают «поломки» в молекулах ДНК?
— Организм человека состоит из большого числа специализированных клеток, ядра которых содержат нуклеиновые кислоты: ДНК и РНК. Совокупность этих молекул содержит биологическую информацию, необходимую для построения и поддержания клеток, органов и систем органов в целом. Весь наследственный материал, заключённый в клетке, получил название – геном. У человека он представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре. ДНК является длинной полимерной молекулой, она хранит биологическую информацию в виде генетического кода, состоящего из последовательности повторяющихся блоков — нуклеотидов. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, которые необходимы для последующего биосинтеза важнейших белков. Открытие структуры ДНК в 1953 году стало поворотным моментом в развитии биологии, а исследователям Фрэнсису Крику, Джеймсу Уотсону и Морису Уилкинсу была присуждена Нобелевская премия в 1962 году. Стойкое изменение генома получило название – мутация. Эти изменения могут касаться структуры отдельных генов, хромосом и генома в целом. То есть изменение последовательности нуклеотидов приводит к нарушениям в кодировании информации – в итоге к аномалиям на уровне качества или количества соответствующих белков.
— Почему некоторые мутации приводят к развитию рака? Как устроен этот механизм? Как ученые определяют, какие именно «поломки» в ДНК приводят к развитию злокачественных опухолей?
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов – клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель. Это возможно по двум причинам – либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. – экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?
— Да, конечно, можно. Спектр генетических повреждений в опухолях характеризуется удивительным многообразием. Например: амплификации (увеличение копийности генов), делеции, инсерции, транслокации, микромутации (точковые замены, микроделеции, микроинсерции) и так далее. Кроме того, в опухоли изменяются уровни экспрессии генов в результате аномального метилирования их промоторов.
Существует много методов, используемых для выявления мутаций в опухолевой ткани, и достаточно много ситуаций, когда это требуется. Выявление определённых мутаций иногда помогает поставить диагноз, определить лечебную тактику, прогноз и так далее. Наиболее часто для молекулярного тестирования используются технологии полимеразной цепной реакции (ПЦР) и секвенирования нового поколения (NGS, next generation sequencing). Обе технологии универсальны и используются для анализа любой генетической последовательности, а также многократно превосходят все другие технологии по своей чувствительности, специфичности и не сопряжены с риском получения «промежуточных», неинтерпретируемых результатов. Секвенирование экзома позволяет выявить все мутации в кодирующих последовательностях генома в каждой конкретной опухоли. Именно полногеномное секвенирование значительно расширяет возможности персонализированного подбора препаратов, предназначенных для специфического поражения мутированных онкобелков.

— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
— Вообще, бывают наследственные и ненаследственные опухоли. Наследственные опухолевые синдромы составляют незначительную долю от общего числа новообразований (около 1%), хотя для определённых локализаций (молочная железа, яичник, толстая кишка) их удельный вклад достигает более высоких показателей (5-20 %). Носительство наследуемой «раковой» мутации является причиной подобного заболевания. В этих случаях, в каждой клетке организма человека есть повреждение, которое передалось ему по наследству. Лица, имеющие такой генетический дефект, остаются практически здоровыми до определенного момента. В то же время они обладают фатально высоким риском возникновения опухолей (85-100%).
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно. Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK – кризотиниба – у больных с ALK-транслоцированными карциномами легкого. Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF – вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины. В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— Какие исследования, связанные с мутациями ДНК, сейчас проводятся в научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»?
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.
Источник