- Снижение овариального резерва — симптомы и лечение
- Определение болезни. Причины заболевания
- Симптомы снижения овариального резерва
- Патогенез снижения овариального резерва
- Классификация и стадии развития снижения овариального резерва
- Осложнения снижения овариального резерва
- Диагностика снижения овариального резерва
- Лечение снижения овариального резерва
- Прогноз. Профилактика
Снижение овариального резерва — симптомы и лечение
Что такое снижение овариального резерва? Причины возникновения, диагностику и методы лечения разберем в статье доктора Каменецкого Б. А., репродуктолога со стажем в 30 лет.
Определение болезни. Причины заболевания
Снижение овариального резерва (СОР) — это уменьшение либо отсутствие реакции яичников на стимулирующую терапию. Заболевание «Снижение овариального резерва» в МКБ-10 (Международной Классификации Болезней 10-й редакции) отсутствует [1] . Наиболее близкие термины:
- E28.3 — Первичная яичниковая недостаточность;
- E28.8 — Другие виды дисфункции яичников.
Термин «Снижение овариального резерва» появился благодаря успехам в области репродуктивной медицины, где основной задачей стимулирующей терапии является получение не одной, а нескольких яйцеклеток. Большинство отечественных авторов рассматривают овариальный резерв как функциональную возможность яичника формировать фолликулы со зрелым (полноценным) ооцитом [4] [5] [6] .
Распространение вспомогательных репродуктивных технологий привело к тому, что овариальный резерв и его снижение рассматриваются с позиций ответа яичника на воздействие гонадотропных препаратов. Гонадотропины — группа препаратов, оказывающих влияние на половые железы, в том числе способствующие созреванию фолликулов в яичниках. Нормальный овариальный резерв — адекватному ответ яичников на стимуляцию. Под адекватным ответом понимается требуемый рост фолликулов и получение достаточного количества ооцитов. Достаточное количество определяется не столько числом получаемых ооцитов, сколько количеством полученных после оплодотворения эмбрионов с правильным хромосомным набором.
В зависимости от возраста женщины для получения одного нормального эмбриона требуется разное количество ооцитов:
- до 39 лет — от 3 до 5 ооцитов;
- в 40 лет – не менее 7;
- в 41 год — 9 и более;
- в 42 года — более 12;
- в 45 лет — не менее 44 [50] .
Сниженный овариальный резерв при стимуляции для женщины до 39 лет — это менее 5 ооцитов [37] .
Предложенная терминология описывает только функциональный резерв, но не учитывает пула покоящихся (примордиальных) фолликулов. Примордиальные фолликулы — это мелкие фолликулы, которые формируются к моменту рождения и располагаются в виде скоплений под белочной оболочкой яичника. Именно поэтому исследователи предлагают использовать термин «овуляторный потенциал», то есть способность фолликула к овуляции при адекватной стимуляции гонадотропинами [7] . Также предлагаются альтернативные определения, такие как «потенциал рождаемости», «репродуктивный резерв», но с обязательным включением в определение пула покоящихся фолликулов. С практической точки зрения, такие определения спорны, так как объективно измерить пул покоящихся фолликулов без гистологического исследования невозможно.
Причины развития СОР можно условно разделить на две группы:
- Физиологические. Возраст — ключевой физиологический фактор, определяющий постепенное снижение овариального резерва [8] . С увеличением репродуктивного возраста снижается количество и качество ооцитов. Кроме того, в отличие от других клеток организма, половые клетки не регенерируют [8][9] . У 95 % женщин в возрасте 30 лет присутствует только 12 % ооцитов от их количества до рождения, а к 40 годам — только 3 % [10] .
- Патологические. К ним относятся заболевания, ятрогенные причины (осложнения после лечения), влияние факторов внешней среды. Сюда входят и генетически обусловленные нарушения:
- анеуплоидия (присутствие дополнительной или отсутствие одной хромосомы) и структурные перестройки Х-хромосомы;
- cиндром Шерешевского — Тернера и другие заболевания, связанных с нарушениями эмбрионального развития половых желёз;
- cиндром ломкой Х-хромосомы — мутация в гене FMR1 в Х-хромосоме;
- наличие аутосомных генетических мутаций (галактоземия);
- аутоиммунные болезни — наличие антител к клеткам, которые синтезируют половые гормоны (болезнь Аддисона) и аутоиммунные заболевания щитовидной железы.
Симптомы снижения овариального резерва
Снижение овариального резерва — процесс, растянутый во времени, которые чаще всего протекает без симптомов. Причиной, заставляющей женщину обратиться к врачу, является отсутствие беременности (бесплодие).
Наиболее яркие симптомы, которые характеризуют угасание функции яичников, — признаки эстрогенной недостаточности (приливы, потливость, тахикардия) и со временем аменорея в возрасте до 40 лет [17] [18] .
Патогенез снижения овариального резерва
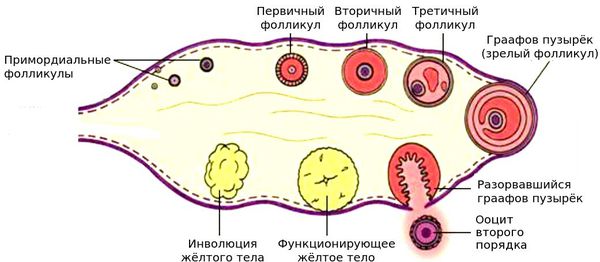
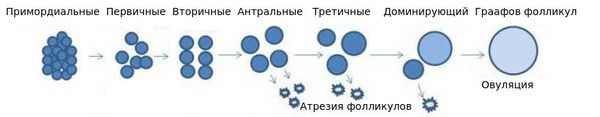
Снижение общего количества ооцитов происходит в течение всей жизни женщины. Пиковое количество ооцитов, присутствующих в яичнике, определяется ещё до рождения: на 20-й неделе внутриутробного развития в яичниках плода женского пола закладывается порядка 7 млн оогониев (предшественников ооцитов) [12] [13] , но уже с 24-26 недели внутриутробного развития их количество снижается. Это происходит в результате процесса, известного как атрезия [11] . Атретический фолликул — фолликул, подвергающийся обратному развитию, в нём имеются признаки гибели ооцита (сморщенная блестящая оболочка, уменьшенный объём цитоплазмы и сморщивание клеточного ядра).
К началу полового созревания количество ооцитов не превышает 300 тысяч [12] [13] . В течение всей жизни овуляции достигают не более 400-500 фолликулов [14] [15] .
Наиболее быстрыми темпами снижение овариального резерва происходит при достижении женщиной 37-38 лет. В этот период скорость потери фолликулов увеличивается практически вдвое [16] .
Механизмы потери фолликулов с возрастом недостаточно изучены, но проведённые исследования показали, что при сокращении примордиального пула фолликулов до 25000 скорость потерь удваивается. Обычно такое сокращение происходит к 37,5 годам [51] .
К другим причинам, оказывающим негативное влияние на уровень овариального резерва, относятся:
- Воспалительные заболевания органов малого таза. Результатом воспаления яичников является выраженный склероз стромы (соединительной ткани, покрывающей яичник) с сопровождающим его нарушением питания фолликулярного аппарата и снижением пула примордиальных фолликулов [20][21] .
- Ятрогенные причины. На сегодняшний день известно, что любое оперативное вмешательство на яичниках приводит к значительному снижению овариального резерва и как следствие к уменьшению эффективности методов вспомогательной репродукции [24] . Одним из наиболее частых вмешательств при лечении синдрома поликистозных яичников до недавнего времени была операция по иссечению не менее 2/3 ткани яичника. Ещё более травматичной и необоснованной хирургической тактикой является оперативное лечение ретенционных кист яичников — доброкачественного образования, возникшего вследствие закрытия протока наботовой железы. Последствием подобной оперативной тактики становится потеря значительной части функциональной ткани яичника [22] . Сегодня подобные вмешательства встречаются достаточно редко, но это не единственный пример «хирургического экстремизма». В анамнезе многих женщин, обращающихся за помощью по поводу бесплодия, есть указания на перенесённые операции на органах малого таза [22][23] . Проведённые вмешательства (аппендэктомия, удаление ретенционных кист яичников, восстановление проходимости маточных труб, коагуляция очагов эндометриоза) часто приводят к возникновению спаечного процесса в малом тазу [22][23] . Спаечный процесс вызывает выраженные сосудистые изменения, нарушение трофики яичника и негативно воздействует на уровень овариального резерва [25][26] .
- Алкогольная и никотиновая интоксикации[19] . Существенную негативную роль на уровень овариального резерва оказывает табакокурение. Показано, что токсическое действие никотина на яичники проявляется в ускорении процессов апоптоза (гибели) фолликулов, что проявляется снижением концентрации уровня АМГ (антимюллерового гормона) [27][28] . Аналогичным действием обладает и употребление алкоголя [29] .
- Лучевая и химиотерапия. Крайне негативно на овариальный резерв и репродуктивную функцию влияет радиационное облучение и химиотерапия при лечении онкологических заболеваний. Следствием этих воздействий часто становиться почти полная потеря овариального запаса яичников, преждевременное угасание их функции и ранняя менопауза [31] . Решающими факторами при проведении химио- или лучевой терапии является доза радиации, а также репродуктивный возраст женщины [32][33] . Например, терапия лимфогранулематоза вызывает стойкую менопаузу у 38-57 % пациентов, а в группе женщин старше 35 лет химиотерапия приводит к стойким необратимым изменениям менструальной функции [33] .
- Влияние химических веществ, используемых в промышленности и сельском хозяйстве. В качестве исторической справки следует упомянуть токсическое влияние на репродуктивную функцию дихлордифенилтрихлорэтана и диэтилстильбэстрола, которые по своей химической структуре являются аналогами эстрогенов. Эти компоненты оказывают влияние на плод женского пола ещё внутриутробно [30] .
- Эпидемический паротит (свинка). Есть предположение, что девочки, переболевшие свинкой, параллельно бессимптомно перенесли воспаление яичников, что способствовало ускоренной гибели фолликулов.
Классификация и стадии развития снижения овариального резерва
Общепринятой классификации не существует. На данный момент в большей степени исследуются практические аспекты решения проблемы — получения достаточного количества ооцитов при проведении стимулирующей терапии. Именно в этом ракурсе последние десятилетия предпринимались попытки ввести диагностические критерии. Одной из основных проблем при сравнении этих исследований было отсутствие единого определения, так называемого «плохого ответа». Значительные различия в определении критериев сделали практически невозможным разработку или оценку какого-либо протокола или метода лечения [34] [35] .
С этой целью рабочая группа Европейского общества репродукции человека и эмбриологии (ESHRE) попыталась стандартизировать определение «плохого ответа» для стимуляции женщин со сниженным овариальным резервом (Болонский консенсус) [36] . Для прогнозирования «плохого ответа» Болонский консенсус рекомендует учитывать наличие как минимум двух из нижеперечисленных условий:
- старший репродуктивный возраст женщины (35 лет и выше);
- наличие слабого ответа (три и менее) в предшествующих обычных протоколах стимуляции;
- снижение любого из диагностических критериев — количество антральных фолликулов (КАФ) менее 5-7 или уровень антимюллерового гормона (АМГ) ниже 0,5-1,1 нг/мл (3,57-7,85 пмоль/л).
Два любых эпизода «плохого ответа» после максимальной стимуляции считаются достаточными для определения пациента как «слабого ответчика». Консенсус позволил внести ясность не только в формулировку сниженного овариального резерва, но и определил прогностические критерии для планирования стимулирующей терапии [36] .
С накоплением данных стало понятно, что в группу пациентов со сниженным овариальным резервом, а как следствие с неадекватным ответом на стимулирующую терапию, включены женщины с разными причинами возникновения и механизмами развития патологии. Это затрудняло планирование адекватной терапии. В связи с этим в 2016 году была сформирована рабочая группа POSEIDON ( Patient-Oriented Strategies Encompassing Individualize Oocyte Number) [37] по разработке новых критериев и классификации пациентов со сниженным овариальным резервом и бедным ответом яичников на стимуляцию.
Чтобы представить более детальную картину, были предложены клинически значимые критерии, которые могут помочь врачу в ведении пациентов. Для определения групп с низким прогнозом на стимуляцию предложены две новые категории [37] :
Первая группа включает количество получаемых при стимуляции ооцитов:
- «субоптимальный ответ» — получение от четырёх до девяти ооцитов в любом возрасте связано со значительно более низкой частотой живорождений по сравнению с пациентами, у которых получено 10-15 ооцитов [38] ;
- «гипореагирование» — для получения адекватного количества ооцитов (более трёх) требуется более высокая доза гонадотропинов и более продолжительная стимуляция [39] .
Вторая группа объединяет «качественные» и «количественные» параметры, а именно:
- возраст пациента и ожидаемая частота анеуплоидии;
- биомаркеры и функциональные маркеры — АМГ и количество антральных фолликулов (их размер достигает 2-10 мм, можно увидеть на УЗИ).
В результате введения этих категорий выделяют четыре группы пациентов со сниженным овариальным резервом и низким ответом на стимулирующую терапию:
- Первая группа:
- возраст до 35 лет;
- количество антральных фолликулов (КАФ) более 5;
- АМГ более или равно 1,2 нг/мл.
- Вторая группа:
- возраст более 35 лет;
- КАФ более 5;
- АМГ более или равно 1,2 нг/мл;
- неожиданно бедный ответ при стандартной стимуляции в ЭКО.
- Третья группа:
- возраст до 35 лет;
- КАФ менее 5;
- АМГ менее 1,2 нг/мл.
- Четвёртая группа:
- возраст более 35 лет;
- КАФ менее 5;
- АМГ менее 1,2 нг/мл.
- ожидаемо бедный ответ.
Выделение отдельных групп решает практическую задачу — планирование терапии с учётом детальных критериев для пациентов разных этиопатогенетических групп.
Осложнения снижения овариального резерва
Основное осложнение — бесплодие [52] . В результате резкого снижения количества фолликулов часть циклов проходит без овуляции. Бесплодие при СОР неизлечимо, возможны лишь варианты преодоления проблемы. Чаще всего при отсутствии результатов в программах ЭКО с использованием собственных ооцитов, альтернативным решением является применение донорских яйцеклеток, что вряд ли можно назвать лечением в привычном понимании.
Вторым по значимости осложнением является преждевременное истощение яичников и, как следствие, нарушение менструальной функции вплоть до её полного угасания. Снижение овариального резерва приводит к критическому снижению количества ооцитов и нарушение менструального цикла по типу:
- пройоменореи — сокращение цикла до менее 24 дней;
- гипоменореи — скудные месячные;
- спаниоменореей — сокращение количества менструальных циклов;
- аменореи — отсутствие менструальных выделений.
По мере снижения уровня эстрогенов появляются вегетативные симптомы: приливы, потливость, тахикардия. Пациенты жалуются на нарушения сна, эмоциональную неустойчивость, частую смену настроения и другие признаки приближения менопаузы [54] .
Угасание овариальной функции влияет и на состояние других органов и систем организма. Начинает страдать опорно-двигательный аппарат — за счёт снижения уровня эстрогенов в крови нарушается электролитный баланс организма и начинается «вымывание» электролитов, что проявляется повышенной хрупкостью костей. Также может страдать сердечно-сосудистая система [53] .
Диагностика снижения овариального резерва
Диагностика строится на совокупности анамнестических и клинико-лабораторных данных. Наиболее важным является возраст. Клинические проявления снижения овариального резерва зачастую начинают проявляться после 35 лет.
Очень часто в анамнезе есть упоминания о раннем наступлении климакса у ближайших родственников по женской линии (мать, старшие сестры).
Основными жалобами являются нарушение (чаще сокращение продолжительности и интенсивности) менструального цикла и бесплодие.
Из объективных критериев:
- достоверное повышение уровня фолликулостимулирующего гормона (ФСГ) до 40 МЕ/л [14][18][40] ;
- снижение уровня антимюллерового гормона (АМГ) менее 1,2 нг/мл [37] ;
- при ультразвуковом исследовании — снижение количества антральных фолликулов (КАФ) [37] .
Из вышеперечисленных критериев на сегодняшний день наиболее информативным критерием для постановки диагноза СОР является определение АМГ [41] [42] . Концентрация АМГ более связана с количеством антральных фолликулов, определяемом при проведении ультразвукового исследования, чем с ранее используемыми критериями концентрации ФСГ или Ингибина B (гликопротеина, который синтезируется в фолликулах яичников) [43] [44] . Ценность определения антимюллерового гормона заключается в его низкой вариабельности от цикла к циклу [45] .
Лечение снижения овариального резерва
Патогенетического лечения не существует. Терапия направлена прежде всего на устранение последствий снижения овариального резерва, а именно преодоления бесплодия.
В программах вспомогательной репродукции в зависимости от принадлежности пациентки к той или иной группе по критериям POSEIDON рассматриваются различные стратегии стимулирующей терапии для получения большего количества ооцитов.
Для первой и второй групп применяется пять основных стратегий отдельно или в комбинациях:
- приоритет в использования рекомбинантного ФСГ (фолликулостимулирующего гормона) по сравнению с гонадотропинами, получаемыми из мочи;
- увеличение разовой и суммарной дозы ФСГ для проведения стимуляции;
- использование рекомбинантного ЛГ (лютеинизирующего гормона);
- добавление стероидного гормона дегидроэпиандростерона (DHEA) перед овариальной стимуляцией;
- применение протокола двойной стимуляции (DuoStim) [46] .
Наиболее сложными с позиции получения достаточного количества ооцитов по критериям POSEIDON являются пациентки, относящиеся к третьей и четвёртой группам .
Стратегии, предложенные для стимуляции пациенток третьей и четвёртой групп:
- применение индивидуальных протоколов стимуляции — минимальная, низкодозная стимуляция, натуральный цикл (получение яйцеклеток без проведения стимуляции яичников) [47][48] ;
- индивидуальная стратегия триггера овуляции (им может быть, например хорионический гонадотропин человека или агонист гонадотропин-рилизинг гормона);
- применение адъювантной (дополнительной) предварительной терапии [46] .
Несмотря на активное применение низкодозовых протоколов, исследования последних лет поддерживают идеи стимуляции высокими дозами рекомбинантного ФСГ с добавлением рекомбинантного ЛГ [46] .
При невозможности получения достаточного количества ооцитов рекомендовано использование донорских ооцитов.
Прогноз. Профилактика
Прогноз для жизни благоприятный. При критическом снижении овариального резерва и наступлении климактерических изменений необходимо применять заместительную гормональную терапию. Её проводят для предотвращения осложнений опорно-двигательной системы (остеопороза), нарушений электролитного баланса организма и «вымывания» электролитов, развития болезней сердечно-сосудистой системы [53] .
Для профилактики бесплодия рекомендовано:
- планировать и реализовать репродуктивную функцию до 35 лет, особенно женщинам, находящимся в группе риска (ранняя менопауза у матери, эндометриоз, оперативные вмешательства на яичниках);
- исключить вредные привычки (курение, употребление алкоголя);
- банкинг ооцитов или эмбрионов в случае, если беременность и роды не планируются до 35 лет, или перед предстоящей химио- и/или лучевой терапией при лечении онкологических заболеваний.
Профилактика ятрогенных осложнений:
- сократить оперативные вмешательства в случаях, когда возможно применить консервативную терапию;
- при необходимости операции на яичниках максимально бережно относиться к овариальной ткани [55] .
Источник