Так ли страшны новые штаммы? Ответы на самые важные вопросы о мутациях коронавируса
Появление новых штаммов коронавируса, имеющих необычные свойства, вызывают тревогу людей во всем мире. Руководитель научной группы разработки новых методов диагностики заболеваний человека Центрального научно-исследовательского института эпидемиологии Роспотребнадзора Камиль Хафизов рассказал о том, что сейчас известно о мутациях COVID-19 и нужно ли будет ежегодно от него прививаться, как мы это делаем в случае с гриппом.
— Сколько всего штаммов коронавируса выявлено на сегодняшний день в мире?
— В первую очередь стоит обратиться к определению штамма вируса как некоторого варианта патогена, который обладает уникальными и стабильными фенотипическими характеристиками. При этом стоит отметить, что вирусы, особенно РНК-содержащие, постоянно мутируют, перебирая разные варианты изменений в геноме, и даже внутри одного человека может содержаться множество версий одного вируса, отличающихся отдельными изменениями в геноме, которые далеко не всегда приводят к образованию нового штамма.
Варианты SARS-CoV-2 циркулируют во всем мире, и после появления некоторые варианты довольно быстро исчезают, другие, наоборот, закрепляются в популяции, процесс динамический. Сколько всего штаммов нового коронавируса существует в природе на данный момент, неизвестно, в том числе из-за размытости самого понятия и факта того, что свойства многих геновариантов вируса пока не изучены.
Так, популярный ресурс PANGO lineages выделяет значительное число отдельных линий патогена, и различные организации во всем мире изучают варианты вируса, чтобы понять, являются ли они более контагиозными, изменяющими тяжесть течения заболевания, детектируемыми доступными диагностическими тестами, отвечающими на терапию, изменяющими эффективность вакцин против COVID-19 и т.п. Потому куда чаще термин «штамм» используется для каких-то особо интересных вариантов патогена, как, например, британского или южноафриканского, которые характеризуются ключевыми изменениями в геноме и имеют важные (часто выгодные патогену) свойства. Так, было введено понятие VoC (от англ. Variants of Concern. — Прим. ред.) — «варианты, вызывающие беспокойство», к которым сейчас причисляют несколько штаммов, включая вышеперечисленные.
— Сколько из них есть в России?
— Строгого ответа нет. Какая-то доля всех штаммов коронавируса, которые распространяются на планете, есть уже и в России, какие-то будут завезены в будущем, какие-то появятся у нас в стране независимо. Ученые во многих лабораториях в мире и в нашей стране сейчас проводят активную работу по секвенированию геномов патогена из различных регионов, чтобы как можно быстрее выявлять новые варианты, мониторить скорость их распространения, устанавливать источники заносов из-за рубежа, определять свойства, корректировать тест-системы в случае необходимости. Из известных штаммов в РФ были выявлены британский, южноафриканский, индийский и несколько локальных.
— Какие штаммы коронавируса самые опасные и проникают внутрь всего организма, а какие — наоборот?
— Как уже говорил выше, само определение штамма подразумевает новые стойкие свойства патогена. Чаще всего приходится иметь дело либо с повышенной заразностью вируса (как, например, в случае с британским штаммом, который, по различным оценкам, примерно на 50% более заразен, чем другие, «старые» версии), либо же со снижением эффективности связывания с нейтрализующими антителами, возникшими после вакцинации или перенесенного ранее заболевания (так в случае с южноафриканским вариантом).
При этом сразу хотел бы отметить, что уменьшение эффективности вовсе не означает отсутствие защиты, но она может быть несколько снижена. В любом случае всячески выступаю за вакцинацию, которая если и не защитит на 100% от заболевания, то может кардинально снизить тяжесть его протекания.
— Какие штаммы наиболее всего распространены в Москве, какими больше всего болеют в России?
— За последнее время мы видим несколько сотен завозов британского штамма как по России, так и в Москве, что вполне ожидаемо ввиду его свойств. Появляются и некоторые локальные российские версии вируса, у которых встречаются мутации в геноме, характерные для британского и южноафриканского вариантов, но пока преждевременно говорить о том, что они действительно обладают какими-то особыми для людей свойствами. По этой же причине мы не хотели бы сейчас раздавать новые имена таким вариантам, по крайней мере до накопления достаточного объема данных.
— От всех ли штаммов болезнь длится одинаково или есть разница?
— В какой-то момент появилась информация, что пациенты с британским вариантом инфекции болеют тяжелее, и летальность в таких случаях выше. Это впоследствии было опровергнуто другими исследованиями, и с тех пор я не видел новой информации. Похожая информация появлялась и про калифорнийский вариант.
Нужно отметить, что тяжесть протекания заболевания зависит от множества факторов, и, как известно, многие вообще переносят болезнь бессимптомно, кто-то же крайне тяжело. Такие факторы, как наличие сопутствующих заболеваний, общее состояние организма, возраст, играют существенно большую роль в развитии тяжелой болезни, чем наличие мутаций в геноме патогена, по крайней мере известных на данный момент.
— Может ли бы такое, что к одному штамму коронавируса у человека есть иммунитет, а к другому нет?
— Перенесенная ранее коронавирусная инфекция или вакцинация в норме вызывают иммунный ответ, и в результате в организме появляются нейтрализующие антитела, хотя защита обусловлена не только ими, потому не стоит пугаться, даже если уровень антител невысок или падает. Но да, мы уже знаем, что ряд мутаций в геноме нового коронавируса приводит к изменениям в структуре его белков, придавая патогену новые свойства, иногда удачные для патогена, в том числе с точки зрения снижения связывания нейтрализующими антителами. Потому точно ответить, что к одному штамму у человека есть иммунитет, а к другому нет, нельзя, но эффективность защиты может быть разной, в зависимости от того, с каким новым вариантом вируса вновь встретился пациент.
В связи с этим достаточно вероятна ситуация, что вакцины против нового коронавируса придется периодически обновлять и иммунизироваться ежегодно, как это сейчас происходит с тем же вирусом гриппа. Думаю, к осени мы накопим достаточное количество данных по эффективности существующих вакцин против новых штаммов. Потому еще раз говорю: на данный момент известных причин избегать вакцинации нет, если только нет прямых противопоказаний по состоянию здоровья.
Источник
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
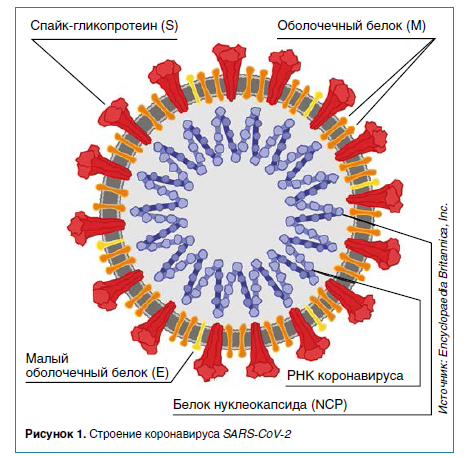
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021
Источник



