- Что значит координационное число комплексообразователя
- Урок №15. Комплексные соединения
- Координационное число
- Содержание
- Координационное число в химии
- Координационное число в кристаллографии
- См. также
- Источники
- Примечания
- Полезное
- Смотреть что такое «Координационное число» в других словарях:
- Что значит координационное число комплексообразователя
Что значит координационное число комплексообразователя
| Форум » Химическое образование » Типовые задачи и решения по комплексным соединениям » координационное число комплексообразователя. (Определение КЧ комплексообразователя и дентатности лигандов.) |
координационное число комплексообразователя.
| plick | Дата: Понедельник, 07.01.2013, 13:18 | Сообщение # 1 | |
| Координационное число комплексообразователя (КЧ) показывает число связей, которые он образует со всеми лигандами в данном комплексном ионе. Дентатность лиганда — число связей, которыми он соединен с комплексообразователем. Дентатность лиганда и его степень окисления — это совершенно разные вещи и их не стоит путать и объединять. Остановимся на первых двух типах дентатности. Бидентатные лиганды (те лиганды, которые образуют 2 связи с комплексообразователем) — сульфат-ионы SO4 2- , тиосульфат-ионы S2O3 2- , оксалат-ионы С2О4 2- , многие органические лиганды. Сумма дентатностей всех лигандов в данном комплексном ионе всегда равна координационному числу комплексообразователя. | ||
| |
| plick | Дата: Понедельник, 07.01.2013, 14:44 | Сообщение # 2 |
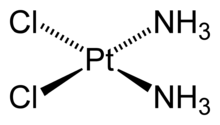
| Задача Определить координационное число комплексообразователя и дентатность лигандов в соединениях: [Ag(NH3)2]OH; [Co(H2O)2(NH3)2SO4]; K2[Os(SO4)2Cl2]; [Cr(NH3)2(H2O)2SO4]Cl [Fe(CO)2(NO)2] Решение. [Co(H2O)2(NH3)2SO4]. В составе данного комплексного соединения 3 вида лигандов: 2 молекулы воды, 2 молекулы аммиака, сульфат-ион. K2[Os(SO4)2Cl2]. Комплексный ион [Os(С2O4)2Cl2]2 + . 2 хлорид иона являются монодентатными лигандами, 2 оксалат иона — бидентатными, отсюда, КЧ (Os 8+ ) = 6. [Cr(NH3)2(H2O)2SO4]Cl. Комплексный ион: [Cr(NH3)2(H2O)2SO4] + молекула аммиака, 2 молекулы воды — монодентатные лиганды. Сульфат-ион — бидентатный лиганд. КЧ(Cr 3+ ) = 6 Источник Урок №15. Комплексные соединенияКомплексные соли — это сложные вещества, в состав которых входят комплексный катион и анион, либо катион и комплексный анион Na 2 [Zn(OH) 4 ] →2Na + + [Zn(OH) 4 ] 2- Ионы противоположного знака, связанные с комплексным ионом, образуют внешнюю сферу. Комплексный ион состоит из комплексообразователя и лигандов и образует внутреннюю сферу (внутреннюю сферу заключают в квадратные скобки). Комплексообразователь – это d-элемент, имеющий на внешнем уровне достаточное количество свободных орбиталей (Cu +2 , Ag + , Pt +4 , Fe +2 , Fe +3 , Co +2 , Co +3 , Co +2 ) Лиганды – это ионы и молекулы, имеющие свободные электронные пары (OH — , CN — , Cl — , NH 3 , H 2 O) Координационное число (КЧ) — это число лигандов в комплексном ионе Координационное число зависит: от природы центрального атома; условий образования комплексов. Виды комплексов Соединения с комплексными анионами K 2 [PtCl 4 ] — тетрахлороплатинат (II) калия Na 2 [Zn(OH) 4 ] — тетрагидроксоцинкат натрия Na[Cr(H 2 O) 2 F 4 ] — тетрафтородиаквахромат (III) натрия Соединения с комплексными катионами [Ag(NH 3 ) 2 ]Cl – хлорид диамминсеребра [Al(H 2 O) 5 OH]SO 4 – сульфат гидроксопентаакваалюминия [Pt(H 2 O)(NH 3 ) 2 OH] NO 3 – нитрат гидроксодиамминакваплатины (II) Соединения без внешней сферы [Al (H 2 O) 3 (OH) 3 ] — тригидроксотриакваалюминий [Pt(NH 3 ) 2 Cl 2 ] – дихлородиамминплатина (II) [Co(NH 3 ) 3 Cl 3 ] – трихлоротриамминкобальт (III) Номенклатура в названиях комплексных ионов сначала указываются лиганды; название комплексного иона завершается названием металла с указанием его степени окисления (римским цифрами в скобках); в названиях комплексных катионов используются русские названия металлов; в названиях комплексных анионов используются латинские названия металлов: Al –алюминат, Cr – хромат, Fe – феррат; Источник Координационное числоКоординационное число (в химии и кристаллографии) — характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле. СодержаниеКоординационное число в химииВ химии понятие координационного числа появилось с развитием химии комплексных соединений. Под ним подразумевается число лигандов (атомов, молекул, ионов), которые образуют первую координационную (внутреннюю) сферу комплексообразователя [1] . Например, в комплексной соли гексацианоферрате(III) калия K3[Fe(CN)6] координационное число иона Fe 3+ равно 6, а в цис-дихлородиамминплатине (II) (соли Пейроне) Pt(NH3)2Cl2 центральный атом платины связан с четырьмя лигандами. Понятие координационного числа применяется и для характеристики центрального атома в молекулах, преимущественно для тех случаев, когда число химических связанных ближайших атомов не равно численному значению валентности. Например, в молекуле азотной кислоты формальная валентность центрального атома азота равна 4, степень окисления — +5, а координационое число — 3. Понятие координационного числа применяется также при описании структуры жидкостей и аморфных тел. В этом случае координационное число — мера ближнего порядка, среднее число ближайших соседей атома. Оно может быть дробным. Координационное число в кристаллографииВ кристаллохимии координационное число — характеристика, которая определяет число ближайших равноудаленных одинаковых частиц (ионов или атомов) в кристаллической решётке. Прямые линии, соединяющие центры ближайших атомов или ионов в кристалле, образуют координационный многогранник, в центре которого находится данный атом. В решётках Браве для всех узлов координационное число одинаково. Число ближайших соседей отражает плотность упаковки вещества. Чем больше координационное число, тем больше плотность и соответственно свойства вещества ближе к металлическим. Данному параметру решетки соответствует первая, вторая (соседи, следующие за ближайшими), третья и т. д. координационные группы частиц. Для простой кубической решетки координационное число равно шести, для ОЦК — 8, ГЦК и ГП (гексагональной плотноупакованной) — 12. См. такжеИсточникиПримечанияWikimedia Foundation . 2010 . ПолезноеСмотреть что такое «Координационное число» в других словарях:КООРДИНАЦИОННОЕ ЧИСЛО — число ближайших к данному атому соседних атомов в кристаллической решётке (атомной структуре кристалла) или молекул в молекулярных кристаллах. Если центры этих ближайших соседей соединить друг с другом прямыми линиями, то получится плоская фигура … Физическая энциклопедия КООРДИНАЦИОННОЕ ЧИСЛО — 1) в кристаллографии число ближайших к данному атому или иону соседних атомов или ионов в кристалле, находящихся от него на одинаковом расстоянии.2) В химии число лигандов, связанных с центральным ионом в комплексных соединениях … Большой Энциклопедический словарь КООРДИНАЦИОННОЕ ЧИСЛО — одно из основных понятий кристаллохимии, означающее число атомов или ионов, окружающих любой атом или ион на ближайшем расстоянии, или в первой сфере. В гольдшмидто паулинговской кристаллохимии считалось, что К.ч. определяется соотношением… … Геологическая энциклопедия КООРДИНАЦИОННОЕ ЧИСЛО — число ближайших к данному атому (иону) соседних атомов (ионов) в кристаллической решетке. В титаномагнетите, например, у катионов в тетраэдрических узлах подрешетки А координационное число – 4, в октаэдрических узлах подрешетки В – 6. Существуют… … Палеомагнитология, петромагнитология и геология. Словарь-справочник. координационное число — – число лигандов, непосредственно связанных с комплексообразователем, определяемое числом свободных орбиталей в центральном атоме. Общая химия : учебник / А. В. Жолнин [1] … Химические термины координационное число — (напр. атомов) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN cooordinate numberCNcoordination number … Справочник технического переводчика координационное число — 1) в кристаллографии число ближайших к данному атому или иону соседних атомов или ионов в кристалле, находящихся от него на одинаковом расстоянии. 2) В химии число лигандов, связанных с центральных ионом в комплексных соединениях. * * *… … Энциклопедический словарь координационное число — [coordination number] число ближайших соседних атомов, окружающих на равных расстояниях данный атом. Металлы с ГЦК и ГПУ решеткой имеют координационное число = 12. У металлов с ОЦК решеткой координационное число = 8; Смотри также: Число число… … Энциклопедический словарь по металлургии координационное число — (см. координация) 1) физ. число ближайших к данному атому или иону соседних атомов или ионов в кристалле (наибольшее координационное число равно 12); 2) хим. число атомов (групп атомов) или ионов, связанных хим. связью с центральным атомом в… … Словарь иностранных слов русского языка координационное число — koordinacijos skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Atomų ar atomų grupių, tiesiogiai prisijungusių prie atomo, skaičius kompleksiniame junginyje. atitikmenys: angl. coordination number vok. Koordinationszahl, f rus … Penkiakalbis aiškinamasis metrologijos terminų žodynas Источник Что значит координационное число комплексообразователяОсновы современной координационной теории были изложены в конце прошлого века швейцарским химиком Альфредом Вернером, обобщившим в единую систему весь накопившийся к тому времени экспериментальный материал по комплексным соединениям. Им были введены понятия о центральном атоме (комплексообразователь) и его координационном числе, внутренней и внешней сфере комплексного соединения, изомерии комплексных соединений, предприняты попытки объяснения природы химической связи в комплексах. Все основные положения координационной теории Вернера используются и в настоящее время. Исключение составляет его учение о природе химической связи, которое представляет сейчас лишь исторический интерес. Образование комплексного иона или нейтрального комплекса можно представить себе в виде обратимой реакции общего типа: M + n L где M – нейтральный атом, положительно или отрицательно заряженный условный ион, объединяющий (координирующий) вокруг себя другие атомы, ионы или молекулы L. Атом M получил название комплексообразователя или центрального атома . В комплексных ионах комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III). Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO) 4 ] и [Fe(CO) 5 ], содержат атомы никеля(0) и железа(0). Комплексообразователь (выделен синим цветом) может участвовать в реакциях получения комплексов, как будучи одноатомным ионом, например: Ag + + 2 NH 3 так и находясь в составе молекулы: Si F 4 + 2 F — I 2 + I — P H 3 + H + B F 3 + NH 3 В комплексной частице может быть два и более атомов-комплексообразователей. В этом случае говорят о многоядерных комплексах. Комплексное соединение может включать несколько комплексных ионов, в каждом из которых содержится свой комплексообразователь. В комплексном ионе или нейтральном комплексе вокруг комплексообразователя координируются ионы, атомы или простые молекулы (L). Все эти частицы, имеющие химические связи с комплексообразователем, называются лигандами (от латинского «ligare» — связывать). В комплексных ионах и лигандами являются ионы Cl — и CN — , а в нейтральном комплексе ] лиганды – молекулы NH 3 и ионы NCS — . Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. В отдельных случаях наблюдается межмолекулярное взаимодействие лигандов с образованием водородных связей. Лигандами могут быть различные неорганические и органические ионы и молекулы. Важнейшими лигандами являются ионы CN — , F — , Cl — , Br — , I — , NO 2 — , OH — , SO 3 S 2 — , C 2 O 4 2 — , CO 3 2 — , молекулы H2 O, NH 3 , CO, карбамида (NH2 ) 2 CO, органических соединений – этилендиамина NH2 CH 2 CH 2 NH 2 , a -аминоуксусной кислоты NH2 CH 2 COOH и этилендиаминтетрауксусной кислоты (ЭДТА) : Чаще всего лиганд бывает связан с комплексообразователем через один из своих атомов одной двухцентровой химической связью. Такого рода лиганды получили название монодентатных . К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие. Некоторые распространенные лиганды типа молекул воды H 2 O, гидроксид-иона OH — , тиоцианат-иона NCS — , амид-иона NH2 — , монооксида углерода CO в комплексах преимущественно монодентатны, хотя в отдельных случаях (в мостиковых структурах) становятся бидентатными . Существует целый ряд лигандов, которые в комплексах являются практически всегда бидентатными . Это этилендиамин, карбонат-ион, оксалат-ион и т.п. Каждая молекула или ион бидентатного лиганда образует с комплексообразователем две химические связи в соответствии с особенностями своего строения: Например, в комплексном соединении [Co(NH3 ) 4 CO 3 ]NO 3 бидентатный лиганд – ион CO3 2 — — образует две связи с комплексообразователем – условным ионом Co(III), а каждая молекула лиганда NH 3 – только одну связь: Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты: Полидентатные лиганды могут выступать в роли мостиковых лигандов, объединяющих два и более центральных атома. Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число ( КЧ ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя (подробнее см. >>>). Когда комплексообразователь координирует монодентатные лиганды, то координационное число равно числу присоединяемых лигандов. А число присоединяемых к комплексообразователю полидентатных лигандов всегда меньше значения координационного числа. Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температуры, природы растворителя, концентрации комплексообразователя и лигандов и др.), при которых протекает реакция комплексообразования. Значение КЧ может меняться в различных комплексных соединениях от 2 до 8 и даже выше. Наиболее распространенными координационными числами являются 4 и 6. Между значениями координационного числа и степенью окисления элемента-комплексообразователя существует определенная зависимость. Так, для элементов-комплексообразователей, имеющих степень окисления +I (Ag I , Cu I , Au I , I I и др.) наиболее характерно координационное число 2 – например, в комплексах типа Элементы-комплексообразователи со степенью окисления +II (Zn II , Pt II , Pd II , Cu II и др.) часто образуют комплексы, в которых проявляют координационное число 4, такие как В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6: Элементы-комплексообразователи, обладающие степенью окисления +III и +IV (Pt IV , Al III , Co III , Cr III , Fe III ), имеют в комплексах, как правило, КЧ 6. Известны комплексообразователи, которые обладают практически постоянным координационным числом в комплексах разных типов. Таковы кобальт(III), хром(III) или платина(IV) с КЧ 6 и бор(III), платина(II), палладий(II), золото(III) с КЧ 4. Тем не менее большинство комплексообразователей имеет переменное координационное число. Например, для алюминия(III) возможны КЧ 4 и КЧ 6 в комплексах и Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K9 [Bi(NCS) 12 ]. Лиганды, непосредственно связанные с комплексообразователем, образуют вместе с ним внутреннюю (координационную) сферу комплекса. Ионы, нейтрализующие заряд внутренней сферы, но не связанные с комплексообразователем ковалентно, образуют внешнюю сферу комплексного соединения. Внешнесферные ионы Cl — находятся на более значительном удалении от комплексообразователя, чем молекулы NH3 , иначе говоря, расстояние Zn – Cl больше, чем длина химической связи Zn – N. Более того, химическая связь комплексного катиона и хлорид-ионов Cl — имеет ионный характер, в то время как молекулы аммиака NH 3 , входящие во внутреннюю сферу, образуют с комплексообразователем Zn(II) ковалентные связи по донорно-акцепторному механизму (донором неподеленных пар электронов являются атомы азота в NH3 ). Таким образом, различие между лигандами внутренней сферы и ионами внешней сферы очень существенно. Изображая формулу комплексного соединения, внешнесферные ионы располагают за квадратными скобками. Обычно внешнюю сферу составляют простые одноатомные или многоатомные ионы. Однако возможны случаи, когда комплексное соединение состоит из двух и более внутренних сфер, выполняющих функции катионной и анионной части соединения. Здесь каждая из внутренних сфер является внешней по отношению к другой. При растворении в воде комплексные соединения необратимо диссоциируют на ионы: [Cu(NH 3 ) 4 ](OH) 2 = [Cu(NH 3 ) 4 ] 2+ + 2 OH — [Ni(NH 3 ) 6 ] 2 [Fe(CN) 6 ] = 2 [Ni(NH 3 ) 6 ] 2+ + [Fe(CN) 6 ] 4 — Кислоты с комплексными анионами в водном растворе подвергаются необратимому протолизу : H 2 [SiF 6 ] + 2 H 2 O = 2 H 3 O + + [SiF 6 ] 2 — Если в комплексном ионе или нейтральном комплексе содержатся два и более комплексообразователей, то этот комплекс называется многоядерным . Среди многоядерных комплексов выделяют мостиковые , кластерные и многоядерные комплексы смешанного типа . Атомы комплексообразователя могут быть связаны между собой с помощью мостиковых лигандов , функции которых выполняют ионы OH — , Cl — , NH 2 — , O 2 2 — , SO 4 2 — и некоторые другие. В роли мостикового лиганда может выступать полидентатный лиганд, имеющий несколько донорных атомов (например, NCS — с атомами N и S, способными участвовать в образовании связей по донорно-акцепторному механизму), либо лиганд с несколькими электронными парами при одном и том же атоме (например, Cl — или OH — ). В том случае, когда атомы комплексообразователя связаны между собой непосредственно, многоядерный комплекс относят к кластерному типу . в котором реализуется четверная связь Re – Re: одна σ-связь, две π- связи и одна δ-связь. Особенно большое число кластерных комплексов насчитывается среди производных d-элементов. Многоядерные комплексы смешанного типа содержат как связь комплексообразователь–комплексообразователь, так и мостиковые лиганды. Здесь имеется одинарная связь Co – Co и два бидентатных карбонильных лиганда CO, осуществляющих мостиковое соединение атомов-комплексообразователей. Источник |




 [ML n ]
[ML n ]

