- КОЛЛОИДНЫЕ ЧАСТИЦЫ (Colloid Nanoparticles)
- Эффект Тиндаля
- Коллоидные растворы вокруг нас
- Тиксотропные коллоиды
- ЭТО ИНТЕРЕСНО
- Радиоизлучение может играть в организме роль универсального «рубильника»
- Х и м и я
- Коллоидная химия
- Коллоидные частицы.
- Коллоидные растворы
- Виды коллоидных частиц
- Строение коллоидной мицеллы
КОЛЛОИДНЫЕ ЧАСТИЦЫ (Colloid Nanoparticles)
- В погоне за открытьем он был слишком воспален,
- И миг настал, когда нажал на крантик Кокильон.
- И закричал безумный: «Да это же коллоид!
- Не жидкость это, братцы, — коллоидальный газ!»
- Вот так, блеснув в науке, как в небе астероид,
- Простой безвестный гений безвременно угас.
- В. Высоцкий
Эффект Тиндаля
Взгляните на растворы, изображенные на рисунке. Внешне они кажутся практически одинаковыми — бесцветные и прозрачные. Впрочем, есть одно «но»: лазерный луч беспрепятственно проходит сквозь правый стакан, а в левом сильно рассеивается, оставляя красный след. В чем секрет?
В правом стакане — обычная вода, а вот в левом — коллоидный раствор серебра. В отличие от обычного или, как говорят химики, «истинного» раствора, коллоидный раствор содержит не молекулы или ионы растворенного вещества, а его мельчайшие частицы. Эти частицы настолько малы, что их невозможно увидеть невооруженным глазом и, более того, бывает сложно наблюдать даже с использованием новейших электронных микроскопов. Впрочем, даже мельчайшие частицы могут рассеивать свет. В физике это явление известно как «эффект Тиндаля». По этой же причине видны пылинки в солнечном луче, падающем через щель между занавесками в темную комнату. Правда, размеры и форму каждой частицы в растворе разглядеть не удастся, но все в целом они дают возможность проследить путь света.
То, что мы не сразу различили истинный раствор и коллоидный — неудивительно. Шотландский химик Томас Грэм (1805-1869), изучавший коллоидные растворы, долгое время называл их «псевдорастворами». Поскольку при выпаривании таких растворов, как правило, вместо кристаллов образуется аморфная масса, похожая на канцелярский клей, он и дал им название «коллоидных» (от греч. kolla — клей, kollodes — клейкий и eidos — вид). Кстати, каждый легко может купить концентрированную взвесь мельчайших частиц серебра в аптеке под названием «коллодий», она обладает отличными бактерицидными свойствами.
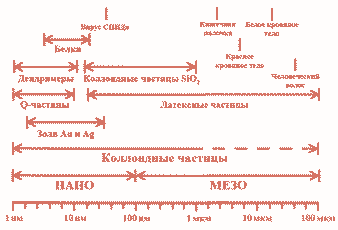
Каким же должен быть размер частиц, чтобы их раствор можно было назвать «коллоидным»? В различных учебниках коллоидными предлагается считать частицы, размер которых составляет от 1 нм до 100 нм, от 1 нм до 200 нм, от 1 нм до 1 мкм. (рис. 1).
- Рис. 1. Некоторые коллоидные системы и характеристические размеры распространенных биологических объектов. На данной диаграмме диапазон размеров коллоидных частиц существенно расширен за счет полимерных (латексных) частиц, обладающих низкой плотностью. Адаптировано на основе Microscopy & Histology Catalog, Polysciences, Warrington, PA 1993-1994
Впрочем, классификация по размерам, как и любая другая, весьма условна. Частицы должны быть настолько малы, чтобы вследствие малой массы вклад силы тяжести в их поведение был сопоставим с броуновским движением. Таким образом, под действием силы тяжести частицы либо совсем не оседают (такие коллоидные растворы называют «стабильными»), либо оседают очень медленно (расслаивание происходит в течение дней или даже месяцев, что в большинстве случаев также позволяет работать с такими растворами как со стабильными). Уже отсюда понятно, что привязка к размерам условна — в случае тяжелых веществ (например, металлов) коллоидный раствор будет стабильным лишь тогда, когда размер частиц не будет превышать несколько нанометров, а для веществ с малой плотностью (например, полимеров) даже при размере частиц более ста нанометров раствор будет оставаться стабильным. Дисперсные среды, содержащие частицы настолько крупные, что они распределяются в диспергирующей среде при перемешивании, но быстро оседают, называются взвесями. Не менее важно отметить, что вне зависимости от размера частиц коллоидный раствор не будет стабильным, если частицы не несут электрический заряд. Одноименно заряженные частицы отталкиваются, и раствор остается стабильным, тогда как если частицы не несут заряд, они быстро слипаются и оседают.
Коллоидные растворы вокруг нас
Коллоидные растворы окружают нас повсюду. В огромном количестве их можно увидеть на кухне — это растворы желатина, крахмала, яичного белка и даже кисель. 
Тиксотропные коллоиды
Еще один пример коллоидной системы — коварные зыбучие пески, состоящие из мельчайших частиц, «перемешанных» с воздухом. Это пример тиксотропного коллоида. Не менее важную роль коллоидные частицы играют в научных исследованиях. Как видно из рис.1 размер различных коллоидных частиц полностью перекрывает весь нано- и мезодиапазон, что позволяет решать с их помощью самые разнообразные методологические задачи — от калибровки электронных микроскопов 

- Рис. 4. Структура Green Rust 1, сформировавшаяся на поверхности стали при ее контакте с водным раствором AgNO3
ЭТО ИНТЕРЕСНО
Радиоизлучение может играть в организме роль универсального «рубильника»
Нанотехнологии развиваются в бешеном темпе, позволяяя достичь результатов, немыслимых буквально десятилетие назад. Однако с сожалением надо отметить, что большое количество нанотехнологических исследований посвящено рутинным, а не революционным разработкам. В сущности, делается то, что уже было сделано прежде, с небольшими улучшениями и вариациями — как правило, наночастицы используются в качестве биосенсоров для определения тех или иных веществ либо как приспособления для высвобождения лекарств (см. drug delivery).
Но ясно, что наночастицы способны на гораздо большее. Именно этого «большего» и смогла добиться команда американских ученых под руководством Джеффри Фридмана. Исследователям удалось создать методику получения необходимых реакций клетки с помощью радиоволн. Радиоволны нагревают металлические наночастицы, связанные с особыми рецепторами на клеточной мембране, а эти рецепторы активируются при нагревании и вызывают необходимые клеточные ответы. Получается, что радиоволны — это что-то вроде рубильника, который может вызвать почти любую желаемую реакцию клетки.
Основные предпосылки для работы были таковы. Предположим, нам нужно чего-то добиться от организма — возбуждения определенных нейронов или мышц, выделения железистыми клетками какого-то вещества, и так далее. Как это сделать?
Можно подобрать химические вещества, которые воздействуют на рецепторы в клетках-мишенях или другим способом вызывают нужные нам эффекты. Но тут перед нами встает множество проблем. Во-первых, подходящего вещества может просто не оказаться. Во-вторых, даже если оно есть, оно может иметь неприятные побочные действия, например влиять не только на те клетки, которые нам нужны, но и на другие тоже. В-третьих, если мы работаем с нервной системой, то велика вероятность, что выбранное нами вещество не сможет пройти через гемато-энцефалический барьер, и от него не будет никакого толку.
Источник
Х и м и я
Коллоидная химия
Коллоидные частицы.
Коллоидные растворы
Коллоидными растворами называют микрогетерогенные дисперсные системы с частицами размером от 1 до 100 мкм. Их характеризует не только наличие поверхности раздела между дисперсной фазой и дисперсионной средой (т.е. между частицами растворяемого вещества и растворителем), но и малая устойчивость. Коллоидные растворы не образуются самопроизвольно.
Виды коллоидных частиц
Частицы коллоидных размеров могут иметь различную внутреннюю структуру, что существенно сказывается как на методах получения коллоидных растворов, так и на их свойствах.
Существуют следующие три типа внутренней структуры первичных частиц коллоидных размеров.
1. Суспензоиды (или необратимые коллоиды),
2. Мицеллярные коллоиды (или ассоциативные коллоиды),
3. Молекулярные коллоиды (обратимые коллоиды).
Суспензоиды
Так называют коллоидные растворы металлов, их оксидов, гидроксидов, сульфидов и других солей.
Мельчайшие частицы перечисленных веществ, имеющих молекулярную или ионную кристалические решётки, составляют дисперсную фазу суспензоидов.
От суспензий они отличаются более высокой дисперсностью.
Суспензоидами их назвали потому, что, как и суспензии, они не могут длительно существовать в отсутствие стабилизатора дисперсности.
Необратимыми их назвали потому, что осадки, остающиеся при выпаривании таких коллоидных растворов, не образуют вновь золя при контакте с дисперсионной средой.
Суспензоиды называют лиофобными коллоидами. Название происходит от греческих слов: лиос – жидкость, фобио – ненавижу. Такое название они получили из-за предположения, что дисперсная фаза в них очень слабо взаимодействует с дисперсионной средой.
Суспензоиды, как и вообще дисперсные системы, могут быть получены двумя путями:
- Методом диспергирования, т.е. измельчения крупных тел, и
- Методами конденсации молекулярно- или ионнорастворённых веществ.
Измельчение путём дробления, помола, истирания даёт сравнительно крупнодисперсионные прошки (> 60 мкм). Более тонкого измельчения достигают с помощью специальных аппаратов, получивших название коллоидных мельниц, или применением ультразвука.
Метод конденсации состоит в получении нерастворимых соединений путём реакций обмена, гидролиза, восстановления, окисления.
Проводя эти реакции в сильно разбавленных растворах и в присутствии небольшого избытка одного из компонентов, получают не осадки, а коллоидные растворы.
К конденсационным методам относится также получение лизолей путём замены растворителя. Например, коллоидный раствор канифоли можно получить, выливая её спиртовой раствор в воду, в которой канифоль не растворима.
Мицелярные коллоиды
Их называют также полуколлоидами. Коллоидные частицы этого типа возникают при достаточной концентрации дифильных* молекул низкомолекулярных веществ путём их ассоциации в агрегаты молекул – мицеллы – сферической или пластинчатой формы.
Дифильными называют молекулы, которые состоят из углеводородного радикала, имеющего сходство с неполярными растворителями, и гидрофильной (полярной) группы, имеющей сродство к воде.
Мицеллы представляют собой скопления правильно расположенных молекул, удерживаемых преимущественно дисперсионными силами.
Образование мицелл характерно для водных растворов моющих веществ (например, мыл – щелочных солей высших жирных кислот).
Минимальную концентрацию поверхностно-активных веществ в растворе, при которой в системе образуются устойчивые мицеллы, находящиеся в равновесии с неассоциированными молекулами поверхностно-активного вещества, называют критической концентрацией мицеллоообразования.
Молекулярные коллоиды (обратимые коллоиды)
К молекулярным коллоидам относятся природные и синтетические высокомолекулярные вещества с молекулярным весом от десяти тысяч до нескольких миллионов. Молекулы этих веществ имеют размеры коллоидных частиц. Из-за огромного размера такие молекулы называют макромолекулами.
Разбавленные растворы высокомолекулярных соединений – это истинные, гомогенные растворы, которые при предельном разведении подчиняются общим законам разбавленных растворов.
Для получения растворов молекулярных коллоидов достаточно привести сухое вещество в контакт с подходящим растворителем.
Неполярные макромолекулы растворяются в углеводородах (например, каучуки в бензоле), а полярные макромолекулы в полярных растворителях (например, некоторые белки — в воде и водных растворах солей).
Вещества этого типа назвали обратимыми коллоидами потому, что после выпаривания их растворов и добавления новой порции растворителя сухой остаток вновь переходит в раствор.
Растворение макромолекулярных коллоидов проходит через стадию набухания, являющуюся характерной качественной особенностью веществ этого типа.
При набухании молекулы растворителя проникают в твёрдый полимер и раздвигают макромолекулы. Последние из-за своего большого размера медленно диффундируют в раствор, что внешне проявляется в увеличеннии объёма полимера.
Растворы высокомолекулярных соединений имеют значительную вязкость, которая быстро возрастает с увеличением концентрации растворов. Повышение концентрации макромолекулярных растворов, добавки веществ, понижающих растворимость полимера, и, часто, понижение температуры приводят к застудневанию, т.е. к превращению сильно вязкого, но всё же текучего раствора, в сохраняющий форму твёрдообразный студень.
Растворы полимеров с сильно вытянутыми макромолекулами застудневают при небольшой концентрации раствора. Так, желатин и агар-агар образуют студни и гели в 0,2-1% растворах. Высушенные студни способны вновь набухать (существенное отличие от гелей).
Строение коллоидной мицеллы
Строение коллоидных частиц удобнее рассматривать, если проследить процессы их образования. Сделаем это на примере частиц AgI.
Образование коллоидной частицы AgI происходит в результате реакции:
AgNO 3 + KI → AgI↓ + KNO 3 .
Молекулы AgI объединяются в практически нерастворимые частицы, в которых ионы Ag + и I — образуют кристаллическую решётку.
Новообразованные частицы сначала имеют аморфное строение, затем в них постепенно происходит кристаллизация.
Если AgNO3 и KI взяты в эквивалентных количествах, то частицы-кристаллы растут, достигая значительной величины, превосходящей размеры коллоидных частиц, и быстро выпадают в осадок.
Если же одно из исходных веществ взято в небольшом избытке, то оно служит стабилизатором, сообщающим устойчивость коллоидным частицам AgI. Так, при избытке AgNO3 в растворе будет находится большое количество ионов Ag + и NO3 — . Однако построение кристаллической решетки AgI согласно правилу Панета – Фаянса может идти только за счёт ионов, входящих в её состав; в данном случае за счёт ионов Ag + .
Ионы Ag + будут продолжать достраивать кристаллическую решётку ядра, прочно входя в её структуру и сообщая ему электрический потенциал.
В связи с этим ионы, достроившие кристаллическую решётку ядра, называются потенциалопределяющими ионами.
Величина электродинамического потенциала, или Е-потенциала, у многих коллоидных частиц достигает 1 В. Частицы с таким относительно высоким зарядом будут притягивать оставшиеся в растворе противоположно заряженные ионы NO3 (называемые поэтому противоионами). Начнётся процесс адсорбции противоионов, в результате которого установится динамическое равновесие между адсорбированными и свободными ионами.
Основная часть всех противоионов, адсорбированная на ядре коллоидной частицы, образует вместе с потенциалопределяющими ионами адсорбционный слой (позиция 3 на рисунке выше).
Ядро и адсорбционный слой вместе составляют гранулу. Гранула имеет электрический потенциал того же знака, что и Е-потенциал, но величина его меньше и зависит от количества противоионов в адсорбционном слое.
Так, если 90% их адсорбировано, то и потенциал гранулы составит 10% от Е-потенциала.
Потенциал гранулы называется электрокинетическим или дзета-потенциалом (ζ-потенциал). Кинетическим его называют потому, что он может быть обнаружен и измерен при движении частиц в электрическом поле. Его можно определить также, как потенциал на границе между адсорбционным (неподвижным относительно частицы) и диффузным (подвижным) слоями. (о диффузном слое см. ниже)
Остаток противоионов удерживается электростатическими силами притяжения вблизизи гранулы, образуя диффузный слой (позиция 5 на рисунке ниже).
Гранула вместе с диффузным слоем образует мицеллу.
Толщина диффузного слоя различна, так как зависит от ионной силы раствора: чем ионная сила выше, тем толщина слоя меньше.
Концентрация противоионов в диффузном слое убывает по направлению к переферии. Соответственно этому убывает и потенциал частицы, падая на границе дифузного слоя до нуля. Таким образом, мицелла всегда электронейтральна.
Если переместить в адсорбционный слой большое количество противоионов, например 95%, электрокинетический (ζ-потенциал), измеряемый на поверхности гранулы, уменьшится до 5% от величины Е-потенциала. Величина Е-потенциала, зависящая от потенциал-определяющих ионов меняться не будет.
Устойчивость коллоидных растворов обусловлена присутствием стабилизатора, т.е. электролита и зависит от величины заряда гранулы (ζ-потенциала). Чем выше этот потенциал, тем сильнее оказываются силы взаимного отталкивания частиц, препятствующие их объединению при столкновениях, наблюдающихся в результате броуновского движения.
Источник