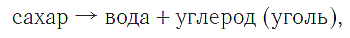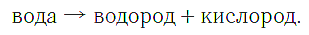- Качественный и количественный состав веществ.
- Урок 4. Сложные вещества
- Органические и неорганические вещества
- Органические вещества
- Неорганические вещества
- Качественный и количественный состав веществ
- Отличия между сложными веществами и смесями веществ
- Как выяснить качественный и количественный состав вещества
- Что показывает качественный состав вещества
- Что показывает состав количественный
- Способы определения состава вещества
- Примеры определения состава
- Заключение
Качественный и количественный состав веществ.
Простые вещества – это вещества, образованные одним химическим элементом. Вещества, образованные из двух и более химических элементов, называют сложными. Сложных веществ гораздо больше, чем простых.
Различают в качественный и количественный состав веществ. Качественный состав – это совокупность химических элементов и (или) атомных группировок, составляющих данное химическое вещество. Количественный состав –это показатели, характеризующие количество или число атомов того или иного химического элемента и (или) атомных группировок, образующих данное химическое вещество.
Химические знаки и формулы.
Состав веществ отображают посредством химической символики. По предложению Й. Я. Берцелиуса элементы принято обозначать первой или первой и одной из последующих букв латинских названий элементов.
Химический знак (символ) – несет значительную информацию. Он обозначает название элемента, один его атом, один моль атомов этого элемента. По символу химического элемента можно определить его атомный номер и относительную атомную массу.
Химическая формула – это способ отображения химического состава вещества. Она обозначает название вещества, одну молекулу его, один моль этого вещества. По химической формуле можно определить качественный состав вещества, число атомов и количество вещества каждого элемента в одном моле вещества, его относительную молекулярную и молярную массу. Посмотреть видеоролик.
Формулы вещества составляют на основании еще одного важнейшего понятия в химии – валентности. Валентность – это способность атомов одного химического элемента соединятся со строго определенным числом атомов другого химического элемента.
Широко используются несколько видов химических формул:
Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых находятся частицы, образующие данное вещество.
Молекулярная (истинная) формула показывает качественный состав и число составляющих вещество частиц, но не показывает порядок связей частиц в веществе, т. е. его структуру. Графическая формула отражает порядок соединения атомов, т. е. связи между ними. Посмотреть видеоролик получения формулы по названию
Относительные атомная и молекулярная массы.
Относительная атомная масса ( ) химического элемента – это величина, показывающая отношение средней массы атома природной изотопной смеси элемента к 1/12 массы атома углерода : Единая углеродная атомная единица массы (а. е. м.) равна:
Относительная атомная масса – одна из основных характеристик химического элемента. Относительная молекулярная масса — равна сумме относительных атомных масс всех атомов, образующих молекулу вещества.
Количество вещества.
Количество вещества (n или v) характеризуют числом атомов, молекул или других формульных единиц данного вещества. В Международной системе СИ за единицу количества вещества принят моль. Моль– это количество вещества, содержащее столько же формульных единиц, сколько атомов содержат 0,012 кг изотопа углерода . Массу одного моля называют молярной массой и обозначают буквой М.
Молярная масса может быть выражена через число молекул (или атомов) в одном моле вещества ( ) и массу ( ) отдельной молекулы (или атома): Массу молекулы (атома) в килограммах можно рассчитать по уравнению следовательно из этого выражения можно определить число молекул или атомов, содержащихся в одном месте любого вещества, которое называют постоянной Авогадро. Постоянная Авогадро ( ) – число атомов или молекул (или других формульных единиц), содержащихся в одном моле вещества;
Вопросы для самоконтроля
1. Что является предметом изучения химии?
2. Какие законы и теории составляют основу химии?
3. Назовите Основные положения АМУ
4. Приведите примеры известных вам аллотропных модификаций.
5. По какой формуле можно вычислить количество вещества?
6. Как вычисляется молекулярная масса ?
7. В каких единицах измеряется относительная молекулярная масса и молекулярная масса?
ПЛАН ЗАНЯТИЯ № 3
Дисциплина: Химия.
Тема: Основные законы химии.
Цель занятия: Повторить основные законы химии: стехиометрия, закон сохранения массы веществ, закон постоянства состава веществ молекулярной структуры, закон Авогадро и следствия их него.
Предметные: знать основные законы химии: стехиометрия, закон сохранения массы веществ, владеть основополагающими химическими понятиями, теориями, законами и закономерностями;
Метапредметные: работать с теоретическим материалом, анализировать, делать выводы.
Личностные: уверенное пользование химической терминологией и символикой.
Норма времени:2 часа
Вид занятия:Лекция.
Тип занятия: Урок повторения.
План занятия:
1. Стехиометрия. Закон сохранения массы веществ.
2. Закон постоянства состава веществ молекулярной структуры. Закон Авогадро и следствия их него.
Оснащение:Учебник.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 — изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель:Тубальцева Ю.Н.
Тема 3.Основные законы химии.
1. Стехиометрия. Закон сохранения массы веществ.
2. Закон постоянства состава веществ молекулярной структуры. Закон Авогадро и следствия их него.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Источник
Урок 4. Сложные вещества
В уроке 4 «Сложные вещества» из курса «Химия для чайников» дадим определение химическим соединениям, рассмотрим различия органических и неорганических соединений, а также выясним, что означает качественный и количественный состав. Напоминаю, что в прошлом уроке «Молекулы и простые вещества» мы рассмотрели, что такое молекулы, простые вещества, а также металлы и неметаллы.
Химические элементы существуют не только в виде свободных атомов и простых веществ. Они также могут входить в состав самых различных химических соединений.
Вещества, состоящие из атомов разных химических элементов, называются сложными веществами или химическими соединениями.
Органические и неорганические вещества
Подавляющее большинство химических веществ — это сложные вещества. Вы уже знаете некоторые из них. Вода, метан, сахар, поваренная соль — сложные вещества. Сложные вещества делятся на две группы — неорганические и органические.
Органические вещества
Все органические вещества объединяет главный признак: в их состав обязательно входят атомы углерода. Кроме углерода, в состав органических веществ чаще всего входят атомы водорода, кислорода, а также азота, фосфора, серы. Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение (рис. 41).
Простейшим органическим веществом является природный газ метан. Но вам, наверное, знакомы и такие органические вещества, как сахар (сахароза), уксусная и лимонная кислоты, спирт, крахмал, белки, жиры, пластмассы и т. д. Органических веществ миллионы. Они содержатся во всех животных и растительных организмах (откуда и произошло их название), входят в состав пищи, топлива, лекарств, красителей, самых разнообразных материалов.
Неорганические вещества
Неорганические вещества являются соединениями всех остальных элементов. К неорганическим традиционно относят также несколько веществ, содержащих углерод: углекислый и угарный газы, мел, соду и некоторые другие. Неорганических веществ около 700 тыс., но их общая масса многократно превышает массу органических веществ. Почти все они — твердые вещества немолекулярного строения (рис. 42), входят в состав минералов, почв, горных пород.
Качественный и количественный состав веществ
Каждое вещество характеризуется определенным качественным и количественным составом.
Качественный состав вещества показывает, из атомов каких элементов оно состоит. Например, вода состоит из атомов водорода и кислорода, а метан— из атомов углерода и водорода. Число атомов каждого элемента в составе мельчайшей частицы вещества характеризует его количественный состав. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула метана — из одного атома углерода и четырех атомов водорода.
Сложное вещество можно с помощью различных химических методов разложить на несколько новых веществ, и так до тех пор, пока не получатся вещества, каждое из которых будет являться простым. Например, сахар при нагревании разлагается на воду и уголь (углерод):
а воду можно разложить с помощью электрического тока на водород и кислород:
Свойства простых веществ, которые при этом получаются (углерода, кислорода и водорода), совершенно не похожи на свойства сложных веществ — сахара и воды. Это разные вещества с разными свойствами. Свойства сложного вещества не являются суммой свойств простых веществ, которые образуются при его разложении.
Сложные вещества, как и простые, имеют либо молекулярное, либо немолекулярное строение. При этом вещества молекулярного строения могут существовать при обычных условиях в различных агрегатных состояниях. Например, метан — газ, вода — жидкость, сахар — твердое вещество.
Вещества немолекулярного строения при обычных условиях — твердые кристаллы, например поваренная соль, мел. Конечно, при нагревании (иногда до нескольких тысяч градусов) такие вещества плавятся, а затем переходят и в парообразное состояние.
Отличия между сложными веществами и смесями веществ
Необходимо различать сложные вещества и смеси веществ:
| Сложное вещество (химическое соединение) | Смесь веществ |
| Образуется в результате соединения атомов различных элементов между собой (химический процесс) | Образуется в результате смешивания различных веществ (физический процесс) |
| Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено | Свойства веществ, из которых составлена смесь, не изменяются |
| Имеет определенный качественный и количественный состав | Состав произвольный |
| Разлагается на составные части только в результате химических процессов | Разделяется на составные части с помощью различных физических методов |
Краткие выводы урока:
- Сложными называются вещества, состоящие из атомов разных химических элементов.
- Каждое чистое вещество имеет определенный качественный и количественный состав.
- Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено.
- Сложные вещества имеют молекулярное или немолекулярное строение.
- Все сложные вещества делятся на органические и неорганические.
Надеюсь урок 4 «Сложные вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Как выяснить качественный и количественный состав вещества
Рассмотрим качественный и количественный состав веществ. Определим его особенности для соединений органического и неорганического происхождения.
Что показывает качественный состав вещества
Он демонстрирует виды атомов, которые есть в анализируемой молекуле. К примеру, вода образована водородом и кислородом.
Молекула оксида натрия включает в себя атомы натрия и кислорода. В серной кислоте содержатся водород, кислород, сера.
Что показывает состав количественный
Он демонстрирует количественное содержание каждого элемента внутри сложного вещества.
К примеру, в воде находится два атома водорода и один кислорода. Серная кислота состоит из двух водородов, одного атома серы, четырех кислородов.
В составе ортофосфорной кислоты три атома водорода, один фосфор, четыре атома кислорода.
Качественный и количественный состав веществ есть и у органических веществ. Например, метан содержит один углерод и четыре водорода.
Способы определения состава вещества
Качественный и количественный состав веществ можно определить химическим путем. К примеру, при разложении молекулы сложного соединения образуется несколько молекул с более простым составом. Так, при нагревании карбоната кальция, состоящего из кальция, углерода, четырех атомов кислорода, можно получить два оксида: кальция и углерода.
Сложное вещество и образующиеся в ход химического разложения соединения могут иметь различный качественный и количественный состав веществ.
Простые и сложные соединения могут быть молекулярного, а также немолекулярного состава.
Первая группа находится в разных агрегатных состояниях. Например, сахар является твердым веществом, вода – жидкая, кислород – газ.
Соединения немолекулярного строения при стандартных условиях находятся в твердом виде. К ним относятся соли. В процессе нагревания они плавятся, переходят из твердого вида в жидкое состояние.
Примеры определения состава
«Опишите качественный и количественный состав следующих веществ: оксида серы (4), оксида серы (6)». Такое задание является типовым в школьном курсе неорганической химии. Для того чтобы справиться с ним, сначала нужно составить формулы предложенных соединений, пользуясь валентностями либо степенями окисления.
В обоих предложенных оксидах присутствуют одни и те же химические элементы, следовательно, их качественный состав одинаковый. Они включают в себя атомы серы и кислорода. А вот в количественном соотношении результаты будут отличаться.
В первом соединении содержится два атома кислорода, а во втором их шесть.
Выполним следующее задание: «Опишите качественный и количественный состав веществ H2S».
Молекула сероводорода состоит из атома серы и двух водородов. Качественный и количественный состав вещества H2S позволяет предугадывать его химические свойства. Так как в составе присутствует катион водорода, сероводород способен проявлять окислительные свойства. Например, подобные характеристики проявляются во взаимодействии с активным металлом.
Информация о качественном и количественном составе вещества актуальна и для органических соединений. Например, зная количественное содержание компонентов в молекуле углеводорода, можно определить его принадлежность к определенному классу веществ.
Такая информация позволяет предугадывать химические и физические характеристики анализируемого углеводорода, выявлять его специфические свойства.
Например, зная, что в составе есть четыре атома углерода и десять водородов, можно сделать вывод о принадлежности данного вещества к классу предельных (насыщенных) углеводородов, имеющих общую формулу СпН2п+2. Для всех представителей данного гомологического ряда характерны реакции замещения по радикальному механизму, а также окисление кислородом воздуха.
Заключение
Любое неорганическое и органическое вещество имеет определенный количественный и качественный состав. Информация необходима для установления физических и химических свойств анализируемого неорганического соединения, а для органических веществ состав позволяет устанавливать принадлежность к классу, выявлять характерные и специфические химические свойства.
Источник