Кардиопротективные свойства антигипертензивных лекарственных средств
Всовременных рекомендациях по диагностике и лечению артериальной гипертензии (АГ) основная цель лечения определена как достижение максимального снижения долгосрочного риска сердечно-сосудистых осложнений (ССО).
Всовременных рекомендациях по диагностике и лечению артериальной гипертензии (АГ) основная цель лечения определена как достижение максимального снижения долгосрочного риска сердечно-сосудистых осложнений (ССО). Достичь этой цели возможно как за счет снижения повышенного артериального давления (АД), так и путем коррекции сопутствующих факторов риска. У всех пациентов с АГ следует снижать АД по меньшей мере до уровня 140/90 мм рт. ст. и ниже при хорошей переносимости.
В настоящее время основной концепцией антигипертензивной терапии является органопротекция, которая предполагает, с одной стороны, защиту органов-мишеней от повреждений, с другой — восстановление уже имеющихся в них структурных и функциональных изменений.
Если говорить о сердце как органе-мишени, то последствиями негативного воздействия на него повышенного АД являются гипертрофия миокарда левого желудочка (ЛЖ), развитие фиброза, различные варианты ремоделирования, апоптоз, что в конечном итоге повышает риск развития ССО.
На ранних стадиях артериальной гипертонии развитие гипертрофии миокарда является результатом структурной адаптации ЛЖ к повышенной нагрузке давлением. По результатам Фремингемского исследования эхокардиографические признаки гипертрофии миокарда ЛЖ были отмечены у 5–49% женщин и у 8–33% мужчин в возрасте от 30 до 70 лет. Степень гипертрофии ЛЖ определяют наследственные и конституциональные факторы (пол, возраст), факторы питания (избыточный вес, чувствительность к соли), а также состояние симпатической нервной и ренин-ангиотензин-альдостероновой (РААС) систем. Результаты многочисленных клинических исследований показали, что гипертрофия миокарда является независимым фактором риска развития ССО, таких как стенокардия напряжения, аритмия, инфаркт миокарда и сердечная недостаточность.
Гипертрофия миокарда ЛЖ (ГМЛЖ) приводит к нарушению функциональных свойств миокарда, причем в первую очередь нарушается его диастолическое наполнение, а затем и систолическая функция. При ГМЛЖ нарушается коронарное кровообращение, что проявляется снижением коронарного резерва и недостаточной перфузией субэндокардиальных слоев миокарда. При наличии ГМЛЖ частота желудочковых аритмий также повышается.
Риск развития коронарной недостаточности, желудочковых нарушений ритма сердца при увеличении массы миокарда левого желудочка на 50% возрастает по меньшей мере вдвое.
Было отмечено, что в группе с выраженной гипертрофией ЛЖ риск сердечной недостаточности возрастает в 5 раз. У 30–40% больных с признаками сердечной недостаточности отмечается нормальное состояние систолической функции, т. к. на ранних стадиях гипертрофического ремоделирования возникают прежде всего нарушения диастолического наполнения ЛЖ и признаки диастолической дисфункции. Таким образом, у больных АГ диастолическая дисфункция является самостоятельным фактором развития сердечной недостаточности. Говоря о кардиопротективных свойствах лекарственных средств (ЛС), мы в первую очередь оцениваем их влияние на ГМЛЖ.
Ретроспективный анализ клинических исследований показал, что антигипертензивная терапия, уменьшающая ГМЛЖ, позволяет добиться снижения риска ССО.
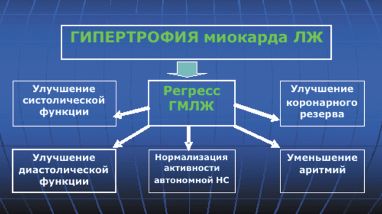
К чему приведет снижение массы миокарда ЛЖ в результате приема антигипертензивных ЛС? В настоящее время доказано, что регресс ГМЛЖ сопровождается улучшением систолической функции, уменьшением миокардиального фиброза и улучшением диастолической функции ЛЖ, увеличением коронарного резерва, нормализацией локальной нервной системы и уменьшением аритмий, что в конечном счете может снизить риск ССО и улучшить прогноз (рис. 1).
Поэтому, говоря о «кардиопротективности» применительно к антигипертензивным ЛС, мы предполагаем не только способность ЛС снижать ГМЛЖ, но и их способность влиять на жесткие конечные точки, такие как сердечно-сосудистая смертность и другие показатели сердечно-сосудистого риска.
Поскольку пусковым фактором развития ГМЛЖ является повышенное АД, следует предположить, что любой антигипертензивный препарат способен вызывать регресс ГМЛЖ.
В настоящее время вопрос о влиянии различных антигипертензивных ЛС на процессы гипертрофического ремоделирования миокарда ЛЖ остается в центре внимания. В 90-х годах был опубликован ряд обзоров клинических исследований, сравнивающих эффективность различных групп антигипертензивных препаратов на степень регресса ГМЛЖ. Авторы четырех наиболее крупных метаанализов, в которых проводилось сравнение разных групп препаратов по способности вызывать регресс гипертрофии ЛЖ, пришли к согласованному заключению — наиболее эффективно уменьшают ГМЛЖ препараты, снижающие активность РААС, — на 11,8–15% от исходного уровня.
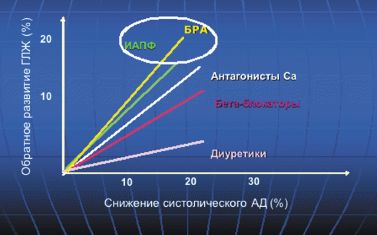
В работе Klingbeil и соавт. (метаанализ 80 двойных слепых клинических исследований) также показано, что наибольшая степень снижения индекса массы миокарда ЛЖ на 13% была отмечена у больных, получавших терапию блокаторами рецепторов ангиотензина (БРА), на 11% — антагонистами кальция пролонгированного действия (АК), на 10% — ингибиторами ангиотензин-превращающего фермента (АПФ), на 8% — диуретиками, на 6% — бета-адреноблокаторами (БАБ) (рис. 2).
Таким образом, лидирующие позиции в этом списке также занимают блокаторы ренин-ангиотензиновой системы — ингибиторы АПФ и БРА, что свидетельствует о высокой роли активации ангиотензиновых рецепторов 1 типа в процессах развития гипертрофии миокарда ЛЖ.
Ингибиторы АПФ и блокаторы рецепторов ангиотензина
Кардиопротективные свойства ингибиторов АПФ и БРА заключаются не только в их способности вызывать регресс гипертрофии миокарда ЛЖ за счет блокады компонентов циркулирующей и тканевой РААС. Потенциальные кардиопротективные эффекты, такие как антиишемическое и антиаритмическое действие, связаны с возможностью этих препаратов восстанавливать нарушенную функцию эндотелия, стимулировать высвобождение оксида азота и простациклина за счет снижения деградации брадикинина, уменьшать потребность миокарда в кислороде за счет регрессии гипертрофии миокарда, снижать активность симпато-адреналовой системы, обусловленной стимуляцией ангиотензина II.
Нами были изучены долгосрочные эффекты различных ингибиторов АПФ и БРА на процессы ремоделирования у больных АГ. Было выявлено достоверное снижение показателей ГМЛЖ на фоне длительной (до трех лет) терапии ингибиторами АПФ эналаприлом, рамиприлом и каптоприлом и БРА ирбесартаном и телмисартаном (рис. 3). Динамика снижения показателей суточного мониторирования АД за период наблюдения была однонаправленной и достоверно значимой при лечении всеми препаратами. При анализе динамики снижения индекса массы миокарда ЛЖ было отмечено более выраженное достоверно значимое снижение данного показателя в группе больных, получавших терапию БРА, что согласуется с данными ряда других исследований.
Особого внимания заслуживают антиишемические свойства ингибиторов АПФ, которые были подтверждены рядом клинических исследований. Так, в исследовании HOPE (Heart Outcomes prevention evaluation study) с рамиприлом (ингибитор АПФ с высокой аффинностью к тканевой АПФ) было включено 9297 больных старше 55 лет с высоким риском ССО. Через 4,5 года наблюдения было отмечено достоверное снижение риска развития острого инфаркта миокарда, инсульта и коронарных событий, требующих проведения реваскуляризации, — то есть тех осложнений, которые являются привычными «спутниками» прогрессирующего атеросклеротического процесса. Результаты этого исследования еще раз подтвердили обоснованность и правомочность концепции, согласно которой предупреждение сердечно-сосудистой заболеваемости и смертности возможно путем блокады РААС на тканевом уровне.
Клиническое изучение антиишемических свойств ингибиторов АПФ у больных АГ в сочетании с ишемической болезнью сердца (ИБС), стабильной стенокардией напряжения было проведено на нашей кафедре. Под влиянием лечения периндоприлом и эналаприлом у больных АГ в сочетании с ИБС, стабильной стенокардией напряжения хорошая антигипертензивная эффективность сочеталась с антиангинальным эффектом и положительной динамикой показателей теста с физической нагрузкой. У больных, получавших терапию периндоприлом, отмечено также снижение суммарной продолжительности эпизодов ишемии миокарда (по результатам Холтеровского мониторования ЭКГ), уменьшение проявлений дисфункции эндотелия, улучшение диастолической функции миокарда у больных с нарушениями релаксации, а также улучшение локальной сократимости миокарда в виде уменьшения количества гипокинетичных сегментов как в покое, так и на высоте физической нагрузки (в условиях проведения стресс-ЭХО-КГ).
В последние годы стали широко доступны результаты крупных многоцентровых клинических исследований, посвященных изучению различных аспектов кардиопротекции относительно нового класса антигипертензивных ЛС — блокаторов рецепторов ангиотензина II. Так, в клиническом исследовании LIFE (Losartan Intervention For Endpoint reduction in hypertension) кардиопротективные свойства лозартана оценивались у 9193 больных АГ с ГМЛЖ по амплитудным критериям ЭКГ. Больные были разделены на группы лечения лозартаном или атенололом. В случае недостаточного контроля АД к терапии добавляли гидрохлортиазид. Длительность лечения составила в среднем 4,8 года. Между группами не было различий по исходным показателям АД и степени снижения АД на фоне активного лечения. В группе больных, получавших лозартан, было отмечено более выраженное снижение количественных признаков гипертрофии миокарда, чем в группе атенолола. Риск развития ССО был на 13% меньше в группе лозартана (23,8 событий на 1000 больных в год), чем в группе атенолола (27,9 событий на 1000 больных в год). Смертность ССО в группе лозартана была недостоверно ниже.
В рандомизированном двойном слепом исследовании CATCH (Candesartan Assessment in the Treatment of Cardiac Hypertrophy) было проведено сравнение эффективности кандесартана (8–16 мг/сут) и эналаприла (10–20 мг/сут) у больных АГ с ГМЛЖ (по данным ЭХО-КГ — индекс массы миокарда ЛЖ (ИММЛЖ) > 100 г/м 2 у женщин и > 120 г/м2 у мужчин). Длительность наблюдения составила 1 год. В обеих группах отмечалось достоверное снижение ИММЛЖ (10,9 ± 15,5% и 8,4 ± 17,4%, p 2 у больных, получавших комбинированную терапию. У больных, получавших монотерапию эналаприлом, снижение данного показателя составило 3,9 ± 23,9 г/м 2 (p
Источник
Кардиопротекция с использованием экзогенного фосфокреатина при общехирургических операциях и критических состояниях. Обзор литературы
А.Г. Яворовский, А.М. Попов, П.В. Ногтев
ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России (Сеченовский университет), Москва, Россия
Для корреспонденции: Попов Александр Максимович — ассистент кафедры анестезиологии и реаниматологии ФГАOУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России (Сеченовский университет), Москва, Россия; e-mail: reanimatolog.popov@gmail.com
Для цитирования: А.Г. Яворовский, А.М. Попов, П.В. Ногтев. Кардиопротекция с использованием экзогенного фосфокреатина при общехирургических операциях и критических состояниях. Обзор литературы. Вестник интенсивной терапии им. А.И. Салтанова. 2020;3:57–66. DOI: 10.21320/1818-474X-2020-3-56-65
Реферат
С каждым годом возрастает количество операций, выполняемых лицам пожилого и старческого возраста с сопутствующей сердечно-сосудистой патологией. Именно у этой категории больных наиболее высока вероятность развития периоперационных кардиальных осложнений, что требует для уменьшения риска их возникновения применения кардиопротективных мероприятий. Одним из вариантов кардиопротекции может быть применение препаратов, направленных на улучшение метаболизма и поддержание адекватного энергообеспечения миокарда. К подобным метаболическим агентам относится экзогенный фосфокреатин.
В данной статье представлен обзор исследований применения экзогенного фосфокреатина как кардиопротектора у пациентов в некардиальной хирургии. Поиск публикаций проводился в базах PubMed/Medline, Embase, e-library, China National Knowledge Infrastructure, WANGFANG DATA. Показано, что применение фосфокреатина в абдоминальной хирургии, онкохирургии, при операциях в травматологии, торокальной хирургии, трансплантологии, а также в отделениях интенсивной терапии при сепсисе и септическом шоке ассоциировано с уменьшением риска кардиальных осложнений и снижением летальности. Учитывая вышеизложенные данные о положительном кардиопротективном эффекте экзогенного фосфокреатина при различных хирургических операциях, данную протективную методику можно рекомендовать для более широкого применения в клинической практике, особенно у больных с высоким кардиальным риском.
Ключевые слова: кардиопротекция, фосфокреатин, миокард, периоперационный период, интенсивная терапия
Поступила: 16.07.2020
Принята к печати: 02.09.2020
Читать статью в PDF
Введение
Ежегодно в мире около 250 млн человек подвергаются некардиальным хирургическим операциям. В Европе при выполнении 5,7 млн некардиальных операций у больных с сопутствующими сердечно-сосудистыми заболеваниями развивается более 167 000 кардиальных осложнений, причем в 19 000 наблюдений — с летальными исходами [1].
Второй важный момент — это то, что с каждым годом возрастает количество операций, выполняемых лицам пожилого и старческого возраста, пациентам с сопутствующей сердечно-сосудистой патологией. Доля таких больных в развитых странах постоянно увеличивается. Соответственно, увеличивается и необходимость в хирургическом лечении у таких пациентов, которая возрастает в четыре раза по сравнению с общей популяцией [1, 2].
Именно у этой категории пациентов риск осложнений со стороны сердечно-сосудистой системы многократно увеличивается. Так, частота кардиальных осложнений у больных старше 50 лет после плановых некардиальных операций составляет 1,4 % [3] и может доходить до 26,6 % у больных старше 85 лет после экстренных абдоминальных вмешательств [4]. Эти осложнения приводят не только к удлинению пребывания больного в стационаре и росту стоимости лечения, но и увеличивают летальность. По данным ряда исследований, у взрослых больных более 40 % летальности при некардиальных оперативных вмешательствах обусловлено кардиальными осложнениями, среди которых наиболее частыми являются различные варианты повреждения миокарда и сердечная недостаточность (СН) [5–7].
В связи с этим эффективная профилактика и своевременное лечение таких осложнений в периоперационном периоде является одним из самых важных факторов по снижению госпитальной летальности пациентов при проведении хирургических операций [1, 8–10].
Одним из главных развиваемых направлений в этом отношении является разработка так называемых риск-снижающих технологий [11, 12]. Последние подразумевают под собой комплекс, который сочетает в себе совокупность методик оценки риска пациента, фармакологической подготовки пациента к оперативному вмешательству, методов анестезиологического обеспечения, включая современный мониторинг, а также адъювантную кардиопротекцию, под которой понимают периоперационное использование различных лекарственных агентов, обладающих защитными свойствами в отношении сердечно-сосудистой системы. К ним относятся такие фармакологические группы, как бета-блокаторы, сартаны, α2-агонисты, нитраты, кальциевые сенситайзеры, блокаторы кальциевых каналов, антиагреганты, статины, галогеносодержащие анестетики. Но на настоящий момент некоторые препараты не подтвердили ожидаемой кардиопротективной эффективности (нитраты, блокаторы кальциевых каналов). Более того, использование нифедипина у больных при сосудистых операциях повышает периоперационную летальность [13].
При периоперационном применении бета-блокаторов повышается риск гемодинамически значимой брадикардии. Возможны и другие побочные эффекты: гипотензия, бронхоспазм, декомпенсация СН. Кроме того, пероральные бета-блокаторы требуют довольно длительной предоперационной подготовки [14]. Это относится и к пероральным статинам, которые нужно назначать минимум за 5–7 дней до операции, чтобы они проявили свою протективную активность.
Большинство препаратов с антикоагулянтной активностью повышают риск периоперационных кровотечений, что ограничивает их активное профилактическое назначение. Предоперационное использование сартанов значимо повышает риск выраженной артериальной гипотензии после индукции общей анестезии, особенно у больных, получающих β-адреноблокаторы; следует подчеркнуть трудность в коррекции такой гипотензии [11].
При применении левосимендана возможны побочные эффекты (артериальная гипотензия и тахикардия), препарат противопоказан больным с аортальным стенозом — самым распространенным клапанным пороком у больных пожилого и старческого возраста, а это заболевание является доказанным фактором риска периоперационного инфаркта миокарда и летальности, особенно при выполнении экстренных оперативных вмешательств [1]. В последнее десятилетие большое внимание уделяется прекондиционирующему эффекту галогеносодержащих анестетиков [11, 15]. Но несомненная эффективность анестетического прекондиционирования кардиомиоцитов, показанная в эксперименте, не нашла пока однозначного подтверждения в клинической практике. Возможно, потому что для реализации кардиопротективного эффекта требуются высокие концентрации галогеносодержащего анестетика, что клинически не всегда достижимо [16].
Среди всех перечисленных лекарственных средств особое место занимает фармакологический агент метаболической (биоэнергетической) направленности — экзогенный фосфокреатин (ФК), препарат с более чем 30-летней историей. Первая работа, обосновывающая его возможное практическое применение и включенная в данный обзор, датируется 1979 г. [17]. Новый виток интереса к нему обусловлен появлением убедительных доказательств высокого уровня, подтверждающих его кардиопротективную эффективность в различных клинических ситуациях. Так, Landoni G. с соавт. и Mingxing F. с соавт. [18, 19] показали, что в общей популяции больных с заболеваниями сердца (более 3000 клинических наблюдений) ФК обеспечивает снижение общей летальности в 3 раза (отношение шансов (ОШ) 0,71; 95%-й доверительный интервал (95% ДИ); р = 0,04); снижение частоты тяжелых аритмий (ОШ 0,42; 95% ДИ 0,27–0,66; р
Источник