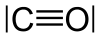- Что значит изоэлектронные частицы
- Изоэлектронность — Isoelectronicity
- Метод молекулярных орбиталей
- Основные положени я метода молекулярных орбиталей (МО ЛКАО)
- Электронное строение гомоядерных двухатомных молекул и ионов
- Электронное строение гетероядерных молекул и ионов
- Задачи для самостоятельного решения
Что значит изоэлектронные частицы
Такие характеристики атомов, как их радиус, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления, связаны с электронным строением атома.
За радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус.
Элементы одного и того же периода имеют одинаковое количество электронных слоев. Поэтому в одном периоде по мере увеличения заряда ядра увеличивается сила притяжения электронов к ядру, что вызывает уменьшение радиуса атома. Например, при переходе от лития к фтору заряд ядра атома растет от `3` до `9`, а радиус атома постепенно уменьшается — от `0,152` до `0,064` нм. Согласно закону Кулона, притя-жение электронов ядром в пределах периода слева направо увеличивается, а, следовательно, уменьшается способность атомов элементов отдавать электроны, то есть проявлять восстановительные (металлические) свойства. Окислительные (неметаллические) свойства, напротив, становятся все более выраженными и достигают максимального проявления у фтора.
Если атом лития легко теряет свой единственный `2s^1`-электрон, то у последующих элементов второго периода тенденция к потере электронов ослабевает по мере увеличения числа электронов. Так, у атома углерода `(1s^2 2s^2 2p^2)` способность отдавать электроны или присоединять их до полного заполнения электронного слоя примерно одинакова. У атома кислорода преобладает стремление к присоединению электронов, а фтор вообще не проявляет восстановительных свойств и является единственным элементом, который в химических реакциях не проявляет положительных степеней окисления.
В главных подгруппах с увеличением заряда ядра атома элемента увеличивается радиус атома элемента, так как в этом направлении возрастает число электронных слоев в атоме элемента. Поэтому в главной подгруппе сверху вниз нарастают металлические (восстановительные) свойства элементов.
В побочных подгруппах при переходе от первого элемента ко второму происходит увеличение радиуса атома элемента за счет добавления еще одного электронного слоя, а при переходе от второго элемента к третьему — даже некоторое уменьшение. Это объясняется `f`-(лантаноидным) сжатием.
Поэтому в побочных подгруппах с увеличением заряда ядра уменьшаются металлические свойства (за исключение побочной подгруппы третьей группы).
Радиус катиона меньше радиуса соответствующего ему атома, причём с увеличением положительного заряда катиона его радиус уменьшается. Наоборот, радиус аниона всегда больше радиуса соответствующего ему атома. Изоэлектронными называют частицы (атомы и ионы), имеющие одинаковое число электронов. В ряду изоэлектронных ионов радиус снижается с уменьшением отрицательного и возрастанием положительного радиуса иона. Такое уменьшение имеет место, например в ряду: `»O»^(2-)`, `»F»^-`, `»Na»^+`, `»Mg»^(2+)`, `»Al»^(3+)`.
энергия, необходимая для отрыва электрона от атома, находящегося в основном состоянии. Она характеризует восстановительные (металлические) свойства атомов и обычно выражается в электронвольтах `(1 «эВ»=96,485 «кДж»//»моль»)`. В периоде слева направо энергия ионизации возрастает с увеличением заряда ядра и уменьшением радиуса атомов. В главных подгруппах сверху вниз она уменьшается, т. к. увеличивается расстояние электрона до ядра и возрастает экранирующее действие внутренних электронных слоев.
Наименьшее значение энергии ионизации имеют щелочные металлы, поэтому они обладают ярко выраженными металлическими свойствами, наибольшая величина энергии ионизации у инертных газов.
энергия, выделяющаяся при присоединении электрона к нейтральному атому. Характеризует окисли-тельные (неметаллические) свойства атомов. Как и энергия ионизации, обычно выражается в электронвольтах. Наибольшее сродство к электрону — у галогенов, наименьшее — у щелочных металлов.
Самый сильный окислитель из всех элементарных окислителей — фтор (он обладает и самым малым атомным радиусом из всех элементов `»VII»` группы).
Следует отметить, что в отличие от ионизации присоединение двух и более электронов к атому энергетически затруднено, и многозарядные одноатомные отрицательные ионы, такие как `»N»^(3-)`, или `»O»^(2-)`, в свободном состоянии не существуют.
Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями `s^2` и `s^2p^6`. У остальных элементов в таблице Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
понятие, позволяющее оценить способность атома оттягивать на себя электронную плотность при образовании химического соединения. Согласно одному из определений (Малликен), электроотрицательность можно определить как полусумму энергии ионизации и сродства к электрону:
Относительная ЭО (OЭO) фтора по Полингу принята равной четырём. Наименьшими ОЭО обладают элементы `»IА»` подгруппы `(0,7 – 1,0)`, большими азот и хлор `(3)`, кислород `3,5`) и фтор. ОЭО `d` -элементов лежит в пределах `1,2 – 2,2`, а `f` -элементов `1,1 – 1,2`.
В периодах ЭО растёт, а в группах уменьшается с ростом `»Z»`, то есть растёт от `»Cs»` к `»F»` по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сродство элементов.
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
Под степенью окисления понимают условный заряд атома элемента в соединении, вычисленный из предположения, что соединение состоит из ионов и валентные электроны оттянуты к наиболее электроотрицательному атому. Иначе говоря, степень окисления показывает, сколько своих электронов атом отдал (положительная), либо притянул к себе чужих (отрицательная).
Напишите электронную конфигурацию атома фосфора и составьте орбитальную диаграмму его валентного уровня. Определите все его возможные степени окисления. Напишите электронные конфигурации всех его заряженных частиц. Расположите данные частицы в порядке увеличения радиуса.
Фосфор находится в третьем периоде, пятой группе, главной подгруппе. Следовательно, его электронная оболочка состоит из трёх уровней. Валентный уровень состоит из внешних `s`- и `p`-подуровней (на это указывает главная группа). Всего валентных электронов у фосфора пять (номер группы `5`). Конфигурация атома $$ <>_<31>\mathrm
1^<2>2^<2>2
^<6>3^<2>3
^<3>$$
Орбитальная диаграмма валентного уровня:
Для того, чтобы принять конфигурацию благородного газа, фосфор может либо принять `3` электрона (тогда он примет конфигурацию аргона), либо отдать все свои валентные пять электронов (тогда он примет конфигурацию неона). Таким образом, низшая степень окисления фосфора равна `(–3)`, а высшая – `(+5)`.
Для проявления степени окисления `(+5)` фосфор поглощает квант энергии и распаривает свои `3s` -электроны в пределах энергетического уровня на `3d` -подуровень:
Однако кроме этих крайних степеней окисления фосфор может проявлять ещё и промежуточную степень окисления `(+3)` за счёт отдачи своих непарных валентных электронов с `p`-подуровня.
Конфигурации заряженных частиц фосфора:
Расположим данные заряженные частицы в порядке возрастания радиуса. Следует помнить, что число протонов в ядре не изменилось, а, значит, отрицательно заряженная частица, у которой электронов больше, чем протонов, будет иметь бóльший радиус, и чем ниже заряд частицы, тем больше её радиус. И наоборот, чем выше заряд частицы, тем меньше её радиус, так как силы притяжения электронов к ядру у такой частицы преобладают над силами межэлектронного отталкивания:
Источник
Изоэлектронность — Isoelectronicity
Изоэлектронность — это явление, наблюдаемое, когда две или более молекул имеют одинаковую структуру (положения и связи между атомами ) и одинаковые электронные конфигурации , но различаются тем, какие конкретные элементы находятся в определенных местах в структуре.
Это определение иногда называют изоэлектронностью валентности . Иногда определения могут быть не такими строгими, иногда требуя идентификации общего количества электронов, а вместе с ним и всей электронной конфигурации . Более обычно, определения шире, и могут распространяться на позволяя различного числа атомов в видах сравниваемым.
Важность концепции заключается в идентификации существенно связанных видов в виде пар или серий. Можно ожидать, что изоэлектронные частицы продемонстрируют полезную последовательность и предсказуемость в своих свойствах, поэтому идентификация соединения как изоэлектронного с уже охарактеризованным предлагает ключи к возможным свойствам и реакциям (различия в свойствах, таких как электроотрицательность атомов в изоэлектронных частицах, могут влиять на реакционную способность).
В квантовой механике , водородоподобных атомов являются ионы с только один электрон , такие как Li 2+
. Эти ионы можно описать как изоэлектронные водороду .
Источник
Метод молекулярных орбиталей
Материалы с портала onx.distant.ru
Основные положения метода молекулярных орбиталей
Электронное строение гомоядерных двухатомных молекул и ионов
Электронное строение гетероядерных молекул и ионов
Задачи для самостоятельного решения
Основные положени я метода молекулярных орбиталей (МО ЛКАО)
- В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) – связывающую, энергия которой ниже, чем энергия АО, и разрыхляющую, энергия которой выше энергии АО.
- Электроны в молекуле располагаются на молекулярных орбиталях в соответствии с принципом Паули и правилом Хунда.
- Отрицательный вклад в энергию химической связи электрона, находящегося на разрыхляющей орбитали больше, чем положительный вклад в эту энергию электрона на связывающей МО.
- Кратность связи в молекуле равна деленной на два разности числа электронов, находящихся на связывающих и разрыхляющих МО.
- С повышением кратности связи в однотипных молекулах увеличивается ее энергия связи и уменьшается ее длина.
Если при образовании молекулы из атомов электрон займет связывающую МО, то полная энергия системы понизится, т.е. образуется химическая связь. При переходе электрона на разрыхляющую МО энергия системы повысится, система станет менее устойчивой (рис. 1).
Рис. 1. Энергетическая диаграмма образования молекулярных орбиталей из двух атомных орбиталей.
Молекулярные орбитали, образованные из s-атомных орбиталей, обозначаются s s. Если МО образованы рz-атомными орбиталями – они обозначаются s z. Молекулярные орбитали, образованные рx— и рy-атомными орбиталями, обозначаются π x и π y соответственно.
При заполнении молекулярных орбиталей электронами следует руководствоваться следующими принципами:
- Каждой МО отвечает определенная энергия. Молекулярные орбитали заполняются в порядке увеличения энергии.
- На одной молекулярной орбитали может находиться не более двух электронов с противоположными спинами.
- Заполнение молекулярных квантовых ячеек происходит в соответствии с правилом Хунда.
Экспериментальное исследование (изучение молекулярных спектров) показало, что энергия молекулярных орбиталей возрастает в следующей последовательности:
σ 1s z z.
Звездочкой (*) в этом ряду отмечены разрыхляющие молекулярные орбитали.
У атомов В, С и N энергии 2s- и 2p-электронов близки и переход 2s-электрона на молекулярную орбиталь σ 2pz требует затраты энергии. Следовательно, для молекул В2, С2, N2 энергия орбитали σ 2pz становится выше энергии орбиталей π 2рх и π 2ру:
При образовании молекулы электроны располагаются на орбиталях с более низкой энергией. При построении МО обычно ограничиваются использованием валентных АО (орбиталей внешнего слоя), так как именно они вносят основной вклад в образование химической связи.
Электронное строение гомоядерных двухатомных молекул и ионов
Процесс образования частицы H2 + можно представить следующим образом:
Таким образом, на связывающей молекулярной σ -орбитали располагается один электрон.
Кратность связи равна полуразности числа электронов на связывающих и разрыхляющих орбиталях. Значит, кратность связи в частице H2 + равна (1 – 0):2 = 0,5. Метод ВС, в отличие от метода МО, не объясняет возможность образования связи одним электроном.
Молекула водорода имеет следующую электронную конфигурацию:
H2 [(σ 1s) 2 ]
В молекуле H2 имеется два связывающих электрона, значит, связь в молекуле одинарная.
Молекулярный ион H2 — имеет электронную конфигурацию:
H2 — [(σ 1s) 2 (σ *1s) 1 ]
Кратность связи в H2 — составляет (2 – 1):2 = 0,5.
Рассмотрим теперь гомоядерные молекулы и ионы второго периода.
Электронная конфигурация молекулы Li2 следующая:
2Li (K2s) Li2 [KK*(σ 2s) 2 ]
Молекула Li2 содержит два связывающих электрона, что соответствует одинарной связи.
Процесс образования молекулы Ве2 можно представить следующим образом:
2 Ве(K2s 2 ) Ве2 [KK*(σ 2s) 2 (σ *2s) 2 ]
Число связывающих и разрыхляющих электронов в молекуле Ве2 одинаково, а поскольку один разрыхляющий электрон уничтожает действие одного связывающего, то молекула Ве2 в основном состоянии не обнаружена.
В молекуле азота на орбиталях располагаются 10 валентных электронов. Электронное строение молекулы N2:
N2 [KK*(σ 2s) 2 (π *2s) 2 (π2px) 2 (π2py) 2 (σ 2pz) 2 ]
Поскольку в молекуле N2 восемь связывающих и два разрыхляющих электрона, то в данной молекуле имеется тройная связь. Молекула азота обладает диамагнитными свойствами, поскольку не содержит неспаренных электронов.
На орбиталях молекулы O2 распределены 12 валентных электронов, следовательно, эта молекула имеет конфигурацию:
Рис. 2. Схема образования молекулярных орбиталей в молекуле О2 (показаны только 2р-электроны атомов кислорода)
В молекуле O2, в соответствии с правилом Хунда, два электрона с параллельными спинами размещаются по одному на двух орбиталях с одинаковой энергией (рис. 2). Молекула кислорода по методу ВС не имеет неспаренных электронов и должна обладать диамагнитными свойствами, что не согласуется с экспериментальными данными. Метод молекулярных орбиталей подтверждает парамагнитные свойства кислорода, которые обусловлены наличием в молекуле кислорода двух неспаренных электронов. Кратность связи в молекуле кислорода равна (8–4):2 = 2.
Рассмотрим электронное строение ионов O2 + и O2 — . В ионе O2 + на его орбиталях размещаются 11 электронов, следовательно, конфигурация иона следующая:
Кратность связи в ионе О2 + равна (8–3):2 = 2,5. В ионе O2 — на его орбиталях распределены 13 электронов. Этот ион имеет следующее строение:
Кратность связи в ионе О2 — равна (8 – 5):2 = 1,5. Ионы О2 — и О2 + являются парамагнитными, так как содержат неспаренные электроны.
Электронная конфигурация молекулы F2 имеет вид:
Кратность связи в молекуле F2 равна 1, так как имеется избыток двух связывающих электронов. Поскольку в молекуле нет неспаренных электронов, она диамагнитна.
В ряду N2, O2, F2 энергии и длины связей в молекулах составляют:
| Молекула | N2 | O2 | F2 |
| Избыток связывающих электронов | 6 | 4 | 2 |
| Энергия связи, кДж/моль | 941 | 494 | 155 |
| Длина связи, пм | 110 | 121 | 142 |
Увеличение избытка связывающих электронов приводит к росту энергии связи (прочности связи). При переходе от N2 к F2 длина связи возрастает, что обусловлено ослаблением связи.
В ряду О2 — , О2, О2 + кратность связи увеличивается, энергия связи также повышается, длина связи уменьшается.
Электронное строение гетероядерных молекул и ионов
Изоэлектронными частицами называют частицы, содержащие одинаковое число электронов. Например, к изоэлектронным частицам относятся N2, CO, BF, NO + , CN- .
Согласно методу МО электронное строение молекулы СО аналогично строению молекулы N2:
CO [KK*(σ 2s) 2 (σ *2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ]
На орбиталях молекулы СО располагаются 10 электронов (4 валентных электрона атома углерода и 6 валентных электронов атома кислорода). В молекуле СО, как и в молекуле N2, связь тройная. Сходство в электронном строении молекул N2 и СО обуславливает близость физических свойств этих веществ.
В молекуле NO на орбиталях распределены 11 электронов (5 электронов атома азота и 6 электронов атома кислорода), следовательно, электронная конфигурация молекулы такова:
NO [KK*(σ 2s) 2 (σ *2s) 2 (π2px) 2 (π2py) 2 (σ 2pz) 2 (π*2px) 1 ] или
NO [KK*(σ 2s) 2 (σ *2s) 2 (π2px) 2 (π2py) 2 (σ 2pz) 2 (π*2py) 1 ]
Кратность связи в молекуле NO равна (8–3):2 = 2,5.
Конфигурация молекулярных орбиталей в ионе NO — :
Кратность связи в этой молекуле равна (8–4):2 = 2.
Ион NO + имеет следующее электронное строение:
NO + [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ]
Избыток связывающих электронов в этой частице равен 6, следовательно, кратность связи в ионе NO + равна трём.
В ряду NO — , NO, NO + избыток связывающих электронов увеличивается, что приводит к возрастанию прочности связи и уменьшению её длины.
Задачи для самостоятельного решения
1. Используя метод МО, установите порядок уменьшения энергии химической связи в частицах:
NF + ; NF — ; NF.
Энергия химической связи уменьшается в ряду:
NF + ; NF; NF — .
2. Используя метод МО, установите порядок увеличения энергии химической связи в частицах:
CO — ; CO; CO + .
Энергия химической связи увеличивается в ряду:
CO + ; CO; CO — .
3. На основе метода МО установите, какие из перечисленных частиц не существуют:
He2; He2 + ; Be2; Be2 + .
Молекулы He2 и Be2 не существуют, так как по методу МО они имеют нулевую кратность связи.
4. Распределите электроны на молекулярных орбиталях для молекулы B2. Определите кратность связи.
B2 [KK*(σ2s) 2 (σ*2s) 2 (π2px) 1 (π2py) 1 ].
Кратность связи в B2 составляет (4–2):2=1.
5. Распределите электроны на молекулярных орбиталях для молекулы N2. Определите кратность связи.
N2 [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ].
Кратность связи в N2 составляет (8–2):2=3.
6. Используя метод МО, определите кратность связи в молекуле С2.
Электроны располагаются на молекулярных орбиталях следующим образом:
С2 [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 ].
Кратность связи в С2 составляет (6–2):2=2.
7. На основе метода МО объясните, почему не существует молекулы Ne2.
Электроны располагаются на молекулярных орбиталях следующим образом:
Ne2 [KK*(σ 2s) 2 (σ *2s) 2 (σ 2pz) 2 (π2px) 2 (π2py) 2 (π*2px) 2 (π*2py) 2 (σ* 2pz) 2 ].
Кратность связи в Ne2 составляет (8–8):2=0.
Нулевая кратность связи объясняет тот факт, что данная молекула не существует.
8. Объясните уменьшение энергии связи при переходе от нейтральной молекулы N2 к иону N2 — .
Электроны располагаются на молекулярных орбиталях следующим образом:
N2 [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ];
N2 — [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 (π*2px) 1 ].
Кратность связи в N2 составляет (8–2):2=3;
Кратность связи в N2 — составляет (8–3):2=2,5.
Уменьшение энергии связи при переходе от нейтральной молекулы N2 к иону N2 —
связано с уменьшением кратности связи.
9. Распределите электроны на молекулярных орбиталях для иона CN — . Определите кратность связи в этом ионе.
CN — [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ].
Кратность связи в CN — составляет (8–2):2=3.
10. Используя метод МО определите, как изменяется длина связи и энергия связи в ряду CN + , CN, CN — .
Электроны располагаются на молекулярных орбиталях следующим образом:
CN + [KK*(σ2s) 2 (σ*2s 2 (π2p x ) 2 (π2p y ) 2 ];
CN [KK*(σ2s) 2 (σ*2s) 2 (π2p x ) 2 (π2p y ) 2 (σ2p z ) 1 ];
CN — [KK*(σ2s) 2 (σ*2s) 2 (π2p x ) 2 (π2p y ) 2 (σ2p z ) 2 ].
Избыток связывающих электронов в CN + , CN, CN — соответственно составляет 4, 5, 6.
Увеличение избытка связывающих электронов приводит к увеличению энергии связи
(прочности связи). При переходе от CN + к CN — длина связи уменьшается,
что обусловлено усилением прочности связи.
Источник