Гибридизация электронных орбиталей: sp3, sp2 и sp.
Гибридизация sp3, sp2 и sp в органической химии с практическими примерами.
Введение
Зачем нам теория гибридизации?
Вот один ответ на это. Экспериментально подтверждено, что атом углерода в метане (CH4) и других алканах имеет тетраэдрическую структуру.
- Напомним, что в тетраэдрической геометрии все углы имеют 109,5°, а связи имеют одинаковую длину.
- Помните также, что ковалентные связи образуются в результате перекрывания орбиталей и совместного использования двух электронов между атомами.
Итак, чтобы предсказать валентность и геометрию атома углерода, мы рассмотрим его электронную конфигурацию и орбитали.
Валентные электроны — те, которые находятся на 2s и 2p орбиталях, и те, которые участвуют в связывании и химических реакциях.
Из конфигурации электронов видно, что невозможно создать четыре одинаковые по длине, энергии и всем остальным параметрам связи, потому что одна из орбиталей является сферической s, а остальные три — p — орбиталями.
- И именно здесь мы нуждаемся в теории, которая может помочь нам объяснить известную геометрию и валентность атома углерода во многих органических молекулах.
Гибридизация — это теория, которая используется для объяснения определенных молекулярных геометрий, которые в противном случае были бы невозможны.
Теперь давайте посмотрим, как это происходит, используя метан в качестве примера.
На первом этапе один электрон перепрыгивает с 2s на 2p орбиталь. Это приводит к возбужденному состоянию углерода:
Обратите внимание, что электрон движется вперед, так как p — оболочка выше по энергии, чем s — оболочка, и это не является энергетически выгодным, но мы увидим, как это компенсируется на следующем этапе, когда орбитали смешаны (гибридизованы).
- Таким образом, на следующем этапе s и p — орбитали углерода в возбужденном состоянии гибридизуются с образованием четырех одинаковых по размеру, форме и энергии орбиталей.
Количество гибридных орбиталей всегда совпадает с количеством смешанных орбиталей.
Итак, четыре орбитали (одна 2s + три 2p) смешаны, и в результате получается четыре sp3 орбитали. Это гибридные орбитали, которые похожи на s и p — орбитали.
- Таким образом, мы называем их sp3, потому что они образованы из одной s орбитали и трех p орбиталей.
Образование этих вырожденных гибридных орбиталей компенсирует энергию подъема s — p — перехода, поскольку они имеют меньшую энергию, чем p — орбитали.
Четыре sp3 — гибридизованные орбитали располагаются в тетраэдрической геометрии и образуют связи, перекрывая s — орбитали четырех водородов: это объясняет симметричную геометрию метана (CH4) , где все связи имеют одинаковую длину и угол связи.
Все четыре связи C — H в метане являются одинарными связями, которые образуются путем лобового (или конечного) перекрытия sp3 — орбиталей углерода и s — орбитали каждого водорода.
Связи, которые образуются путем встречного перекрытия орбиталей, называются σ (сигма) связями, потому что электронная плотность сосредоточена на оси, соединяющей атомы C и H.
Этан — CH3-CH3 и другие алканы
Если вместо одного водорода мы подключим другой sp3 — гибридизированный углерод, мы получим этан:
И, следовательно, во всех алканах существует сигма — связь между атомами углерода и атомами углерод — водород, и атомы углерода sp3 гибридизуются с тетраэдрической геометрией:
Чтобы обобщить это, любой атом с четырьмя группами (или атом или одинокая пара) является sp3 гибридизированным.
- И если посмотреть на это, то, чтобы четыре группы были как можно дальше друг от друга, как мы знаем из теории отталкивания электронных пар, группы должны находиться на одинаковых четырех орбиталях, что возможно только в гибридизации sp3.
Например, какая гибридизация кислорода в следующей молекуле?
Кислород связан с двумя атомами и имеет две неподеленные пары. Всего — четыре группы, и именно поэтому он sp3 гибридизован.
Когда атом углерода находится в возбужденном состоянии, sp3 — гибридизация не является единственным вариантом смешивания орбиталей.
Гибридизация sp2 происходит, когда s — орбиталь смешивается только с двумя p — орбиталями, в отличие от трех p — орбиталей в гибридизации sp3.
- Итак, три орбитали смешаны, и в результате получаются три гибридные орбитали, которые называются sp2 — гибридными орбиталями.
Получающиеся 3 sp2 — орбитали затем располагаются в тригональной плоской геометрии (120°).
Важным отличием здесь по сравнению с гибридизацией sp3 является неучтенная (негибридизированная) p — орбиталь, которая не участвовала в гибридизации. Эта орбиталь расположена под углом 90° к плоскости тригонального расположения трех орбиталей sp2:
Гибридизация углерода в этилене — C2H4
Два sp2 — гибридизированных атома углерода могут образовывать сигма — связь , перекрывая одну из трех sp2 — орбиталей и связываясь с двумя атомами водорода каждый, и два атома водорода образуют сигма — связь с каждым углеродом, перекрывая их s — орбитали с двумя другими sp2 — орбиталями.
Это создает три связи для каждого углерода и одну орбиталь слева.
- Помните, стандартная валентность углерода равна четырем, и ей положено иметь четыре связи.
Эта четвертая связь образована параллельным перекрытием двух 2p — орбиталей на каждом атоме углерода. Этот тип связи путем параллельного перекрытия орбиталей называется π-связью.
Итак, два атома углерода в этилене, который является первым членом семейства алкенов, имеют двойную связь.
- В каждой двойнойсвязи есть одна сигма и одна π-связь.
Вот некоторые ключевые параметры гибридизации sp2 и двойных связей, которые вам необходимо знать:
* Все атомы на двойной связи находятся в одной плоскости;
* Угол между атомами составляет 120°;
* Угол между плоскостью и p — орбиталями составляет 90°.
При sp — гибридизации s — орбиталь углерода в возбужденном состоянии смешивается только с одной из трех 2p — орбиталей.
Это называется sp — гибридизацией, потому что две орбитали (одна s и одна p) смешаны:
Получающиеся две sp — гибридные орбитали затем располагаются в линейной геометрии (180°), а две негибридизованные 2p — орбитали располагаются под углом 90°:
Давайте посмотрим, как это происходит в ацетилене — C2H2 . Два атома углерода образуют сигма — связь, перекрывая sp — орбитали.

Один водород связывается с каждым атомом углерода, перекрывая его орбиталь с другой орбиталью.
Две p — орбитали каждого углерода перекрываются, образуя две π-связи.
Основные параметры sp гибридизации и тройной связи:
* Все атомы имеют линейную структуру;
* Угол между атомами составляет 180°;
* В тройной связи есть одна σ (сигма) и две π (пи) связи.
Гибридизация других элементов
В заключение, все, что мы обсуждали выше, относится не только к углероду.
Теория гибридизации работает с тем же принципом для всех других важных элементов в органической химии, таких как кислород, азот, галогены и многие другие.
Источник
Химия. 11 класс
§ 14.1. Гибридизация атомных орбиталей
Изучая строение молекул органических веществ, вы узнали, что все молекулы имеют определённое пространственное строение. Это является следствием направленности ковалентных связей. Ковалентные связи располагаются в пространстве в направлении максимального перекрывания электронных облаков. Угол между связями — валентный угол — зависит от числа атомных орбиталей данного атома, принимающих участие в образовании σ-связей .
Для объяснения и предсказания пространственного строения молекул как органических, так и неорганических веществ, а также сложных ионов (например, , ) используют представление о гибридизации атомных орбиталей.
Термин гибрид вам известен из биологии и означает организм, полученный вследствие скрещивания. По аналогии с этим в теории химической связи вводят понятие гибридная орбиталь. Она рассматривается как результат своеобразного «скрещивания» разных по форме, но близких по энергии атомных орбиталей.
Теоретические представления о гибридизации атомных орбиталей построены на следующих положениях.
1. При образовании ковалентных σ-связей исходные валентные s— и p-орбитали приобретают одинаковую форму и энергию, превращаясь в гибридные орбитали.
Гибридизацией называют перераспределение электронной плотности орбиталей свободного атома при образовании молекулы с формированием гибридных орбиталей.
2. Гибридные орбитали похожи друг на друга и отличаются от исходных s— и p-орбиталей своей энергией и формой электронного облака. В результате гибридизации энергия гибридных атомных орбиталей выравнивается. Гибридные орбитали более вытянуты в пространстве в сторону соседних атомов. Это обеспечивает их более полное перекрывание с атомными орбиталями соседних атомов и, соответственно, более прочные связи с ними.
3. В гибридизации участвуют разные по форме, но близкие по энергии атомные орбитали. Это означает, что в гибридизации могут принимать участие, например, 2s-орбиталь с 2p-орбиталью , но не 1s-орбиталь с 2p-орбиталью .
4. Число образующихся гибридных орбиталей равно суммарному числу исходных орбиталей, принимающих участие в гибридизации.
5. Гибридные орбитали участвуют в образовании только σ-связей .
6. π-Связи образуются за счёт бокового перекрывания негибридных орбиталей.
7. Гибридные орбитали располагаются в пространстве на максимальном удалении друг от друга.
8. В гибридизации принимают участие не только орбитали, которые образуют σ-связи , но и s— и р-орбитали с неподелённой парой электронов того же энергетического уровня. Гибридные орбитали с неподелённой парой электронов занимают больший объём, чем связывающая пара электронов между двумя атомами. По этой причине неподелённые пары обладают максимальной отталкивающей силой, что приводит к уменьшению валентного угла между орбиталями со связывающими электронами.
Различают несколько типов гибридизации. Каждому из них соответствует определённая ориентация гибридных орбиталей в пространстве (табл. 12.1).
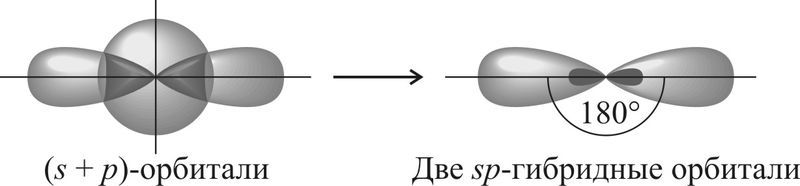
Так, если атом образует две σ-связи за счёт его одной s— и одной p-орбиталей , то образуется две sp-гибридные орбитали, которые ориентированы друг к другу под углом 180°. Такой тип гибридизации называют sp-гибридизацией .
Если атом образует три σ-связи за счёт его одной s— и двух p-орбиталей , то угол между образующимися тремя sp 2 -гибридными орбиталями составляет 120°. Такой тип гибридизации называют sp 2 -гибридизацией .
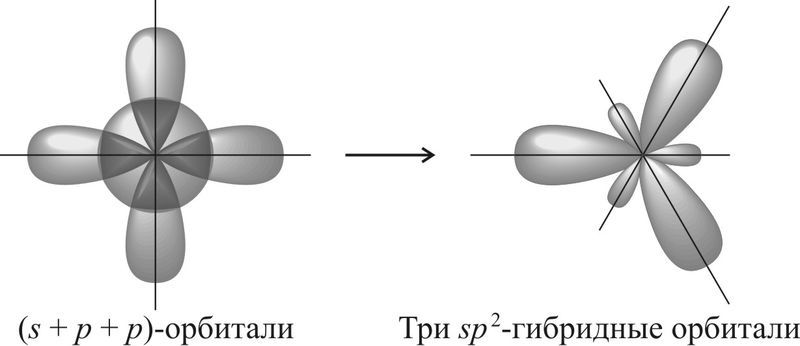
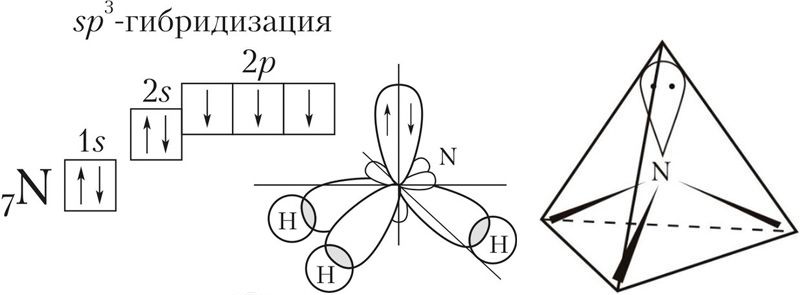
Если атом образует четыре σ-связи за счёт его одной s— и трёх p-орбиталей , то угол между образующимися четырьмя sp 3 -гибридными орбиталями составляет 109,5°. Такой тип гибридизации называют sp 3 -гибридизацией .
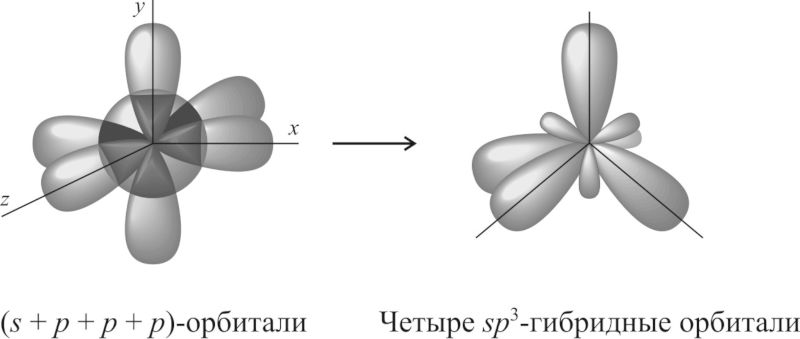
У элементов 3-го и последующих периодов в образовании гибридных атомных орбиталей могут принимать участие и d-орбитали .
Таким образом, расположение в пространстве гибридных орбиталей определяет углы между σ-связями , то есть пространственное строение молекул и сложных ионов.
Характеристики различных типов гибридизации и примеры молекул и сложных ионов, пространственное строение которых отвечает этим типам гибридизации, приведены в таблице 12.1.
Таблица 12.1. Характеристики sp— , sp 2 — и sp 3 -гибридизации валентных орбиталей центрального атома
| Исходные атомные орбитали | Число гибридных орбиталей | Тип гибридизации | Валентный угол* | Геометрическая фигура, отвечающая типу гибридизации центрального атома, и форма структурных единиц | Примеры |
|---|---|---|---|---|---|
| s + p | Две | sp | 180° | , , , ,  | |
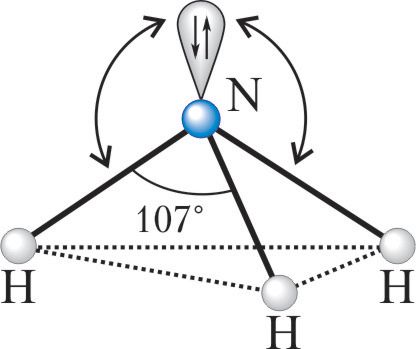
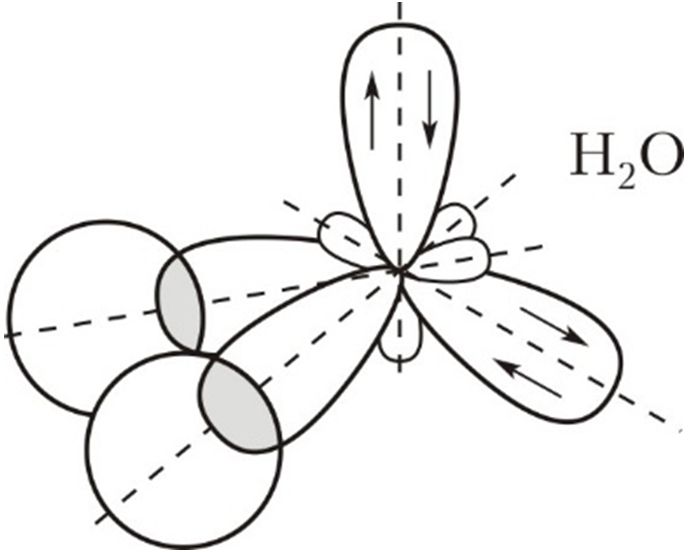
| s + p + p + p | Четыре | sp 3 | 109,5° | * Указан идеальный валентный угол. В реальных структурах вследствие отталкивания неподелённых электронных пар валентный угол может отклоняться от идеального. Рассмотрим, как можно использовать представление о гибридизации атомных орбиталей для предсказания и объяснения формы молекул неорганических веществ. Пример 1. Валентный угол в молекуле аммиака составляет 107, а ионе аммония — 109,5°. Используя представление о гибридизации атомных орбиталей атома азота, объясните наблюдаемые различия в значениях валентных углов в NH3 и . В молекуле аммиака азот является центральным атомом и образует три ковалентные связи с атомами водорода по обменному механизму. Если бы в образовании ковалентных связей участвовали исходные гантелеобразные р-орбитали азота, то угол между связями должен был составлять 90°. Объяснить действительный валентный угол в аммиаке можно, если использовать представление о гибридизации атомных орбиталей. У атома азота на валентном слое имеется три неспаренных электрона на р-орбиталях и пара электронов на s-орбитали . При образовании химических связей все эти орбитали ( s + 3p ) подвергаются гибридизации с образованием четырёх sp 3 -гибридных орбиталей, которые в идеальном случае должны были бы располагаться по вершинам тетраэдра под углом друг к другу в 109,5°. Однако, из-за того что на одной из гибридных орбиталей имеется неподелённая пара электронов, которая отталкивает орбитали со связывающими электронами, валентный угол уменьшается до 107. В связи с тем что орбиталь с неподелённой парой электронов не входит в описание взаимного расположения атомов, принято говорить, что молекула аммиака имеет форму треугольной пирамиды с основанием в виде правильного треугольника из атомов Н—Н—Н и вершиной — атомом N. При присоединении к молекуле аммиака катиона водорода искажение валентных углов устраняется. Пример 2. В соответствии с экспериментальными данными валентный угол Н—O—Н в молекуле воды составляет 104,5°, то есть молекула воды имеет угловое строение. Используя представление о гибридных орбиталях, объясните пространственное строение молекулы воды. В молекуле воды центральный атом кислорода образует две σ-связи с атомами водорода. Остальные электроны кислорода, расположенные на валентном электронном слое, образуют две неподелённые пары. В этом случае можно говорить об образовании четырёх гибридных орбиталей ( s + 3p ) и, соответственно, о sp 3 -гибридизации орбиталей атома кислорода. Как и в случае молекулы аммиака, гибридные орбитали ориентированы по углам тетраэдра, однако орбитали с двумя неподелёнными парами электронов отталкивают пары электронов, образующих химические связи О—Н . Это уменьшает валентный угол Н—O—Н . Он становится равным 104,5°, то есть меньше тетраэдрического (109,5°): Неподелённые пары электронов не во всех соединениях обладают сильным отталкивающим действием на электроны химической связи. Например, в спиртах валентный угол Н—O—C составляет 107–109° и мало отличается от тетраэдрического. В молекуле серной кислоты угол Н—O—S тоже составляет 108,5° и также мало отличается от тетраэдрического. В простых эфирах, например H3C—O—CH3 , угол C—O—C составляет 109–112° и также близок к тетраэдрическому. При определении пространственного строения молекул всегда надо помнить, что, как всякое модельное представление, понятие о гибридизации имеет ограниченную область применения. Если при определении формы молекул, образуемых элементами 2-го периода, гибридизация даёт хороший прогноз, то для элементов периодов с большими номерами её предсказательные возможности не всегда совпадают с экспериментальными данными. Например, в молекулах воды и сероводорода атомы кислорода и серы, с точки зрения возможного типа гибридизации, должны находиться в состоянии sp 3 -гибридизации . Однако в молекуле воды валентный угол близок к тетраэдрическому, а в молекуле сероводорода он составляет 92°. Тем не менее валентный угол в молекуле H3C—S—H составляет уже 99,5°, в молекуле Cl—S—Cl — 103°, а у циклической молекулы S8 угол S—S—S равен 108°, что весьма близко к 109,5°. Источник |